高效植酸盐降解细菌水拉恩氏菌JZ-GX1的植酸酶特性研究
李桂娥,吴小芹
(南京林业大学 森林资源与环境学院,江苏 南京 210037)
磷是植物生长发育所必须的第二大元素,植物所需的磷素营养主要来源于根际土壤。土壤中P主要由无机磷和有机磷两大部分组成,其总含量在0.02%~0.2% (P2O50. 05%~0. 46% )之间。调查显示,在全球土壤中,有机磷含量约占总磷含量的50%,在牧草土壤中甚至高达80%[1]。在中国土壤中,植酸类磷以及它们与金属离子形成的各种形式的衍生物(植酸盐)是土壤中有机磷的主要存在形式,其含量占总有机磷含量的20%~60%,对土壤肥力和植物营养有重要的影响[2]。而这部分有机磷必须在酶的作用下矿化降解成无机磷才能被植物吸收利用,是植物可利用磷的重要来源[3-4]。在该过程中,植酸酶发挥着重要作用。事实上,土壤中绝大部分的植酸酶都来源于土壤微生物,微生物是土壤有机磷的转化者。从植物根际或者根际土壤中分离得到的部分微生物,能够分泌胞外植酸酶降解不同类型的植酸盐,这已得到证实[5-7]。
水拉恩氏菌Rahnella aquatilisJZ-GX1,是前期从马尾松根际土壤中筛选获得的高效植酸盐降解菌株,经测定具有较高的植酸酶活性,并且能够显著促进杨树和马尾松的生长[8]。植酸酶作用的主要特点是催化效率高,具有高度的专一性,但酶活性易受到多种因素的调节控制,例如温度、pH和金属离子等,致使酶活性不够稳定,因此对水拉恩氏菌JZ-GX1的植酸酶酶学特性进行研究,是进一步阐明植酸酶的作用机理,以及开发应用植酸盐降解微生物于生产实践的必要过程。本研究对高效植酸盐降解细菌水拉恩氏菌JZ-GX1所产植酸酶在细胞内外的定域表达及酶学特性进行研究,探讨该菌株所产植酸酶的最适反应温度和pH及其在不同温度和pH环境下的稳定性。旨在探究水拉恩氏菌JZ-GX1菌株的最佳酶促反应条件,为其将来作为微生物解磷菌肥的开发应用提供参考依据。
1 材料与方法
1.1 供试菌株
本研究所用菌株水拉恩氏菌(R. aquatilis)JZ-GX1,分离自广西林科院马尾松林根际土壤,现保藏于中国典型培养物保藏中心(CCTCC),保藏编号为NO:M 2012439。经测定该菌株具有较高的植酸酶活性[8]。
1.2 细菌细胞不同部位植酸酶液提取
将菌株JZ-GX1在NA平板(牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸馏水1 L,调节pH值至7.2~7.4)上活化后,接种于液体发酵培养基(植酸钙4 g,葡萄糖10 g, MgCl25 g, KCl 0.2 g,MgSO40.25 g,(NH4)2SO40.1 g,蒸馏水1 L,调节pH至7.2~7.4),置于摇床上振荡培养72 h(180 r/min,28℃),摇培后的细菌培养液待用。细菌不同部位植酸酶提取方法参照楚晓娜等人的研究方法[9],略有修改。主要提取程序如下:
(1)细胞外酶提取:取培养好的细菌菌液50 mL,以5 000 r/min离心(4℃),取上清液,即得S1。将沉淀P1重悬于醋酸缓冲液(0.2 M,pH 5.5),混匀后于5 000 r/min离心(4℃),收获上清S2。合并Sl,S2得到胞外酶。
(2)细胞间质酶提取:再将沉淀P2重悬于渗透休克的蔗糖溶液中,混匀,冰浴30 min,后于8 000 r/min离心10 min(4℃),收获上清得S3。将沉淀P3重悬于10 mL冰水中,混匀,冰浴20 min,8 000 r/min离心10 min(4℃),收获上清S4,合并S3和S4即为细胞间质酶。
(3)胞内酶提取:将沉淀P4重悬于10 mL醋酸缓冲液中(0.2 M,pH 5.5),混匀后,超声波破碎细胞:60%功率,超声波2 s,停3 s,破碎细胞总体时间15 min。8 000 r/min离心l0 min(4℃),收获上清S5即得胞内酶。分别测定各部位的酶活和蛋白含量,通过比较各部位的酶比活力,定位酶在细胞中的分布情况。
1.3 细菌细胞各部位植酸酶活性测定
植酸酶活性测定程序参照彭远义的钒钼酸铵法[10],稍加改动。植酸酶活性计算主要是通过测定降解植酸盐释放出的无机磷的含量。取1 mL植酸钠浓度为1 mM的醋酸缓冲液(0.2 M,pH 5.5 ),加入2 mL细胞各部位的植酸酶提取液或者植酸酶粗酶液(2 mL灭菌蒸馏水作为对照),于37℃下保温反应30 min后,加入两滴10%的三氯乙酸终止反应,然后加入2 mL显色剂,每个处理3个重复,测定反应体系中无机磷的含量。植酸酶酶活性单位(U)定义为:在一定条件下(37℃、pH值2.5或5.5),每分钟从植酸钠溶液中释放出1 μmol无机磷所需要的酶量为一个酶活单位,用U表示。
1.4 待测样品的蛋白质浓度测定
吸取待测液 1 mL(做3次重复),分别放入具塞试管中,加入考马斯亮蓝 G-250 试剂 4 mL,摇匀,放置 2 min后以标准曲线 1 号管作为空白,在 595 nm 波长下比色,用分光光度计(Thermo Spectronic HEλIOSγ,Waltham,Massachusetts,USA)测定吸光度值OD595。将吸光值代入标准曲线,求得待测样品的蛋白质浓度。植酸酶比活力为每毫克蛋白质所具有的酶活力单位数,一般用U/mg蛋白质表示。
1.5 pH值对植酸酶活力的影响和植酸酶pH值稳定性检测
配制pH值3.8、4.8、5.5、5.8的0.2 M醋酸缓冲液和pH值7.0、8.0的0.l mol/L Tris-HCI缓冲液,在不同pH值的缓冲液中测定植酸酶粗酶液的酶活力,获得植酸酶相对活力——pH值曲线。
分别配制不同pH值的缓冲液,pH值范围为1.0~11.0,梯度为1,将植酸酶粗酶液加入到不同pH值缓冲液中,37℃保温处理30 min,再调pH值至5.5,测定酶的残留活性。
1.6 反应温度对植酸酶活性的影响和植酸酶热稳定性检测
在0.2M醋酸缓冲液(pH值5.5)中,于20、30、37、50、60、70、80℃水浴中进行酶反应,测定植酸酶粗酶液的活力,制作温度——活力曲线。
将植酸酶粗酶液在不同温度下(37、50、70、80℃)分别保温一定时间(10、20、40、60、80、100、120 min),再在37℃测定残留酶活性。
1.7 数据处理与分析
数据(每个处理至少3个重复)以表示。用SPSS(SPSS Version 18.0, SPSS Inc.)进行数据统计分析,采用Tukey’s HSD检验对数据进行方差分析,显著性水平a为0.01,概率P值小于显著性水平,则认为存在显著差异,用Exce(lMicrosoft Excel 2007)制作图表。
2 结果与分析
2.1 水拉恩氏菌JZ-GX1 植酸酶的定域分析
分别获得水拉恩氏菌JZ-GX1发酵液的上清液、胞间质和胞内提取物,以植酸钠为底物,测定各部位提取物中的植酸酶活性和蛋白含量,并计算各提取物的植酸酶比活力,结果如表1所示。由表1可知,JZ-GX1菌株胞外、胞间质和胞内的植酸酶比活力存在极显著的差异,胞外酶提取液的比活力显著大于胞内和胞间质提取液,分别是胞间质和胞外酶活力的1 669倍、12 518倍。这表明该菌产生的植酸酶主要分泌到细胞外,为胞外酶,只有少部分留在细胞内和细胞间质,所以直接将该菌的培养液离心收取上清液,即可得到植酸酶粗酶液。

表1 水拉恩氏菌JZ-GX1植酸酶在细胞内的定域†Table 1 Phytase position of Rahnella aquatilis JZ-GX1
2.2 pH值对水拉恩氏菌JZ-GX1植酸酶活力的影响
一般情况下,酶的活力受环境pH的影响极为显著,pH值对水拉恩氏菌JZ-GX1的植酸酶活性的影响见图1,从图可知,当pH值<5.5时,植酸酶的活性随着pH值的升高而升高,植酸酶的最适pH值为5.5左右,当pH值大于7.5时酶活性下降较快,该菌所产植酸酶为酸性植酸酶。
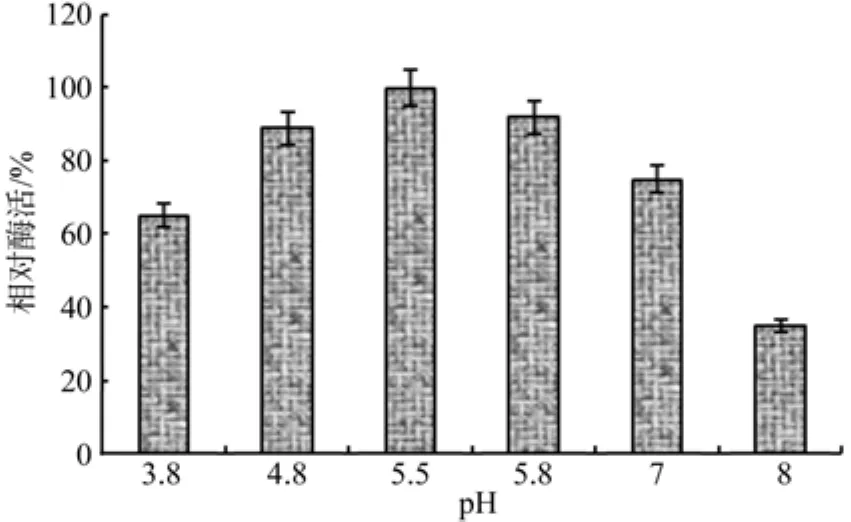
图1 pH对水拉恩氏菌JZ-GX1植酸酶活性的影响Fig.1 Effects of pH on phytase activity of Rahnella aquatilis JZ-GX1
2.3 水拉恩氏菌JZ-GX1植酸酶pH值稳定性
水拉恩氏菌JZ-GX1的植酸酶在不同pH值下保温处理30 min后,再在标准条件下测定植酸酶活性,植酸酶pH值稳定性如图2所示。结果表明,在pH值3.0~7.0的范围内,植酸酶相对活性维持在75%以上,而pH值高于7.0时酶相对活性迅速下降,当pH值为11.0时已无酶活性,这说明该菌所产植酸酶具有较好的耐酸特性,但是不耐碱。2

图2 水拉恩氏菌JZ-GX1植酸酶pH稳定性Fig.2 pH stability of phytase of Rahnella aquatilis JZ-GX1
.4 温度对水拉恩氏菌JZ-GX1植酸酶活性的影响
酶的催化作用都受温度的影响,在最适温度下,酶的活力最高,反应速度也最快。反应温度对植酸酶活性的影响见图3,从图中可知植酸酶的最适反应温度为37 ℃左右,当反应温度在30 ℃和50 ℃之间时,提取液的植酸酶活性较明显,但当温度上升到70 ℃以上时,酶活性下降较快。
2.5 水拉恩氏菌JZ-GX1植酸酶的热稳定性

图3 温度对水拉恩氏菌JZ-GX1植酸酶活性的影响Fig.3 Effects of temperature on phytase activity of Rahnella aquatilis JZ-GX1
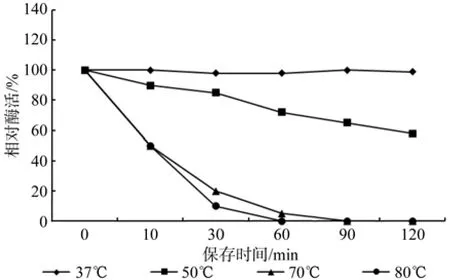
图4 水拉恩氏菌JZ-GX1植酸酶的热稳定性Fig.4 Heat stability of phytase secreted by Rahnella aquatilis JZ-GX1
水拉恩氏菌所产植酸酶的热稳定性如图4所示,结果表明,当处理温度为80 ℃时,保温处理10 min后,酶活性丧失50%左右,60 min时酶活性已完全丧失;70 ℃下,保温处理10 min后,同样酶活性下降50%左右,而酶活性维持时间延长至90 min;当保温温度为50 ℃时,处理90 min后,酶活性仍可以保持65%以上,具有较好的热稳定性,37 ℃下保温120 min后,酶活性基本没有损失。
3 结论与讨论
植酸盐是土壤有机磷存在的主要形式,由于这部分磷极其难溶,所以对植物生长基本是无效的,但若经微生物酶降解,便可被植物吸收利用。植酸酶是一种能高效降解植酸盐的酶类,其在土壤中主要来源于微生物,微生物植酸酶降解植酸盐具有生物催化的特色,其作用效果和催化反应速率受所处环境的影响。掌握微生物分泌植酸酶的主要部位和其酶促反应的最适pH、最适温度,以及其对pH和温度的稳定性等酶学主要特性,有助于更好地利用产植酸酶微生物。
微生物酶可以在活细胞内起催化作用,也可以透过细胞膜作用细胞外的物质,前者称胞内酶,后者称胞外酶。水拉恩氏菌JZ-GX1培养液离心后的上清液植酸酶比活力是最高的,分别是胞间质和胞内酶比活力的1 669倍、12 518倍,这表明,菌株JZ-GX1产生的植酸酶为胞外酶,主要分泌到细胞外起作用。这一结果为植酸酶粗酶液的提取提供了依据,即可通过培养液离心直接获得粗酶液;同时这对于微生物菌肥利用而言这是非常有利的,为其能够应用于生产实践提供了极大的便利和可能。
微生物酶的活性受环境条件的影响十分显著,不同来源的植酸酶反应对最适环境因子的要求差异较大,主要的物理环境条件有:温度、pH值等。相关研究指出:植酸酶的最适pH值一般在2.0~8.0之间,植物来源的植酸酶最适pH值4.0~7.5,大多数在5.0~6.0,细菌来源的植酸酶最适pH值为4.0~8.0,真菌来源的植酸酶最适pH值为2.5~7.0[11]。不同来源的植酸酶的最适温度差异较大。从嗜温微生物Aspergillus terreus和Myceliophthora thermopHila 等分离到的高温植酸酶最适温度在70~80 ℃,有较好的耐热性,但在37℃时的活性却很低[12-14]。文章对水拉恩氏菌JZ-GX1的植酸酶反应的最适pH和最适温度进行,结果表明JZ-GX1菌株所产植酸酶为酸性植酸酶,最适pH为5.5,具有一定的耐酸性,但不耐碱;最适温度为37℃,当温度小于50℃时,该酶具有良好的热稳定性。因此为使由该菌制备的菌肥发挥最大的促生功效,应尽量避免在低温的冬季及pH较高的盐碱土壤施用。
微生物菌肥在野外的应用,受到许多环境因子的影响,要使其在野外应用时也表现出与实验室一样的促生效果则必须充分掌握其促生所需的最适环境,尤其是以微生物酶调节为主的促生效应。本研究为水拉恩氏菌JZ-GX1将来作为微生物菌肥应用于农林业生产,提供了重要的参考依据。
[1] Mclaughlin MJ, Baker TG, James TR,et al. Distribution and forms of phosphorus and aluminium in acidic topsoil under pastures in south-eastern Australia [J]. Aust J Soil Res, 1990, 28:371-385.
[2] 熊顺贵. 基础土壤学[M]. 北京: 中国农业大学出版社, 2001:219-222.
[3] Findenegg GR, Neiemans JA. The effect of phytase on the availability of P from myo-inositol hexaphosphate (phytate) for maize roots [J]. Plant Soil, 1993, 154: 189-196.
[4] Rodriguez H, Fraga R. Phosphate solubilizing bacteria and their role in plant growth promotion [J]. Biotechnol Adv, 1999, 17:319-339.
[5] Tarafdar JC, Marschner H. Dual inoculation with Aspergillus fumigatus and Glomus mossae enhances biomass production and nutrient uptake in wheat (Triticum aestivum L.) supplied with organic phosphorus as Na-phytate [J]. Plant Soil,1995,173:97-102.
[6] Richardson AE, Hadobas PA. Soil isolates of Pseudomonas sp.that utilize inositol phosphates [J]. Can. J. Microbiol., 1997, 43:509-516.
[7] Richardson AE, Hadobas PA, Hayes JE, et al. Utilization of phosphorus by pasture plants supplied with myoinositol hexaphosphate is enhanced by the presence of soil microorganisms [J]. Plant Soil, 2001, 229: 47-56.
[8] Li GE, Wu QX, Ye JR, et al. Isolation and Identification of Phytate-degrading Rhizobacteria with Activity of Improving Growth of Poplar and Masson Pine [J]. World J Microb, DOI:10.1007/s11274-013-1384-3.
[9] 楚晓娜, 张先恩, 陈亚丽, 等. 假单胞菌WBC23 甲基对硫磷水解酶性质的初步研究[J]. 微生物学报, 2003,43(4):453-459.
[10] 彭远义. 植酸酶产生菌的选育及高表达工程菌的构建研究[D].成都:西南农业大学, 2004.
[11] Wang HL, Swain W, Hesseltine CW. Phytase from Aspergillus terreus Part1. Production,Purification and some general properties of the enyme [J]. J Food Sci, 1980, 12: 62-66.
[12] 王尊生. 青霉植酸酶的初步研究[J]. 微生物杂志, 2001,12(3):59-61.
[13] 王 艺,丁贵杰.外生菌根对马尾松幼苗的影响[J].中南林业科技大学学报,2011,31(4):74-78.
[14] 范 超,黎继烈,吴 浩,等.重组巨大芽孢杆菌产青毒素G酰化酶发酵条件研究[J].中南林业科技大学学报,2011,31(7):124-129,135.

