间断和连续给药方式对哌拉西林在组织和血浆分布的动力学研究
王松芝,王晓梅,刘恒戈,张倩,毛元飞 (.新疆医科大学附属肿瘤医院,新疆 乌鲁木齐8300;.新疆医科大学药学院,新疆 乌鲁木齐8300)
对于全球的急救护理医生来说,败血症治疗仍然面临着巨大的挑战,严重败血症和败血性休克的死亡率接近50%,由于其具有高死亡率和发病率,所以改善治疗策略是非常必要的。目前的研究表明,控制病原体的来源,进行早期以及适当的抗生素治疗是较重要的干预措施。随着败血症发病率的日益增高,进一步的研究应该将重点放在优化抗生素治疗上[1]。
败血症患者可能会发生一系列的病理生理变化,这使得抗生素的使用变得更加复杂。Joukhadar等[2]的研究发现,在败血性休克的重症患者中,其外周组织中哌拉西林的浓度明显降低。由于抗生素分布到最容易发生感染的部位是治疗的关键问题,因此可以解释在这些患者为何在使用抗生素后仍保持如此高的发病率和死亡率的原因。
鉴于此,许多研究者建议利用连续输注以优化β-内酰胺抗生素的时间依赖杀菌特征[3]。很多预期和回顾性研究数据表明通过连续输注对重症患者施用β-内酰胺具有一些临床优势。但先前的药动学研究将重点放在了血浆浓度上,很少有研究将重点放在组织分布上。先前的研究也仅对比了间断和连续给药的血浆及组织药动学,而对一些易受感染的组织如腹膜渗出物、肌肉和皮下组织中药物的浓度没有观察[4]。
本研究目的是通过哌拉西林间断和连续输注2种给药模式,观察败血症重症患者在第1天和第2天的药物分布情况,以建立其在血浆和皮下组织浓度的药代动力学模型,为临床用药提供理论依据。
1 资料和方法
1.1 一般资料 研究对象选自在2010 年4 月-2012年1月间在我院的重症监护病房治疗的14例患者。纳入标准为:(1)年龄17~75岁;(2)确诊的或疑似败血症重症患者;(3)其主治医生认为哌拉西林他唑巴坦适合用于治疗,并且方便取样。(4)血浆肌酐浓度低于120μmol·L-1;排除标准:(1)对哌拉西林、哌拉西林他唑巴坦具有确诊的或疑似的变态反应;(2)具有肾功能损害的患者(定义为血浆肌酐>120μmol·L-1)。该项研究获得了本地伦理委员会的批准。同时参加者或其监护人签署了知情同意书。
1.2 治疗方法 对于确诊的或疑似的败血症重症患者,所有的患者都具有留置的导管。
1.2.1 抗生素给药 患者随机地接受哌拉西林他唑巴坦间断治疗或输注治疗。间断治疗方式为:哌拉西林他唑巴坦4 g/0.5 g(辉瑞公司治药,批号293432),静脉输入,临床治疗所应用剂量是每6 h或8 h给4 g/0.5 g哌拉西林他唑巴坦,每次输入时间为30~40 min,连续输注给药方法:(1)第1天:哌拉西林他唑巴坦4 g/0.5 g输注,如无不良反应,立即开始连续输注24 h的8 g/1 g哌拉西林他唑巴坦(哌拉西林333 mg·h-1)。(2)第2天:24 h持续输注12 g/1.5 g哌拉西林他唑巴坦(哌拉西林500 mg·h-1)(试验已经证明哌拉西林他唑巴坦溶液在37 ℃下至少能稳定24 h[12]。)
1.2.2 样品的收集 第1天,在间断和连续输注的3,6,15,0,30,45,60,90,120,210,360,480 min收集血液样品。第2天,在开始新的输注前和开始新的输注后的5,10,20,30,60,120,180,240,480 min收集桡动脉血液样品。试样于3 000 r·min-1下离心10 min,之后在-20 ℃下冷冻用于随后的分析。每个样品在收集后尽快进行分析(通常在一周内进行分析)。利用以下方程计算8 h肌酐清除率:肌酐清除率(mL·min-1)=(C尿中肌酐×V尿)/(C血浆中肌酐×尿采集时间)
1.2.3 组织中的药物浓度测定 采用微透析来测定皮下组织中游离(或者非结合的)抗生素,临床利用此方法来测定在感染患者的肌肉、皮下组织、上皮分泌液、腹水、脑脊液和血液中的药物浓度,以确定其抗菌效应和渗透性。微渗析的原理和详细描述已经有人报道过[11],微渗析是基于通过半透膜的扩散分析来自细胞外间隙的分析物样品。在体内,此过程是利用生理学溶液以低的流速不断地灌注微透析探针而实现的。一旦探针埋入组织中,分析物就会穿过透析膜从细胞外液扩散到灌注液中继而可以取样和分析。在本研究中,微透析探针(CMA60,Microdialysis AB,Stockholm,Sweden)具有截留相对分子质量20 kDa,外周直径为0.6 mm,膜长度为30 mm,将其无菌地置入每个患者上臂的皮下组织中。开始输注哌拉西林他唑巴坦后,在抗生素治疗的第1天和第2天每隔约20 min 收集微透析样品。将样品储存在-20℃,随后用于分析。微透析溶液中哌拉西林的回收根据反向透析方法由穿过微透析膜进入组织所损失的内部标准(哌拉西林G)来插补。计算公式:哌拉西林回收率(%)=100×(Cin-meanCout/Cin)。其中,Cin是哌拉西林G2 mg·L-1(灌注液);Cout是测得的微透析中的哌拉西林G的浓度。
1.2.4 方法学考查 主要包括回收率的日内重复性,通过连续改变探针外部的介质浓度并测定其回收率的变化情况来考察探针回收率的重复性。介质为含有哌拉西林的ACD 溶液,其质量浓度从0~1 000 ng mL-1,共6个浓度点。每隔20 min收集一次渗析液,同时改变介质中哌拉西林的浓度,浓度的改变方法是从低浓度到高浓度,然后返回最低浓度,共收集3个循环。通过增量回收率计算法计算哌拉西林的回收率。然后应用浓差法测定探针的回收率,并观察流速和浓度对回收率的影响。
1.2.5 临床治疗结果的评估 抗生素治疗的临床治疗结果是治疗医生根据表1中所述的定义进行评估的。
1.2.6 血浆中非结合的哌拉西林的测定 将患者的血浆500μL离心通过3 kDa标称截留膜设备(Amicon YM30,Millipore,Billerica,MA)得到的过滤回收率为25%的原液体积。100μL滤液加上20μL500 μg·mL-1的哌拉西林G(内标)利用高效液相色谱法进行分析。

表1 抗生素治疗临床结果等级的定义Tab 1 Definitions for classification of clinical outcome of antibiotic therapy
1.2.7 血浆药物检测 血浆哌拉西林浓度利用反相高效液相色谱法进行测定,利用UV 检测器(Waters 510 pump,717自动进样器和486可调吸光度检测器在218 nm 处进行设定)。使用的色谱柱为150 mm×4.6 mm 的Gemini 3μm C18柱(Phenomenex,Lane Cove,Australia)。对患者血浆进行分析评估,定量检测限为2.5 mg·L-1,重复性在可接受范围内:变异系数为2.2%(日内)和6.4%(日间)。利用高效液相电喷雾质谱(LCMS)分析哌拉西林的微透析浓度。哌拉西林LCMS的定量检测限为0.125 mg·L-1,重复性在可接受的范围内:在2 mg·L-1和0.2 mg·L-1时变异系数分别为2%和3%。
1.3 分析方法
1.3.1 药动学分析 利用非线性回归分析每位患者的血浆和皮下组织微透析数据以评估其药代动力学参数。应用了多种模型对数据进行分析,利用线性梯形规则对0~24 h的药时曲线下面积进行计算。评估每位患者的药动学参数,然后对哌拉西林在血浆和皮下组织的分布动力学进行描述。利用Prism version4.0软件绘制数据(GraphPad Software,San Diego,CA)。利用SPSS15.0软件(SPSS,Chicago,IL)对数据进行统计学分析。
1.3.2 血浆-组织浓度平衡时间的计算 平衡时间(t1/2eq,50)定义为组织浓度/血浆浓度的比值达到50%的时间,t1/2eq,50取决于静脉给药速率。当施用负荷剂量之后立即进行连续输注时:t1/2eq,50=0.693/k2,达到90%平衡的时间(t1/2eq,90)=3.3×t1/2eq。
1.3.3 药效学分析 间断和连续给药方法的药效学利用在给药过程中观察到的95%置信区间的最低浓度检测限(Cmin)来评估。将连续输注时超过100%给药间隔的最小抑菌浓度的时间(T>MIC),以及间断给药超过60%给药间隔的最小抑菌浓度的时间作为药代动力学治疗成功的目标。取得目标成功的概率与药代动力学分布进行对比。由于本研究连续输注应用的剂量较小(12 g哌拉西林/24 h),我们可以利用所观察到的连续输注的Cmin以及正常剂量的Cmin(基于同样剂量的间断给药计算得到的)来测定目标成功的概率。
2 结果
2.1 患者的一般情况 研究中纳入了14例患者,其中7例患者随机分到通过间断给药接受哌拉西林他唑巴坦,7例通过连续输注接受哌拉西林他唑巴坦。患者的人口统计和临床资料如表2所示。患者在体质量、尿量、平均动脉压、身体质量指数、败血症器官衰竭评估分数或急性生理和慢性健康评估Ⅱ评分上无显著统计学差异(Mann-Whitney U 检验)。其中间断组患者比输注组患者的年龄要大(中位年龄42对24,P=0.04;独立样本t检验)。
2.2 药物治疗结果分析(表3) 哌拉西林用量连续输注组比间断给药组少25%(235 mg/164 mg),在第2天时连续输注组的中位血浆浓度显著较高(17.9 mg 对5.1 mg·L-1;P<0.005)。而在第1天间断给药组的血浆浓度较高(8.7 mg·L-1对5.2 mg·L-1;P=0.08)。2组的中位组织浓度在第1天(连续输注组3.1 mg·L-1对间断组2.6 mg·L-1;P=0.37)无明显差别,在第2天(输注组6.4 mg·L-1对间断组1.2 mg·L-1;P=0.02)有显著差异性。本研究测定哌拉西林在患者体内的半衰期(间断组0.56 h-1[四分距0.50~0.58],输注组0.28 h-1[四分距0.19~0.95])明显要比健康志愿者体内的半衰期(0.6~1.1 h-1)短。哌拉西林的蛋白结合率为30%,哌拉西林从微透析探针中的回收率为40%。
2.3 药动学模拟 应用两阶段药动学方法来模拟每位患者的血浆和组织药物浓度,同时试验中还对一元线性模型、三元线性模型以及各种Michaelis-Menten模型都进行了检测,发现只有二元线性模型能够很好地描述所得数据。将单独的药代动力学模型的结果合并在一起来模仿通过间断和连续给药的血浆和皮下组织中哌拉西林的浓度。不同药动学模型的参数如表3所示。观察到的血浆和组织的数据如图1a所示,模拟的药动学模型数据如图1b所示。
2.4 药效学结果 哌拉西林从血浆到组织的分布范围的真实数据和模拟数据见图2,我们观察到患者体内哌拉西林在组织中的浓度比血浆中的浓度低50%~80%。当Cmin正常化到实际体质量时,Cmin的可变性显著降低(间断组SD从160%降低到49%,输注组从106%降低到28%)。
由图可见,连续输注组T1/2eq,50发生在大约173 h-1之后,T1/2eq,90发生在570 h-1之后,与连续输注组相比,间断组在组织和血浆的T>MIC都较低,由于间断给药很少能得到充足的波谷浓度,所以给取得100%T>MIC是不可能的。
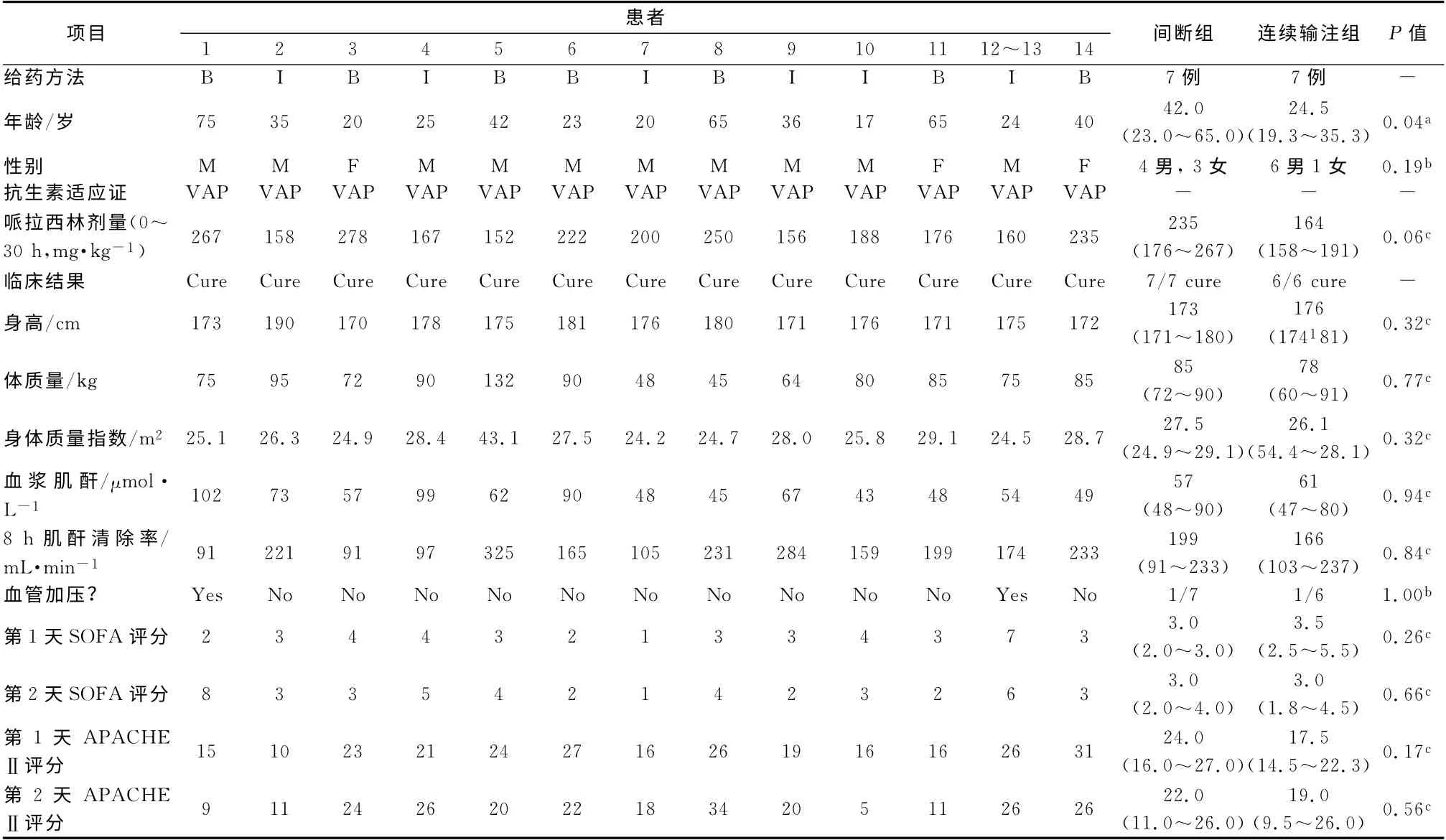
表2 患者的人口统计和临床资料Tab 2 Demographic and clinical details of enrolled patients
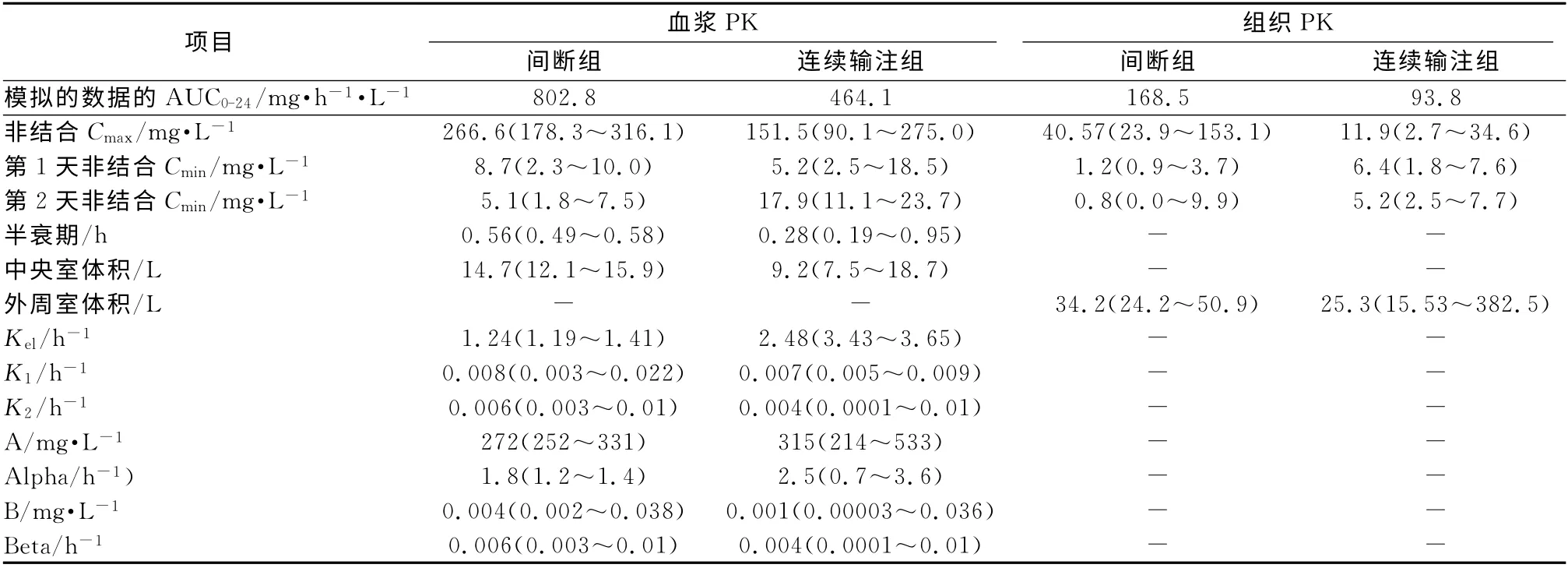
表3 抗生素治疗1 d和2 d时间断给药和连续给药哌拉西林的药动学性质Tab 3 Pharmacokinetic properties or piperacillin administered by bolus dosing and continuous infusion on days 1 and 2 of antibiotic therapy

图1 (A)间断给药(4 g给药时间持续20 min以上)和初始负荷剂量之后连续输注给药(数据以中位和四分位距表示)时血浆和皮下组织中非结合的哌拉西林的药时曲线图。(B)间断和连续给药后非结合的哌拉西林的血浆和组织中的药时曲线Fig 1 (A)Concentration–time profile of unbound piperacillin in plasma and subcutaneous tissue when administered by bolus administration(4 g over 20 minutes)or continuous infusion after initial loading dose(data represented as median and interquartile ranges);and(B)simulated plasma and subcutaneous concentrations of unbound piperacillin administered by bolus dosing(4 g/6 hrs;16 g/24 hrs)or continuous infusion(12 g/24 hrs)
3 讨论
由于哌拉西林是一种半合成哌拉西林,β-内酰胺抗生素,常被用于医院感染的经验治疗。通常是与β-内酰胺抑制剂-他唑巴坦结合应用以增加其抗菌活性。哌拉西林经常会与蛋白结合并且主要通过肾脏清除。应用哌拉西林治疗败血症重症患者主要是因为其具有广谱抗菌活性,毒副反应较少的特性[5]。
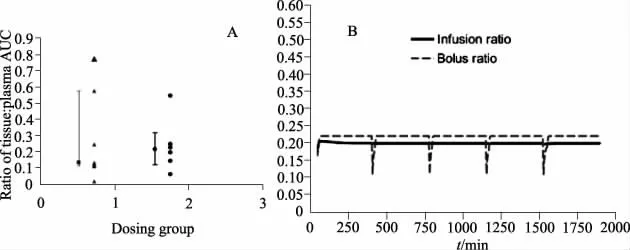
图2 组织分布:哌拉西林渗透到组织的范围:(A)皮下组织与血浆中哌拉西林曲线下面积比,(B)皮下组织和非结合的血浆哌拉西林浓度比值的模拟数据Fig 2 Tissue distribution:the extent of piperacillin penetration into subcutaneous tissue as described by:(A)the ratio of subcutaneous tissue to plasma piperacillin area under the concentration time curve(AUC)for individual patients(median data with interquartile range are proximal to each group;group 1 is the bolus dosing group and group 2is the infusion dosing group);and(B)time course of subcutaneous tissue to unbound plasma piperacillin concentration ratios using modeled data
对于败血症重症患者,间断给药和连续输注给药哌拉西林的血浆和组织内的药动学相似。通过利用重新定义的药效学终点,我们证明连续输注给药所用剂量比间断给药降低25%,并可以在皮下组织中获得较高的药效学目标。虽然对于2种给药形式应用了不同的药效学目标,但连续给药能够获得比间断给药模式高的血浆药效学目标(表3)。因为组织常常是感染的目标部位,所以本试验获得的组织中的浓度数据对于预测抗生素的疗效极其有用[6]。
本研究通过测定间断和连续输注施用β-内酰胺抗生素的皮下组织药物浓度[7],与先前的研究者一样,我们也利用了微透析方法[8],因为其能够测量分布到组织中的非结合的哌拉西林,我们的数据表明连续输注提高了药物组织渗透性[9]。而且我们发现二元线性药动学模型能够很好地描述我们从患者试验中获得的数据。
实验还发现,连续给药得到了较稳定的稳态浓度,这使得医生能够把控对患者施加的药物剂量以获得目标药物浓度。同时我们也观察到连续给药和间断给药哌拉西林的组织/血浆浓度比值是近似的。但利用连续输注哌拉西林能够改善获得指标治疗成功的可能性。由于连续给药缩短了给药间隔,延长了输注的时间,从而可以使药物的T>MIC 提高,甚至达到100%,从而改善其药效学治疗结果,目前认为,β-内酞胺类(哌拉西林)抗生素属于时间依赖性杀菌剂,因此,其临床结果的最佳指针是抗生素在最低抑菌浓度(MICs)水平以上的维持时间(即T>MIC),而与药物浓度的高低关系不大。所以连续输注给药的治疗效果要优于间断给药的治疗效果[10]。
4 结论
与标准的间断给药相比,连续输注的哌拉西林的量低25%,同时能够维持较高的波谷浓度和组织间浓度[11],这说明连续输注治疗比间断治疗时哌拉西林的组织渗透性更好,更有利于败血症的治疗[12]。
[1] Garnacho-Montero J,Garnacho-Montero C,et al.Timing of adequate antibiotic therapy is more determinant of outcome than TNF and IL-10 polymorphisms in septic patients[J].Crit Care,2006,10:111-119.
[2] Joukhadar C,Frossard M,Mayer BX,et al.Impaired target site penetration of beta-lactams may account for therapeutic failure in patients with septic shock[J].Crit Care Med,2001,29:385-391.
[3] Garnacho-Montero J,Garcia-Garmendia JL,et al.Impact of adequate empirical antibiotic therapy on the outcome of patients admitted to the intensive care unit with sepsis[J].Crit Care Med,2003,31:2742-2751.
[4] Harbarth S,Garbino J,Pugin J,et al.Inappropriate initial antimicrobial therapy and its effect on survival in a clinical trial of immunomodulating therapy for severe sepsis[J].Am J Med,2003,115:529-535.
[5] MacArthur RD,Miller M,Albertson T,et al.Adequacy of early empiric antibiotic treatment and survival in severe sepsis:Experience from the MONARCS trial[J].Clin Infect Dis,2004,38:284-288.
[6] Georges B,Conil JM,Cougot P,et al.Cefepime in critically ill patients:Continuous infusion vs.an intermittent dosing regimen[J].Int J Clin Pharmacol Ther,2005,43:360-369.
[7] Lodise TP Jr,Lomaestro B, Drusano GL. Piperacillin tazobactam for Pseudomonas aeruginosa infection:Clinical implications of an extended-infusion dosing strategy[J].Clin Infect Dis,2007,44:357-363.
[8] Lorente L,Huidobro S,Mart n M,et al:Meropenem administration by intermittent infusion versus continuous infusion for the treatment of nosocomial pneumonia[J].Crit Care,2005,9(Suppl 1):38-42.
[9] Roberts JA,Boots R,Rickard CM,et al.Is continuous infusion ceftriaxone better than once-a-day dosing in intensive care?A randomized controlled pilot study[J].J Antimicrob Chemother,2007,59:285-291.
[10]Roberts JA,Paratz JD,Paratz E,et al.Continuous infusion of beta-lactam antibiotics in severe infections-A review of its role[J].Int J Antimicrob Agents,2007,30:11-18.
[11]Dahyot C,Marchand S,Bodin M,et al.Application of basic pharmacokinetic concepts to analysis of microdialysis data:Illustration with imipenem muscle distribution[J].Clin Pharmacokinet,2008,47:181-189.
[12]Viaene E,Chanteux H,Servais H,et al.Comparative stability studies of antipseudomonal beta-lactams for potential administration through portable elastomeric pumps(home therapy for cystic?brosis patients)and motor-operated syringes(intensive care units)[J].Antimicrob Agents Chemother,2002,46:2327-2332.

