高效液相色谱法测定核桃隔膜中黄酮苷的含量
张淑兰,王国军,唐辉,刘艳芳,王幻,关丽 (.新疆生产建设兵团医院药剂科,新疆 乌鲁木齐83000;.新疆特种植物药资源教育部重点实验室,石河子大学药学院,新疆 石河子8300)
核 桃 隔 膜(diaphragma of Juglans regia L.)又 名 分 心木,为胡桃科胡桃属植物核桃(Juglans regia L.)的带骨质内果皮的种隔,系新疆维吾尔族民间用药,用于治疗遗精、遗尿、尿路感染、肾虚遗精、阳痿早泄等症状[1-2]。化学研究表明核桃隔膜含有黄酮类物质、生物碱、皂苷、有机酸、挥发油及氨基酸等成分[3],鉴于黄酮类成分的药理活性和本课题组前期的研究表明,黄酮类化合物可能是核桃隔膜中重要的活性成 分[4-5]。
近年来国内外对核桃仁、叶、花、青皮的研究已趋于成熟[6-8],但对核桃隔膜的开发利用还相对较少,为了深入分析核桃隔膜的有效成分,更全面地评价这一植物资源,本文建立了测定黄酮苷含量的高效液相色谱方法,并采用直接测定主成分木犀草苷与间接测定水解后苷元换算成黄酮苷相结合的方式测定核桃隔膜中黄酮苷的含量,并比较了不同产地核桃隔膜中黄酮苷含量的差异,为核桃隔膜的的质量控制提供有效的理论依据。
1 材料
1.1 仪器 美国Agilent HP1100型高效液相色谱系统(配有:四元泵,紫外可变波长检测器,ChemStations 色谱工作站);API4000三重四级杆串联质谱仪(Applied Biosystems,USA);德国Sartorius BP211D 十万分之一电子分析天平;上海科导SK5200HP超声清洗器。
1.2 试剂 对照品槲皮素(批号100081-200406)、山柰素(批号110861-200606)、木犀草素(批号111520-200504)、木犀草苷(批号111720-201106)均购于中国食品药品检定研究院。甲醇、乙腈为色谱纯,水为纯净水,醋酸、乙醇、盐酸及其他试剂均为分析纯;核桃隔膜购自乌鲁木齐及大理药材市场。
2 方法与结果
2.1 试验条件
2.1.1 黄酮苷色谱条件 Waters C18柱(150 mm×4.6 mm,5μm);流动相是乙腈~0.4%醋酸水;0~10 min乙腈14%~24%,10~30 min乙腈24%~61%,检测波长254 nm;柱温25 ℃;流速1.0mL·min-1;进样量20μL。
2.1.2 黄酮苷质谱条件 质谱扫描方式ESI(-);扫描范围250~700 amu;离子源温度650 ℃;碰撞气流速5 psi;离子源电喷雾电压-4 500 V;雾化器电流GS150 psi、GS260 psi;去簇电压DP-40 V、EP-40 V;碰撞能量-35 V,碰撞出口电压-6 V。干燥气体为N2。
结合LC-MS图谱及标准品比对确定确定相对分子质量为447.0的为木犀草苷,见图1、图2,而样品中的芦丁含量无法准确定量,结果见图3。在此条件下,样品中的木犀草苷与相邻组分分离度良好,结果见图3。
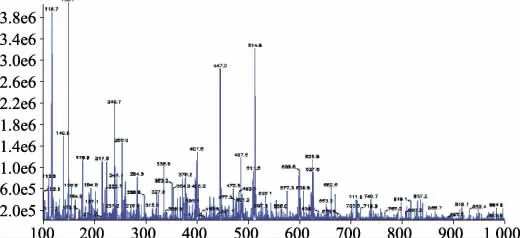
图1 样品的HPLC-MS图Fig 1 HPLC-MS chromatogram of sample
2.1.3 黄酮苷元的色谱条件 Waters C18柱(150 mm×4.6 mm,5μm);检测波长254 nm;温度25 ℃;流动相为甲醇-乙腈-0.4%磷酸溶液组成,见表1。在此色谱条件下,样品中各组分的色谱峰分离度良好,槲皮素、木犀草素及山柰素的保留时间分别是13.744,14.855,17.163 min,结果见图4。
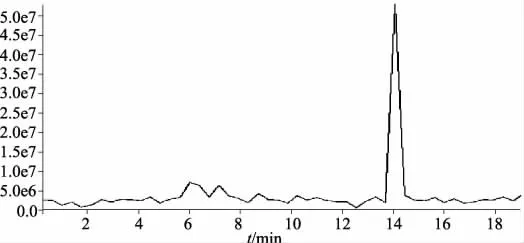
图2 木犀草苷的离子提取图Fig 2 Ion extraction chromatogram of of luteoloside

图3 核桃隔膜HPLC图A.对照品;B.样品;1-芦丁;2-木犀草苷Fig 3 HPLC chromatograms of sampleA.reference substance;B.sample;1-lutin;2-luteoloside

表1 HPLC梯度条件Tab 1 HPLC elution conditions

图4 苷元HPLC色谱图A.对照品;B.样品;1-槲皮素;2-木犀草素;3-山柰素Fig 4 HPLC chromatograms of flavone aglyconsA.reference substance;B .sample;1-quercetin;2-luteolin;3-kaempferide
2.2 对照品溶液的配制 分别精密称取槲皮素,木犀草素及山柰素对照品5.67,6.54,4.06 mg,用甲醇溶解稀释成质量浓度为113.4,130.8,81.2μg·mL-1的对照品储备液,摇匀,备用。另外精密称取木犀草苷5.04 mg,用甲醇溶解稀释成质量浓度100.8μg·mL-1的对照品储备液,摇匀,备用。
2.3 样品溶液的配制 称取核桃隔膜100 g粉碎(过3号筛),60%乙醇超声提取2次,浓缩干燥得核桃隔膜黄酮提取物9.8 g。称取核桃隔膜黄酮提取物75 mg,加甲醇30 mL,体积分数为25%盐酸溶液5 mL 置于150 mL 锥形瓶中,在95 ℃水浴中回流水解90 min,冷却,转移至50 mL 量瓶中,用甲醇稀释至刻度,摇匀,作为供试品溶液。另取未水解的核桃隔膜黄酮提取物适量,加甲醇溶解定容至25 mL,摇匀,备用。
2.4 线性关系考察 精密移取槲皮素,木犀草素及山柰素混合对照品及木犀草苷溶液0.5,1,2,3,4,5,6 mL 分别置于10 mL的量瓶中,用甲醇稀释定容,摇匀,0.45μm 微孔滤膜滤过,按上述色谱条件进样测定。以色谱图峰面积(A)为纵坐标,浓度(C)为横坐标,进行线性回归,并绘制标准曲线,线性方程见表2,结果表明3种苷元及木犀草苷的线性关系良好。
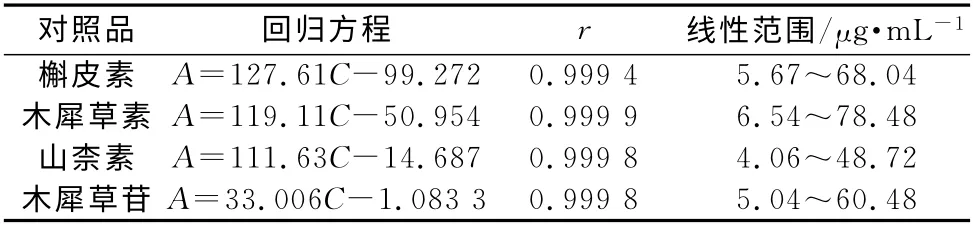
表2 线性关系Tab 2 Linear relationship
2.5 精密度试验 精密移取混合对照品及木犀草苷溶液20 μL,按上述色谱条件进样测定6次,记算槲皮素、木犀草素、山柰素及木犀草苷峰面积的RSD 分别为1.1%、1.0%、1.0%、0.2%,说明仪器的精密度良好。
2.6 重复性试验 取新疆核桃隔膜6 份,精密称定,按“2.3”项下方法制备样品溶液,精密吸取20μL 进样测定,记录样品中槲皮素、木犀草素、山柰素及木犀草苷峰面积的RSD 分别为1.6%、1.7%、2.0%、1.7%,结果表明本 方法的重复性良好。
2.7 稳定性试验 取同批样品溶液20μL,分别于0,2,4,6,8,12 h在上述色谱条件下进样分析。计算槲皮素、木犀草素、山柰素及木犀草苷峰面积的RSD 分别为2.4%、1.6%、1.7%、1.1%,表明样品溶液在12 h内稳定。
2.8 加样回收率试验 精密称取同批核桃隔膜黄酮提取物30 mg,分别加入6 mL、0.113 4 mg·mL-1的槲皮素,5 mL 0.081 26 mg·mL-1的山柰素,4 mL、0.130 8 mg·mL-1的木犀草素及2 mL、0.100 8 mg·mL-1的对照品标准 溶 液,按“2.3”项处理方法制备样品溶液6 份,在上述色谱条件下测定加样回收率。结果槲皮素、木犀草素、山柰素及木犀草苷的平均回收率分别为94.86%、93.89%、103.90%、104.0%;RSD 分别为1.9%、2.7%、3.2%、1.1%。
2.9 样品测定 取两个产地的样品,分别按“2.3”项下方法制得样品溶液,分别精密吸取对照品溶液与样品溶液各20 μL,进样分析。采用外标法分别计算槲皮素、木犀草素、山柰素及木犀草苷含量,按下式将苷元换算成黄酮苷的的含量[9],结果见表3。
黄酮苷含量=槲皮素量×1.44+木犀草素量×1.57+山柰素量×1.39

表3 样品含量测定结果Tab 3 Results of determination
3 讨论
本实验采用HPLC法测定核桃隔膜中黄酮苷的含量,相比以芦丁为对照品的比色法测定黄酮苷更加准确、重现性更好。实验中采用LC-MS对核桃隔膜中的黄酮类物质(保留时间为11.117 min的化合物)进行分析研究,对该化合物进行MS分析得到分子质量为447.0(木犀草苷对照品分子质量448.376 9)(见图1),并对该化合物进行离子提取,得到单一的图谱(见图2),通过HPLC保留时间和分子质量与已知对照品的对比确定该化合物为木犀草苷(图3);而黄酮提取物水解后的苷元样品经标准品对比确定黄酮提取物中主要有槲皮素、木犀草素、山柰素。
黄酮苷水解受溶液pH 值、水浴温度、水解时间等因素的影响。文献[10]中水解用的酸多有不同,且水解时间、温度各有不同,时间从0.5~2 h不等,温度80~110 ℃也不等。经试验,以甲醇-25%盐酸(6∶1)混合液95 ℃水解1.5 h为最佳水解条件。
核桃隔膜黄酮提取物的水解样品中主要为槲皮素,木犀草素和山柰素3种苷元。核桃隔膜黄酮提取物中以木犀草素为苷元的苷为木犀草苷,槲皮素为苷元的苷代表有扁蓄苷,以山柰素为苷元的苷有胡桃苷,故可用相对分子质量为434的扁蓄苷对槲皮素的转换因子1.44,分子质量为448的木犀草苷对木犀草素的转换因子1.57和分子质量为418的胡桃苷对山柰素转换因子1.39,通过下面的转换关系来计算核桃隔膜黄酮提取物中黄酮苷的含量(黄酮苷含量=槲皮素量×1.44+木犀草素量×1.57+山柰素量×1.39)。
通过直接测定黄酮主成分木犀草苷含量与间接测定黄酮苷的含量比较发现,直接测得木犀草苷含量3.015 mg·g-1,间接测得黄酮苷含量8.56 mg·g-1,木犀草苷含量最高,可以作为总黄酮苷含量评价的主要指标;经过木犀草素换算的黄酮苷含量5.68 mg·g-1,而木犀草苷含量3.015 mg·g-1,说明样品中以木犀草素为苷元的苷除了木犀草苷外还有其他黄酮苷。本实验还比较了新疆与云南不同品种的核桃隔膜中黄酮苷的含量,结果发现新疆产地的含量更高。
[1] 菇克娅·沙德克.维吾尔医常药材学(维)(下册)[M].乌鲁木齐:新疆科技卫生出版社,1993:53.
[2] 全国中草药汇编编写组.中草药大辞典:上册[M].北京:人民卫生出版社,1975:667.
[3] 王艳梅,高莉,刘梦,等.核桃隔膜化学成分定性研究[J].食品工业科技,2008,29(12):123-124.
[4] 王艳,迪丽达尔·马合木提,韩艳春,等.维吾尔药核桃分心木不同提取物对肾阳虚模型小鼠的实验研究[J].新疆医科大学学报.2012,35(2):153-157.
[5] 余旭亚,陈朝银,王洪钟,等.核桃仁与核桃油总黄酮含量比较研究[J].食品研究与开发,2002,23(6):25-26.
[6] 陈勤,李磊珂,吴耀.核桃仁的化学成分与药理研究进展[J].安徽大学学报(自然科学版),2005,29(1):86-89.
[7] 高岳芳,张丽,韩颖,等.核桃属植物叶的化学成分及生物活性研究进展[J].西北林学院学报,2010,25(4):165-169.
[8] 李秀凤.核桃青皮的成分与药理研究进展[J].食品科技,2007(4):241-242.
[9] 孙兆荣.高效液相色谱法测定银葛胶囊中总黄酮醇苷的含量[J].中国医院药学杂志,2011,31(22):1906-1908.
[10]陈钧.定量分析银杏黄酮苷的水解反应条件[J].分析化学研究简报,2011,29(4):450-452.

