OATP1B1及CYP3A4基因多态性对阿托伐他汀转运代谢影响的分子机制
袁钊,李新华,黄世博,夏春华,熊玉卿 (.南昌大学医学院临床药理研究所,江西 南昌330006;.南昌大学校医院,江西 南昌330006)
阿托伐他汀(atorastain,ATV)是新一代β-羟基-β-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,可竞争性抑制胆固醇的生物合成,显著降低血脂水平[1]。虽然ATV 已广泛用于高胆固醇血症的治疗,但其调脂疗效呈现明显的个体差异[2]。有研究表明,ATV 与其他他汀类不同之处在于,其既是摄入型转运体有机阴离子转运多肽B1(OATP1B1)的底物,又 主 要 经CYP3A4 代 谢[3-4]。故OATP1B1及CYP3A4的基因多态很可能影响ATV 的转运与代谢,从而导致ATV 疗效和不良反应个体差异的出 现[5-6]。系 统 研 究 ATV 转 运、代 谢 相 关 的OATP1B1及CYP3A4基因多态性及其相互间的关联意义重大。为此,本研究从体外分子水平,系统考察ATV 在不同基因型OATP1B1及CYP3A4个体中转运代谢过程的差异,分析 OATP1B1 及CYP3A4基因多态性对ATV 转运代谢影响的分子机制。为进一步的体内研究及正确确立ATV 的临床合理用药提供前期研究数据及理论依据。
1 材料
1.1 仪器 2010EV 液质联用仪、2010A 高效液相色谱仪为日本Shimadzu公司;550型酶标仪(美国Bio-RAD 公 司);XP205 型 电 子 分 析 天 平(美 国Mettler Toledo公 司);ZHWY-2102C 双 层 恒 温 培养振荡器(上海智诚分析仪器制造有限公司)。
1.2 药品与试剂 阿托伐他汀对照品(中国食品药品检定研究院,批号201102101,含量>97.0%);瑞舒伐他汀内标(中国食品药品检定研究院,批号201001002,含量>99.7%);二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)均为美国Amresco公司产品;高糖DMEM 培养基、非必需氨基酸(美国Gibco公司);胎牛血清(FBS,杭州四季青公司);PBS缓冲液(南昌长城生物科技有限公司);6-磷酸-葡萄糖(6-P-G)、6-磷酸-葡萄糖脱氢酶(6-P-G)、氧化型辅酶Ⅱ(β-NADP)均为Sigma公司产品;甲醇、乙腈为色谱纯;其他试剂均为分析纯。
1.3 其他材料 OATP1B1质粒模型:成功转染慢病毒包装后OATP1B1*1a、*5、*15 质粒的HEK293T 细胞。体外转运试验中cDNA 转染的HEK293T 细胞(自身不表达OATP1B1,通过转染实现高表达)可作为一种有效的工具,用于预测OATP1B1 SNPs对药物体内处置过程的影响[7];人重组CYP3A4酶:购自陕西北美基因有限公司,其酶蛋白含量及酶活性均已标定。
2 方法
2.1 ATV 在不同基因型OATP1B1质粒中转运差异的研究
2.1.1 溶液配制 (1)ATV 对照品贮备液:精确称取ATV 对照品22.02 mg,以3.035 mL DMSO 配制成6 000μmol·L-1的贮备液,-20 ℃保存,临用前进行稀释;(2)瑞舒伐他汀标准品贮备液:精确称取瑞舒伐他汀标准品17.41 mg,以10 mL DMSO 配制成1 739μmol·L-1的贮备液,-20 ℃保存,临用前进行稀释。
2.1.2 ATV 对HEK293T 细胞毒性试验 取对数生长期HEK293T 细胞,通过细胞计数器调整细胞密度至1.0×106/mL,每孔加200μL 细胞悬液接种于96孔培养板,培养24 h后换液,实验组分别加入含ATV 系列浓度的培养液,对照组和空白组只加培养液,边缘空用PBS填充,每组设6个复孔,24 h后每孔加入5 mg·mL-1的MTT20μL,培养4 h后吸弃孔内培养液,每孔加150μL DMSO 溶液,置于双层空气恒温振荡器中,37 ℃、50 r·min-1振荡10 min,使甲瓒充分溶解,用酶联免疫检测仪于波长490 nm 处测定其吸光度值,空白孔调零,记录各孔吸光度值。计算细胞存活率:细胞存活率=(实验组吸光度值/对照组吸光度值)×100%。
2.1.3 HEK293T 细胞样品处理方法的建立 采用冰醋酸-醋酸乙酯液液萃取法提取细胞中的待测样品。取100μL 完成摄取试验的HEK293T 细胞破碎液,加入20μL 内标瑞舒伐他汀(10μmol·L-1),加入30μL 冰醋酸,振荡30 s,加入1 mL 醋酸乙酯,涡旋振荡2 min,于20 000 r·min-1离心10 min,取0.8 mL 上清液于浓缩仪中挥干(60 ℃30 min),加入100μL 甲醇复溶,20 000 r·min-1离心10 min后,取10μL进样分析。
2.1.4 ATV LC-MS分析方法建立
(1)色谱条件 流动相:乙腈-水(含0.1%甲酸)=60∶40;流速:0.2 mL·min-1;色谱柱:Shimadzu Pack VP-ODS C18(5μm,150 mm×2.0mm)。
(2)质谱条件 离子化方式:电喷雾离子化;采集方式:选择性离子监测;加热块温度:200 ℃;CDL电压:25 V;检测电压:-1.65 kV;检测方式:正离子检 测,检 测 离 子[M-H]-:阿 托 伐 他 汀m/z 559.40;内标(瑞舒伐他汀)m/z 482.30;雾化气流速:1.5 L·min-1;干燥气流速:2.0L·min-1。
2.1.5 考马斯亮蓝法[8]测定HEK293T 细胞裂解液蛋白含量 分别加入1.0 mg·min-1的蛋白质标准溶液0,1,2,3,4,5μL,其余用纯化水补充,使样品总体积为5μL,加入考马斯亮蓝G-250溶液195 μL,把酶标板放在振荡器上振荡30 s,充分混匀,放置2 min后再次振荡,然后在595 nm 下比色测定(1 h内完成)以标准曲线0号管做参比,在595 nm 波长下比色,记录吸光值,以蛋白质含量(μg·mL-1)为横坐标,吸光值为纵坐标,绘出标准曲线,用于计算蛋白浓度值。
2.1.6 ATV 在 表 达 不 同 基 因 型OATP1B1 的HEK293T 细胞中的摄取试验 取对数生长期HEK293T 细 胞(HEK293T、OATP1B1 * 1a-HEK293T、OATP1B1*5-HEK293T、OATP1B1*15-HEK293T 细胞),将细胞悬液稀释为1.0×106/mL,每孔0.5 mL,加于12 孔培养板内,培养2 d。实验前,吸弃旧培养液,加入37 ℃预热的摄取缓冲液荡洗细胞3次,最后一次置于37 ℃培养箱温孵30 min后,吸弃缓冲液,用于药物摄取试验。
(1)pH 值对不同基因型OATP1B1-HEK293T摄取的影响 于上述准备用于细胞摄取试验的12孔板中分别加入pH 值分别为6.5,7.5,8 的含10 μmol·L-1ATV 摄取缓冲液0.5 mL,每组设5个复孔,同时设置不加药的空白孔。置37 ℃培养箱中孵育20 min,吸弃细胞上层培养液,加入37 ℃摄取缓冲液洗涤4次后加入0.2 mL 无菌水于-80 ℃超低温冰箱反复冻融3 次。细胞破碎液移入EP 管于20 000 r·min-1离心10 min。取细胞破碎液100μL按“2.1.3”项 操 作 后 进 样 分 析,LC-MS 法 测 定HEK293T 中ATV 的含量,另取50μL细胞破碎液用于考马斯亮蓝法细胞蛋白含量测定,摄取量以pmol·min-1·mg-1protein表示。
(2)时间对不同基因型OATP1B1-HEK293T摄取的影 响 每孔加入0.5 mL 20μmol·L-1的ATV 摄取缓冲液。加完药后,置37 ℃的培养箱中分别孵育5,10,20,40,60 min,每组设5个复孔,同时设不加药物的空白孔,按时间点吸弃培养液,其余操作同前。
(3)ATV 浓 度 对 不 同 基 因 型 OATP1B1-HEK293T 摄取的影响 每孔加入150,100,50,20,10,5μmol·L-1ATV 摄取缓冲液0.5 mL,每浓度设5个复孔,同时各设5个不加药的空白孔。置37 ℃的培养箱中分别孵育一定时间,吸弃上层培养液,其余操作同前。
2.2 ATV 在不同基因型CYP3A4重组酶系中代谢差异的研究
2.2.1 ATV 代谢孵育方法建立 孵育总体系200 μL,含 氯 化 镁3.3 mmol·L-1、6-磷 酸-葡 萄 糖3.3 mmol·L-1、6-磷 酸-葡 萄 糖 脱 氢 酶20μg·mL-1、NADP+1.3 mmol·L-1、系列浓度ATV10μL、重组酶1 mg·mL-1,其他体积由PBS 缓冲液(pH 7.4)补充。37 ℃、120 r·min-1预温孵5 min后,加入40μL NADPH 反应体系孵育,孵育完成后,加入100μL冰乙腈终止反应,涡旋3 min,4 ℃、20 000 r·min-1离心10 min,取上清用于HPLC分析。
2.2.2 ATV 及其代谢产物HPLC 分析方法建立 色谱 条 件:色 谱 柱:Diamonsil C18柱(150 mm×4.6 mm);流动相:乙腈-20 mmol·L-1醋酸胺=38∶62;进样量:20μL;流速:1.0 mL·min-1;检测波长:246 nm;柱温:室温;分析时间:14 min。
由于未能获得ATV 代谢产物邻羟基阿托伐他汀和对羟基阿托伐他汀的对照品,本实验以ATV作为标准,利用代谢产物峰面积与剩余底物峰面积的比值,对代谢产物进行相对定量。
2.2.3 重组酶代谢ATV 动力学参数测定条件的选择
(1)ATV 在重组酶中代谢的时间曲线 按“2.2.1”项下方法进行孵育,固定孵育体系中重组酶蛋白含量为1.0 mg·mL-1。孵育时间点设计为0,10,20,40,60,90 min。零时间点采用不加启动剂孵育90 min后,先加入200μL冰乙腈,然后再加启动剂。结果直接将代谢产物峰对孵育时间作图,寻找在线性范围内的时间点。
(2)ATV 在重组酶中代谢的酶浓度曲线 按“2.2.1”项下方法进行孵育,其中酶的浓度通过体系中总蛋白含量来控制。分别使孵育体系中总蛋白含量为0.5,1.0,1.5,2.0mg·mL-1,孵育60 min后,加入200μL冰乙腈终止反应,处理后进样分析。结果直接将代谢产物峰对酶浓度作图,寻找在线性范围内的酶浓度点。
2.2.4 人CYP3A4重组酶对ATV 代谢的酶动力学参数测定 按“2.2.1”项下方法配置孵育体系,使ATV 浓度为10~150μmol·L-1。孵育体系中甲醇体积分数低于0.5%。孵育60 min,蛋白质含量为1.0mg·mL-1。酶动力学参数Km和Vmax由产物生成法测定,即以底物生成的速率作为代谢速率。
3 结果
3.1 ATV 对HEK293T 细胞的毒性反应 结果表明,ATV 在1~200μmol·L-1范围内对HEK293T细胞毒性小,细胞活力大于80%,超过上述药物浓度范围时出现细胞毒性,细胞形态发生变化。

图1 ATV 对HEK293T 细胞的抑制率(n=4±s)Fig 1 The living rate of ATV determined by MTT(n=4±s)
3.2 HEK293T 细胞裂解液蛋白曲线 考马斯亮蓝法建立测定蛋白标准曲线,结果蛋白量在1~30 μg范围内线性关系良好,回归方程为:Y=0.017 5 X+0.030 5,R2=0.990 1(n=5)。用此线性方程计算HEK293T 细胞的裂解液稀释后的蛋白含量。
3.3 ATV 在表达不同基因型 OATP1B1 的HEK293T 细胞中的摄取参数
3.3.1 pH 值对摄取转运的影响 结果表明,pH 值为6.5,7.5,8 的 摄 取 缓 冲 液 对OATP1B1*1a-HEK293T、OATP1B1*5-HEK293T 与OATP1B1*15-HEK293T细胞摄取ATV 的差异无统计学意义。3.3.2 时间对摄取转运的影响 考察分别表达OATP1B1*1a、OATP1B1*5、OATP1B1*15 的HEK293T 细 胞 在5,10,20,40,60 min 时 对20 μmol·L-1ATV 的摄取情况。结果表明,随着时间的延长,对ATV 的摄取增加,在20 min时摄取均趋于饱和,因此,在下一步的实验中将摄取终止时间设置为20 min。
3.3.3 ATV 浓度对摄取转运的影响 表达OATP1B1*1a、*5、*15 基因的HEK293T 细胞在20 min内对系列浓度的ATV 摄取情况见图2。由图2可见,随着ATV 浓度增加,3组摄取量趋于增加并逐渐饱和,呈现酶动力学特征曲线。
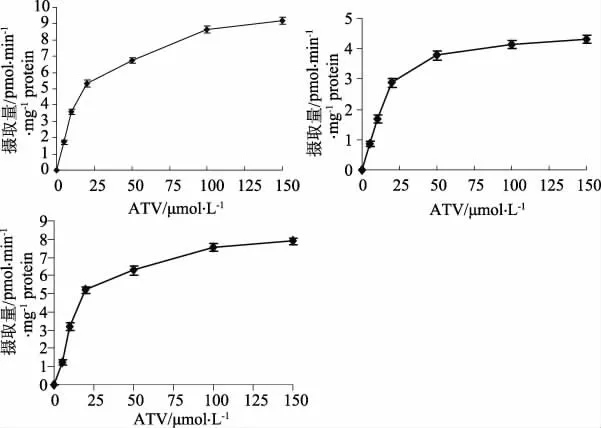
图2 药物浓度对ATV 在转染目的基因的HEK293T 细胞中摄取情况的影响Fig 2 Effect of durg concentration on the uptake of ATV in HEK293T cells transfected with target gene
由表1 可以看出,表达OATP1B1*1a 或与OATP1B1*5的细胞对ATV 的转运摄取有较大的差异,OATP1B1*5 对ATV 的转运能力降低;与OATP1B1*15相比,OATP1B1*5转运活性较低,OATP1B1*1a与OATP1B1*5对系列浓度ATV的转运差异有统计学差异(P<0.05)。见表1。
3.4 ATV 在CYP3A4重组酶系中的代谢确证 用含有野生型CYP3A4 重组酶(*1)或突变型CYP3A4重组酶(*3、*5、*16、*18)的孵育体系对ATV 进行代谢,孵育后反应液经HPLC分析,可以观察到分别在3.5,9.4 min处有代谢峰,两个代谢物峰均能稳定出现,且代谢物峰面积随ATV 底物含量改变成比率增加,在含无活性重组酶的孵育体系中孵育后,在相同位置则没有ATV 代谢峰出现。见图3。

表1 ATV 在表达不同基因型OATP1B1-HEK293T 细胞中的吸收动力学参数Tab 1 Kinetic parameters of uptake of ATV in different genotypes OATP1B1 expression of HEK293T cells

图3 HPLC分析ATV 的特异性A.ATV 孵 育 样 品(无NADPH);B:ATV 孵 化 样 本,峰1:ATV;peak2,peak3:ATV 代谢物Fig 3 HPLC analysis of the specificity of ATVA.ATV incubation sample-no NADPH;B.ATV incubation sample,peak1:ATV;peak2,peak3:ATV metabolite by CYP3A4 wild type
3.5 CYP3A4重组酶对ATV 代谢动力学实验孵育条件摸索 如图4A 所示,在0~90 min内,代谢物的生成量呈线性增长,说明在此段时间内,ATV代谢速率是恒定的。如图4B 所示,在蛋白含量0.25~2.0mg·mL-1范围内,代谢物的生成量也呈线性增长,说明在2.0mg·mL-1以下,酶没有饱和。考虑到实验需要一定的代谢量以利于定量,遂选择孵育时间60 min,酶蛋白为1.0mg·mL-1。
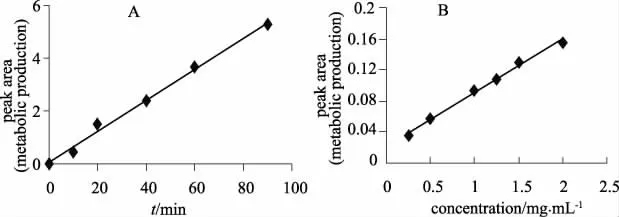
图4 CYP3A4*1中孵育条件对ATV 代谢情况的影响A.代谢量与培养时间的关系;B代谢量与孵育蛋白质含量的关系Fig 4 The relationship between metabolism and incubation condition for CYP3A4*1A.metabolic amount vs.incubation time;B metabolic amount vs.incubation protein concentration
3.6 CYP3A4重组酶对ATV 代谢的酶动力学参数及比较 将实验数据按米曼氏方程拟合,内在清除率CLint等于Vmax/Km,CLint是比较突变重组酶与野生型重组酶代谢差异的标准,CLint值越大表明该酶对底物的代谢活性越大,比较CYP3A4重组酶对ATV 代谢的酶动力学参数(表2)。
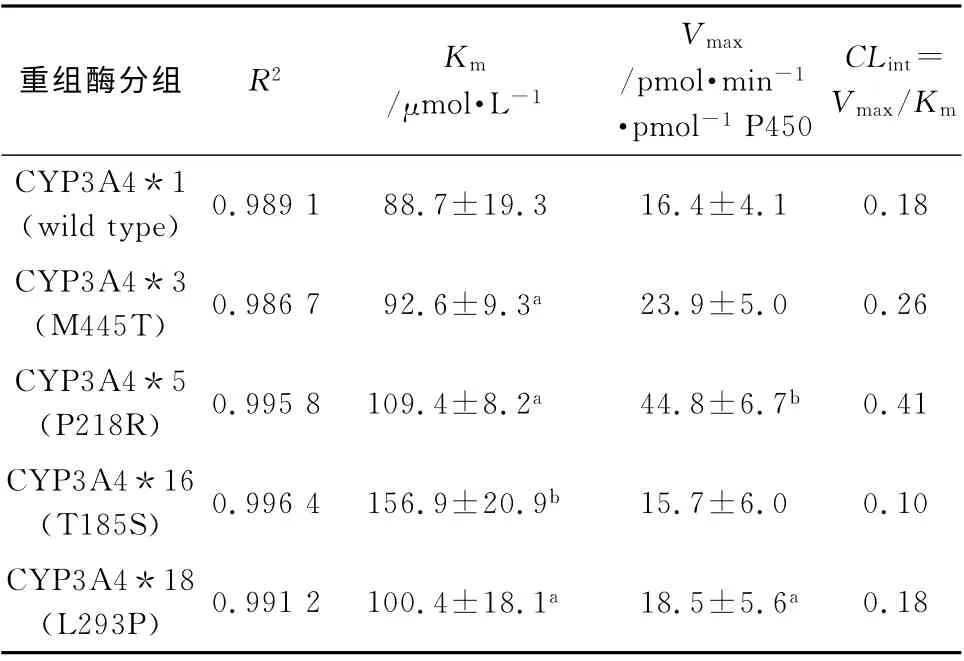
表2 ATV 在人重组酶CYP3A4*1/*3/*5/*16/*18中按米曼氏方程拟合的代谢动力学参数Tab 2 ATV metabolic kinetic parameters of Michaelis-Menten equation fitting in human Recombinase CYP3A4*1/*3/*5/*16/*18
研究结果表明,CYP3A4*3的Km与野生型的相近,代谢速率略高于野生型,CLint值比较看来酶活性略大于野生型。CYP3A4*5 的Km虽略高于野生型,但显著高于野生型的代谢速率,弥补了其对ATV 的低亲和力,CLint值比较看来酶活性显著大于野生型。CYP3A4*16 的Km显著高于野生型,代谢速率与野生型的相近,CLint值比较看来酶活性显著低于野生型。CYP3A4*18的Km与代谢速率均略高于野生型,CLint值比较看来酶代谢ATV 的活性与野生型相近。
4 讨论
本文通过分子学水平探明OATP1B1多态性对ATV 转运影响的机制及CYP3A4 多态性对ATV代谢影响的机制。
自Ieiri等[9]研究发现口服同等剂量ATV 的高血脂患者中,携带c.521CC等位基因的患者相比c.521TT AUC增高144%的报道以来,Yoshio Kameyama等[10]利用感染表达OATP1B1的HEK293T细胞,证实ATV 为OATP1B1 的底物。诸多围绕摄入型转运体OATP1B1对药物转运影响的研究进一步证明,体外转运试验中cDNA 转染的HEK293T 细胞可作为一种有效的工具,用于预测OATP1B1 SNPs对药物体内处置过程的影响[7]。本研究室亦通过构建OATP1B1重组质粒模型,证实ATV 在不同基因型HEK293T 细胞的摄取率OATP1B1*5明显小于OATP1B1*1a。本次研究表明OATP1B1 521 位点(亚洲人群的突变率为16%[11])可能是ATV 转运的分子作用点,也是影响OATP1B1对ATV 转运能力的关键位点,该位点发生突变会导致转运入肝至靶点的ATV 量减少,难以达到相应的降脂疗效,故临床上应关注患者OATP1B1 521位点的突变情况,指导ATV 临床合理用药。
CYP3A4是参与他汀类药物Ⅰ相代谢过程中最主要的酶类[12],国内外研究显示CYP3A4酶活性具有明显的个体差异(可达60倍),会导致治疗失败或难以预料的毒副作用的发生[13]。而90% 的CYP3A4代谢活性个体差异均由基因多态引起。CYP3A4多态性会导致患者间出现显著的个体差异,影响他汀类药物治疗降脂疗效,甚至出现横纹肌溶解等不良反应[14]。迄今为止,在中国人体中已发现的CYP3A4编码区突变基因型主要为CYP3A4*3、*5、*16 和*18,其发生率虽然不高,其中CYP3A4*3最早在32名中国人中发现1例突变,而CYP3A4*5、*16 和*18 突变发生率均在1%左右[15]。而有关这些位点突变后酶活性的变化文献报道并不一致,酶活性可能会因底物不同而存在差异[16]。不同基因型CYP3A4 酶对ATV 代谢过程影响有何差异尚未见展开研究。我们这次研究表明CYP3A4 酶这些位点的突变会不同程度影响CYP3A4对ATV 的代谢活性,故ATV 在临床用药时也应关注患者CYP3A4不同位点的突变情况。
总之,药物转运体 OATP1B1 及代谢酶CYP3A4基因多态性会对ATV 的转运代谢过程产生影响,从而导致巨大个体差异,这些差异将会引起毒副作用或无效治疗的发生。临床用药过程中,应密切关注个体差异与基因多态的关联,并针对不同患者通过减少剂量避免不良事件的发生,或更换药物避免无效治疗,以免延误最佳治疗期。
目前,大部分有关基因多态性对他汀类药物影响的研究,都只考虑某一种多态性对他汀类药物的影响,而他汀类药物在体内的代谢、转运、产生药效的过程十分复杂,影响因素众多,单个遗传决定因素难以全面反应多态性所致影响,同时考虑多个基因联合 效 应 更 具 现 实 意 义。如OATP、P-gp[17]、CYPs、LDL-受 体[18]、CETP[19]、ApoE[20]及HMGCoA 还原酶[21]等多态性均不同程度影响他汀类药物代谢、转运及药效的改变。因此,研究在基因多态“网络”对他汀类药物转运、代谢及药效的影响,为临床上个体化用药提供实验数据和理论依据,确保用药的安全性和有效性,意义重大。
[1] 王震宇,禹同生,王健,等.阿托伐他汀的药理作用及临床应用进展[J].中国新药杂志,2010,19(18):1684-1687.
[2] Maggo SD,Kennedy MA,Clark DW.Clinical implications of pharmacogenetic variation on the effects of statins[J].Drug Saf,2011,34(1):1-19.
[3] Lins RL,Matthys KE,Verpooten GA,et al.Pharmacokinetics of atorvastatin and its metabolites after single and multiple dosing in hypercholesterolaemic haemodialysis patients[J].Nephrology and Dial Transplant,2003,18(10):967-976.
[4] Willrich MAV,Hirata MH,Genvigir FDV,et al.CYP3A5*3A allele is associated with reduced lowering-lipid response to atorvastatin in individuals with hypercholesterolemia[J].Clin Chim Acta,2008,398(1-2):15-20.
[5] Rashid S,Curtis DE,Garuti R,et al.Decreased plasma cholesterol and hypersensitivity to statins in mice lacking Pcsk[J].Proc Nat Acad Sci,2005,102(15):5374-5379.
[6] Ho RH,Choi L,Lee W,et al.Effect of drug transporter genotypes on pravastatin disposition in European and African-American participants[J].Pharmacogenet Genomics,2007,17(8):647-656.
[7] Niemi M,Backman JT,Kajosaari LI,et al.Polymorphic organic anion transporting polypeptde 1B1is a major determinant of repaglinide pharmacokinetics[J].Clin Pharmacol Ther,2005,77(6):468-478
[8] Chung YK,Heo HJ,Kim EK,et al.Inhibitory effect of ursolic acid purified from Origanum majoranal on the acetylcholinesterase[J].Mol Cells,2001,11(2):137-143.
[9] Ieiri I,Suwannakul S,Maeda K,et al.SLCO1B1(OATP1B1,an up take transporter)and ABCG2(BCRP,an efflux transporter)variant alleles and pharmacokinetics of pitavastatin in healthy volunteers[J].Clin Pharmacol Ther,2007,25(4):541-547.
[10]Yoshio Kameyama,Keiko Yamashita,Kaoru Kobayashi,et al.Functional characterization of SLCO1B1(OATP-C)variants,SLCO1B1*5,SLCO1B1*15 and SLCO1B1*15 +C1007G,by using transient expression systems of HeLa and HEK293 cells[J].Pharmacogenetics and Genomics,2005,15(7):513-522.
[11]Niemi M.Role of OATP transporters in the disposition of drugs[J].Pharmacogenomics,2007,8(7):787-802.
[12]Kajinami K,Akao H,Polisecki E,et al.Pharmacogenomics of statin responsiveness[J].Am J Cardiol,2005,96(9):65-70.
[13]Matsumura K,Saito T,Takahashi Y,et al.Identifieation of a novel polymrphic enhancer of the human CYP3A4 gene[J].Mol Pharmacol,2004,65:326-334.
[14]Fiegenbaum M,Da Silveira FR,Van Der Sand CR,et al.The role of common variants of ABCB1,CYP3A4,and CYP3A5 genes in lipid-lowering efficacy and safety of simvastatin treatment[J].Clin Pharmacol Ther,2005,78(5):551-558.
[15]Floyd MD,Gervasini G,Masica AL,et al.Genotype-phenotype associations for common CYP3A4 and CYP3A5 variants in the basal and induced metabolism of midazolam in European and African-American men and women[J].Pharmacogenetics,2003,13(4):595-606.
[16]Alessio Provenzani, Monica Notarbartolo, Manuela Labbozzetta,et al.The effect of CYP3A4 and ABCB1 single nucleotide polymorphisms on tacrolimus dose requirements in Caucasian liver transplant patients[J].Ann Transplant,2009,14(1):23-31.
[17]Rashid S,Curtis DE,Garuti R,et al.Decreased plasma cholesterol and hypersensitivity to statins in mice lacking Pcsk[J].Proc Nat Acad Sci U S A,2005,102(15):5374-5379.
[18]Venrooij FV,Stolk RP,Banga JD,et al.Common cholesteryl ester transfer protein gene polymorphisms and the effect of atorvastatin therapy in type 2 diabetes[J].Diabetes Care,2003,26(4):1216-1223.
[19]张莉莉,吕安林,贾国良,等.载脂蛋白E 基因多态性对他汀类药物调脂消斑的影响[J].第四军医大学学报,2004,25(11):1029-1031.
[20]Pedro-Botet J,Schaefer EJ,Bakker-Arkema RG,et al.Apolipoprotein E genotype affects plasma lipid response to atorvastatin in a gender specific manner[J].Atherosclerosis,2001,158(1):183-193.
[21]Neuvonen PJ.Drug interactions with HMG-CoA reductase inhibitors(statins):the importance of CYP enzymes,transporters and pharmacogenetics[J].Curr Opin Investig Drugs,2010,11(3):323-332.

