解剖部位差异对脂肪干细胞生物学行为及成骨分化能力的影响*
陈 亮, 吴柏霖, 吴明珑, 王玉玺, 曾晓勇△, 叶章群
华中科技大学同济医学院附属同济医院1泌尿外科2骨科,武汉 430030
组织工程是一门新兴的交叉学科,属于以重建或修复受损组织器官为目标的再生医学[1-4]。脂肪干细胞(adipose-derived stem cells,ASCs)作为一种成体间充质干细胞,具有多向分化潜能[5-6],可通过简易、微创的手段大量获取,能在体外实现大量快速扩增[2,5],是理想的干细胞来源[7-8]。
脂肪干细胞最终用于临床康复治疗,必须解决来源可靠、高效的问题。现有的流行病学和实验研究均提示脂肪组织的解剖部位来源与其功能之间存在紧密联系[9-18]。受此影响,在不同部位取材的脂肪干细胞是否也存在生理和功能的差异成为一个需要阐明的问题,对这一问题的了解有助于组织工程种子细胞的挑选。然而,在过去报道的文献中,因为存在着诸如解剖变异、脂肪捐献者的健康状况、年龄、性别、体重等干扰实验的因素[13,15,17],不同解剖部位来源的细胞生物学行为差异仍不明确。
为此,我们设计了该实验以探讨来源部位的差异对脂肪干细胞生物学行为的影响。为了避免其他混杂因素的干扰,实验使用的脂肪组织均来自于相同饲养条件下的新西兰大白兔。实验比较了来自腹股沟皮下脂肪、颈背部皮下脂肪和肾周脂肪3个不同部位的细胞生物学活性,包括增殖、细胞活性和成骨分化能力。
1 材料和方法
1.1 实验动物
脂肪组织来自3只年龄相同的雌性新西兰大白兔(华中科技大学同济医学院实验动物学部)。实验动物从出生开始均在相同的环境中饲养,并生长至4周龄,体重接近2.4kg(2.37~2.42kg)。经耳缘静脉注射45 mg/kg 戊巴比妥钠常规麻醉实验动物,无菌术切除腹股沟皮下、颈背部皮下、肾周的脂肪组织。手术过程中无动物死亡。每个部位切除组织约2~5g,按解剖部位分为3组。以上所有动物实验均依照美国国立卫生研究院指南,并获得同济医学院伦理委员会批准。
1.2 ASCs的分离和培养
ASCs的分离采用Zuk等[19]的方法,并加以改进,具体如下:动物实验获取的脂肪组织在磷酸盐缓冲液(phosphate-buffered saline,PBS)中彻底漂洗,去除可见的血管和筋膜,以眼科剪剪碎至直径约2 mm 小块,再以Ⅰ型胶原酶处理,37℃振荡2h。其后,加入等体积的含10% 胎牛血清(HyClone,USA)的DMEM 低糖培养液(Gibco,USA)中和胶原酶活性,1 000r/min 离心10min后,弃上层悬浮的脂肪,沉淀即含有ASCs。沉淀以无血清的DMEM 低糖培养液重悬,悬液经50μm 滤网过滤,并1 000r/min 离心10 min,弃去上清,沉淀以含10%胎牛血清的DMEM 培养液重悬。悬液按细胞数4×104/cm2移入25cm2培养瓶,置于37℃、5%CO2培养箱中静置培养,每3 天更换培养液。当ASCs生长至融合率约80% 时即对细胞进行传代,实验使用第2至4代的ASCs。
1.3 细胞增殖实验
细胞增殖能力通过MTT 实验测得。胰酶消化下的ASCs按密度5×103/cm2种入96孔板(Costar,USA)中培养,每24h 取出培养板,按MTT 细胞增殖及细胞毒性检测试剂盒(Beyotime,China)说明书处理后,用MK3 酶标仪(Thermo Scientific,USA)检测每孔490nm 处吸光度值,如此连测7d。
1.4 细胞活力实验
ASCs分别在培养第2、4、7天时种于6孔板上培养,使用活/死细胞活性及毒性试剂盒(Molecular Probes,USA)对细胞进行处理,活细胞将被染上绿色荧光,而死细胞会被染上红色荧光。细胞置于激光共聚焦显微镜(FV500,Olympus)下观察,并计数5个随机视野下的活细胞数,取其均值。
1.5 成骨分化实验
1.5.1 成骨分化诱导 ASCs按密度5×104/cm2种于6孔板中培养24h,再更换为成骨诱导培养液。成骨诱导培养液为在ASCs培养液基础上添加0.1 μmol/L 地塞米松、10 mmol/L b-甘油磷酸、50 μmol/L 抗坏血酸-2-磷酸盐。每周更换2次诱导培养液,经过3周可完成成骨诱导。
1.5.2 组织化学检测 成骨诱导3周后,ASCs的成骨程度通过碱性磷酸酶(ALP)活性半定量来评价。培养板经PBS 冲洗后,孵育液中37℃孵育30 min,再以等体积的8% 多聚甲醛固定10min,双蒸水冲洗、晾干。然后,细胞与磷酸对硝基苯酯和氨甲基丙醇混合,置于分光光度计下测量405nm 处吸光度值,检测对硝基苯酚的生成。
1.5.3 qRT-PCR 检测 分化过程中的细胞用TRIzol(Invitrogen,USA)提取总RNA,并使用Prime-Script RT Reagent Kit(TaKaRa)合成cDNA,以SYBR Premix Ex TaqTM(TaKaRa)进行real-time PCR。检测目标为:Runx2(骨表达标志),COLL-1(细胞外基质蛋白),OC(骨钙蛋白)。采用qRTPCR 法每周检测1次诱导细胞的基因表达,共检测3周。引物序列见表1。

表1 qRT-PCR 引物序列Table 1 Sequences of target genes for qRT-PCR
1.6 统计分析
实验使用了3只新西兰大白兔,且每组实验均重复3次。实验数据以±s表示,使用SPSS 12.0软件进行单因素方差分析和t 检验,以P<0.05为差异有统计学意义。
2 结果
2.1 ASCs的形态特点
在ASCs的传代培养过程中,ASCs的形态如图1所示。ASCs呈多边形,有丰富的胞质和较大的细胞核,符合间充质干细胞的形态特点。分别取自3个解剖部位分离培养的ASCs具有相似的形态特征。
图1 3组ASCs的光镜下形态Fig.1 Morphology of ASCs from three anatomic sites under the light microscope
2.2 取自不同解剖部位的ASCs的增殖特性
利用MTT 实验描述3组细胞的增殖能力(图2)。通过计算,腹股沟组的倍增时间为19.64h,颈背部组的倍增时间为20.13h,肾周组的倍增时间为22.02h,腹股沟组与肾周组、颈背部组与肾周组之间差异有统计学意义(P<0.05),而皮下脂肪(腹股沟及颈背)两组之间差异无统计学意义(P>0.05)。
2.3 取自不同解剖部位的ASCs的细胞活性
在活/死细胞染色中,活细胞获得绿色荧光,而死细胞则有红色荧光(图3A~C)。在镜下观察时,来自3个部位的活ASCs随着时间延长而逐渐增多,但3组间活细胞数的差异无统计学意义(P>0.05,图3D)。

图2 MTT 实验检测3组ASCs增殖能力Fig.2 MTT assay showing the proliferation ability of ASCs in the three groups
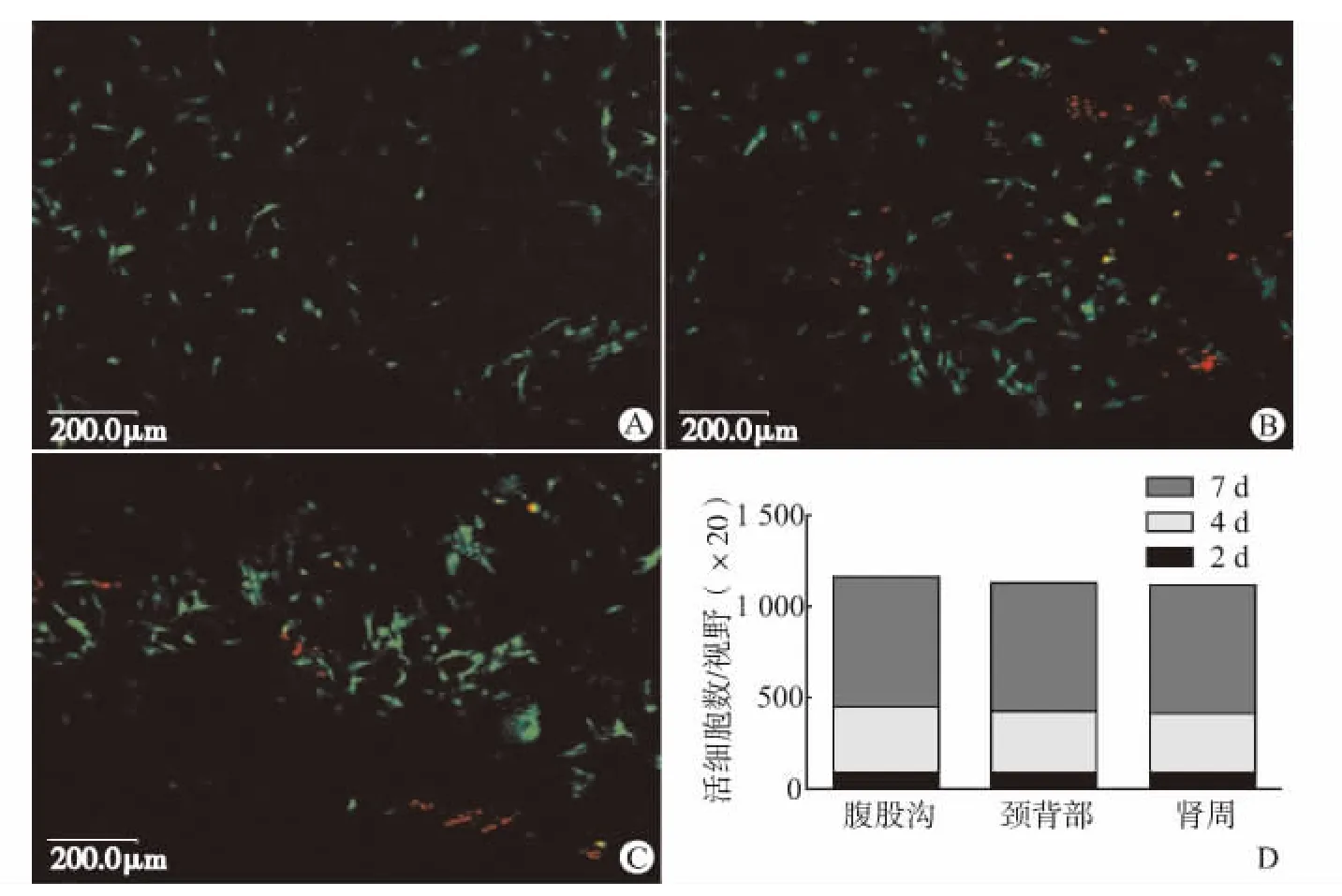
图3 活/死细胞荧光染色Fig.3 LIVE/DEAD cell fluorescence assay
2.4 取自不同解剖部位的ASCs的成骨分化能力
成骨分化3周后,通过ALP活性半定量检测的方法,对3组ASCs的成骨分化能力进行了检测(图4A)。取自皮下脂肪的两组(腹股沟组和颈背部组)的ALP活性均高于肾周组(均P<0.05),并且腹股沟组的ASCs比颈背部组的成骨能力更强(P <0.05)。
qRT-PCR 可以在基因转录水平评价来自3组ASCs在不同时段的分化能力(图4B~D)。骨形成的标志基因COLL-1和OC 在3周内逐渐升高,升至原水平的4倍和8倍,并在第3周达到峰值。OC的表达在取自皮下脂肪的两组中高于肾周脂肪组(均P<0.05)。而Runx2在最初的1 周中处于高峰,在随后的2周内逐渐下调,并且腹股沟组和颈背部组的表达均高于肾周组(均P<0.05)。结果显示皮下脂肪来源的ASCs的成骨分化能力比来源于肾周的ASCs强。
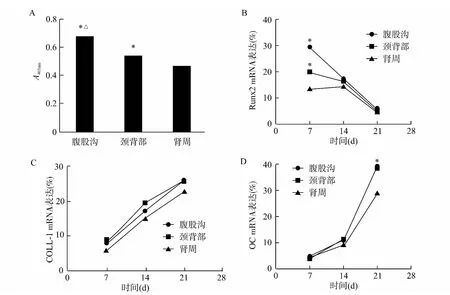
图4 细胞组织化学以及qRT-PCR检测来源于不同解剖部位的ASCs的成骨分化能力Fig.4 Immunohistochemistry and qRT-PCR analysis of the osteogenesis ability of ASCs from different anatomic sites
3 讨论
基于脂肪干细胞的再生医学治疗,应选取活性较好的自体脂肪干细胞。本实验的目的是通过在增殖、分化等方面的比较来评估不同解剖部位来源的脂肪干细胞的功能活性,以此更加深入地认识细胞行为和脂肪分布之间的关系;并以标准化的实验动物和实验来阐述不同解剖部位来源的脂肪干细胞的特性,以加深对以往相关研究的认识和组织工程中种子细胞的挑选。
目前已有一些关于不同解剖部位来源的脂肪细胞的功能和活性的研究报道[10-11,13-18]。Jurgens等[13]选择接受吸脂整形手术患者的脂肪作为ASCs来源,这些肥胖患者均存在脂肪代谢异常,其基础代谢率为25.5(正常范围是18.50~24.99)。Toyoda等[17]的研究中脂肪捐献者的年龄参差不齐,所患的疾病也各不相同(其中有胃癌患者)。Schipper等[15]对12名非肥胖患者(25至60岁)的脂肪组织进行研究,比较了5处皮下脂肪来源的脂肪干细胞的增殖相关的活性,但未涉及分化方面的比较。de Girolamo等[20]的研究仅考虑了年龄的因素。这些都限制了研究的科学性。本研究旨在比较不同解剖位置来源的ASCs在增殖、活性和分化上的差异。因此,我们将其他条件全部标准化,实验动物均为新西兰大白兔,饲养在相同的环境中,排除年龄、性别、体重的干扰,且实验动物的操作均由一人完成,使不同解剖部位来源的ASCs的比较结果更加可信。
本研究的细胞增殖实验提示皮下脂肪来源的ASCs的增殖速率快于肾周脂肪来源的ASCs,此实验结果与van Harmelen等[18]的相同,却与Toyoda等[17]的相反,其研究比较了皮下脂肪和大网膜脂肪组织来源细胞的功能。我们推测一方面可能与研究对象的差异和实验条件的不同有关,并且Toyoda等采用细胞染色计数并绘制生长曲线的方式来检测细胞增殖速率,在原理上与活/死细胞染色评价细胞活性的方法相似,在精确性上不如MTT 法,从而导致了结果的不一致。另一方面我们推测增殖能力的差异或许与不同解剖部位的代谢水平相关。本实验结果还提示在皮下脂肪中,来源于腹股沟和颈背部的ASCs在细胞增殖实验中无明显差异,此结果与Schipper等[15]的相符,提示皮下脂肪来源的ASCs具有相似的增殖速率。
在组织工程研究中,细胞的分化功能至关重要。本研究发现,来源于皮下脂肪的ASCs比来源于肾周脂肪的ASCs成骨分化能力更强。Jurgens等[13]研究提示来自腹部和臀部的ASCs无显著性差异,并因为来自臀部脂肪的ASCs的ALP 活性稍高而认为其功能性更优。Prunet-Marcassus等[14]也研究了C57BL/6小鼠的腹股沟、附睾、肩胛间脂肪的ASCs的活性,发现腹股沟来源的脂肪干细胞分化能力最好。Jurgens等[13]对ASCs的成软骨分化能力的研究结果也与之相似。本研究结果提示皮下脂肪来源的ASCs分化能力优于肾周脂肪的ASCs。
从不同部位脂肪来源的ASCs在功能上存在差异,皮下脂肪被认为优于内脏脂肪[9-11,13-18,21]。本研究首次阐明新西兰大白兔不同解剖部位来源的ASCs的功能差异。但本研究目前还无法明确其中的机制,我们推测在发育过程中,来源于不同胚层可能对此有所影响,还可能与不同部位的代谢水平差异相关。
总而言之,不同解剖部位来源的ASCs将影响组织工程的最终结果,因此选择细胞的来源非常重要。本研究提示皮下脂肪来源的ASCs在细胞增殖、活性和分化功能上更好,可作为脂肪干细胞取材的首选部位。
[1] Atala A.Tissue engineering and regenerative medicine:concepts for clinical application[J].Rejuvenation Res,2004,7(1):15-31.
[2] Gimble J M,Katz A J,Bunnell B A.Adipose-derived stem cells for regenerative medicine[J].Circ Res,2007,100(9):1249-1260.
[3] Saber S E.Tissue engineering in endodontics[J].J Oral Sci,2009,51(4):495-507.
[4] Theoret C.Tissue engineering in wound repair:the three“R”s-repair,replace,regenerate[J].Vet Surg,2009,38(8):905-913.
[5] Zuk P A,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279-4295.
[6] Safford K M,Hicok K C,Safford S D,et al.Neurogenic differentiation of murine and human adipose-derived stromal cells[J].Biochem Biophys Res Commun,2002,294(2):371-379.
[7] Cherubino M,Marra K G.Adipose-derived stem cells for soft tissue reconstruction[J].Regen Med,2009,4(1):109-117.
[8] Mizuno H.Adipose-derived stem cells for tissue repair and regeneration:ten years of research and a literature review[J].J Nippon Med Sch,2009,76(2):56-66.
[9] Fraser J,Wulur I,Alfonso Z,et al.Differences in stem and progenitor cell yield in different subcutaneous adipose tissue depots[J].Cytotherapy,2007,9(5):459-467.
[10] Hauner H,Entenmann G.Regional variation of adipose differentiation in cultured stromal-vascular cells from the abdominal and femoral adipose tissue of obese women[J].Int J Obes,1991,15(2):121-126.
[11] Hauner H,Wabitsch M,Pfeiffer E F.Differentiation of adipocyte precursor cells from obese and nonobese adult women and from different adipose tissue sites[J].Horm Metab Res Suppl,1988,19:35-39.
[12] Hausman D B,Park H J,Hausman G J.Isolation and culture of preadipocytes from rodent white adipose tissue[J].Methods Mol Biol,2008,456:201-219.
[13] Jurgens W J,Oedayrajsingh-Varma M J,Helder M N,et al.Effect of tissue-harvesting site on yield of stem cells derived from adipose tissue:implications for cell-based therapies[J].Cell Tissue Res,2008,332(3):415-426.
[14] Prunet-Marcassus B,Cousin B,Caton D,et al.From heterogeneity to plasticity in adipose tissues:site-specific differences[J].Exp Cell Res,2006,312(6):727-736.
[15] Schipper B M,Marra K G,Zhang W,et al.Regional anatomic and age effects on cell function of human adipose-derived stem cells[J].Ann Plast Surg,2008,60(5):538-544.
[16] Shahparaki A,Grunder L,Sorisky A.Comparison of human abdominal subcutaneous versus omental preadipocyte differentiation in primary culture[J].Metabolism,2002,51(9):1211-1215.
[17] Toyoda M,Matsubara Y,Lin K,et al.Characterization and comparison of adipose tissue-derived cells from human subcutaneous and omental adipose tissues[J].Cell Biochem Funct,2009,27(7):440-447.
[18] van Harmelen V,Rohrig K,Hauner H.Comparison of proliferation and differentiation capacity of human adipocyte precursor cells from the omental and subcutaneous adipose tissue depot of obese subjects[J].Metabolism,2004,53(5):632-637.
[19] Zuk P A,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[20] de Girolamo L,Lopa S,Arrigoni E,et al.Human adipose-derived stem cells isolated from young and elderly women:their differentiation potential and scaffold interaction during in vitro osteoblastic differentiation[J].Cytotherapy,2009,11(6):793-803.
[21] Kang H M,Kim J,Park S,et al.Insulin-secreting cells from human eyelid-derived stem cells alleviate type I diabetes in immunocompetent mice[J].Stem Cells,2009,27(8):1999-2008.

