富半胱氨酸61表达与哮喘气道炎症间关系的探讨*
曹 勇, 陈辉龙, 方慧娟
华中科技大学同济医学院附属同济医院呼吸与危重病学科,武汉 430030
支气管哮喘(以下简称哮喘)是内科的常见病和多发病。限于对其发病机制的有限认识,目前仍有一部分患者的症状难以得到完全控制。这促使我们不断地进一步探讨其发病机制。
研究表明,哮喘是一种由多种细胞和细胞组分参与的气道慢性炎症性疾病,气道上皮细胞、嗜酸性粒细胞、Th2淋巴细胞、Th17淋巴细胞及Eotaxin、多种白细胞介素(interleukin,IL)等组成了一个复杂的网络系统推动炎症的进展,但是这其中有许多具体分子调控环节尚不清楚。
富半胱氨酸61(cysteine-rich 61 protein,cyr61,亦称CCN1),是一种富含半胱氨酸的分泌型细胞外基质蛋白,属于CNN 家族成员之一。cyr61具有促进细胞粘附、趋化、增殖以及血管生成等功能,其可参与肌肉神经的损伤修复过程,微血管再生,细胞免疫应答,以及肿瘤细胞的炎症反应等多种疾病的病理生理过程[1-2]。近期文献表明给予小鼠重组cyr61可促进损伤气道上皮细胞的修复[3]。但是,cyr61在哮喘中的作用尚未见研究报道。
本实验拟通过免疫组织化学方法检测cyr61在哮喘小鼠模型肺组织中的表达,并进一步分析其与气道炎症间可能的联系。
1 材料和方法
1.1 实验动物造模与分组
动物实验全程依据《华中科技大学实验动物管理办法条例》执行。24只清洁级雌性BALA/c小鼠购于华中科技大学同济医学院实验动物学部,鼠龄6周,体重(20±2)g。小鼠随机分为哮喘组、地塞米松干预组、孟鲁司特钠干预组以及正常对照组,每组6只小鼠。哮喘组小鼠参考我科实验室既往方法[4],即通过卵清蛋白(ovalbumin,OVA)致敏和激发的方法制作哮喘小鼠模型。小鼠在第1天和第8天通过腹腔注射40μg OVA(购于美国Sigma公司)和4.5mg Al(OH)3佐剂,于实验第22天至24天每天以2% OVA 雾化激发小鼠30min。地塞米松干预组在制作哮喘模型同时,于每次激发后腹腔注射地塞米松(1.7mg/kg)干预。孟鲁司特钠干预组在制作哮喘模型同时,于每次激发后灌胃给予孟鲁司特钠500μg(默沙东制药,英国)干预。实验第25天结束,取小鼠右肺中叶做常规石蜡切片,苏木精-伊红(HE)染色,光学显微镜下观察肺组织病理学变化,以观察模型是否成功。
1.2 支气管肺泡灌洗液的处理
通过气管插管以1mL无菌PBS平衡液反复灌洗鼠肺3次,并回收支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)。BALF 以4℃、400g离心5min。收集上清液-70℃保存以备ELISA检测。细胞沉淀重悬后通过瑞氏-吉姆萨染色分类计数各种炎性细胞。
1.3 免疫组织化学法检测cyr61表达
山羊抗小鼠cyr61一抗购于美国Santa Cruz公司,SP 检测试剂盒及DAB 显色剂购于武汉博士德生物工程有限公司。实验步骤参照说明书进行。其中一抗cyr61工作浓度为1∶100,4℃孵育过夜。实验中以无菌生理盐水代替一抗作为阴性对照,以已知阳性片作阳性对照。阳性细胞胞质染色呈棕黄色。采用HMIAS-2000高清晰度彩色医学图文分析系统进行图像分析,每张病理切片400倍镜下随机选取10个视野,计数阳性细胞的平均灰度值。
1.4 ELISA法检测BALF中IL-4、IL-17A含量
IL-4和IL-17A 检测试剂盒购于美国R&D 生物公司,实验参照试剂盒说明书进行。所有样品均采用双复孔检测,计算均值。
1.5 统计学处理
2 结果
2.1 哮喘模型的建立
哮喘组小鼠OVA 激发当时即出现明显呼吸急促,行动迟缓。连续激发3d 后,小鼠毛色失去光泽,反应迟钝。病理切片观察发现细、小支气管壁和伴行动脉周围有较多嗜酸性细胞和淋巴细胞浸润,支气管皱襞增多延长,杯状细胞增生明显,平滑肌增厚,管腔缩窄。地塞米松和孟鲁司特组小鼠上述指证均较哮喘组明显减轻(图1)。

图1 不同干预组小鼠肺组织HE染色图片(×100)Fig.1 HE staining analysis of the pathological changes of mouse lung tissues in the different groups(×100)
2.2 各组小鼠BALF中炎性细胞比较
地塞米松和孟鲁司特组来源的BALF 中有核细胞(nucleated cells)总数、嗜酸性粒细胞(eosinophils)以及淋巴细胞(lymphocytes)数无明显差异,较哮喘组明显减少(P<0.05),但均较正常对照组明显增多(P<0.05)。见图2。
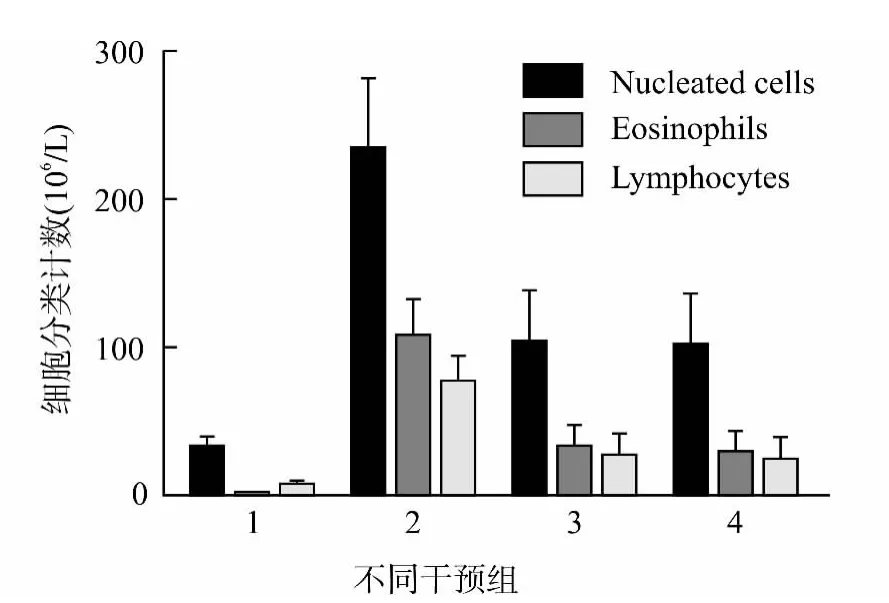
图2 不同干预组支气管肺泡灌洗液中细胞计数Fig.2 Counts of nucleated cells,eosinophils and lymphocytes in BALF in different groups
2.3 各组小鼠BALF中IL-4和IL-17A蛋白含量比较
通过ELISA 检测发现地塞米松和孟鲁司特组来源的BALF 中IL-4和IL-17A 水平无明显差异,较哮喘组明显降低(P<0.05),但均较正常对照组明显增高(P<0.05)。见图3、4。

图3 不同干预组支气管肺泡灌洗液中IL-4蛋白水平比较Fig.3 Comparison of the level of IL-4in BALF in different groups
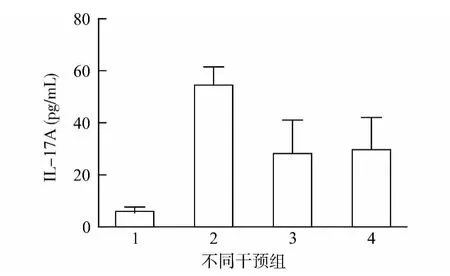
图4 不同干预组支气管肺泡灌洗液中IL-17A 蛋白水平比较Fig.4 Comparison of the level of IL-17Ain BALF in different groups
2.4 小鼠肺组织中cyr61表达比较
通过免疫组化对cyr61进行检测,发现其主要表达于小气道上皮细胞胞质中。在哮喘小鼠中,其表达明显增强,并且气道周围浸润的炎症细胞中亦有表达。通过灰度值分析进一步发现:地塞米松和孟鲁司特组来源的肺组织中cyr61 表达无明显差异,较哮喘组明显减轻(P<0.05),但均较正常对照组明显增强(P<0.05)。见图5、6。
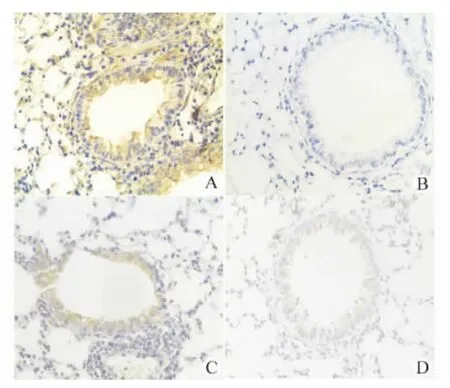
图5 免疫组化检测小鼠肺组织中cyr61的表达(DAB 显色,×200)Fig.5 Immunohistochemistry staining showing the expression of cyr61in the airways of mice in different groups(DAB,×200)
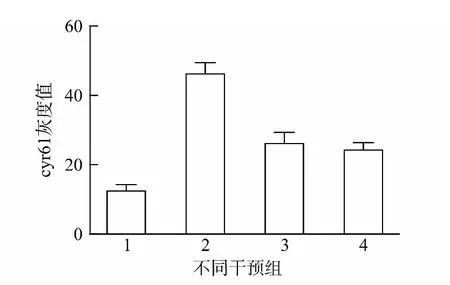
图6 不同组别中cyr61灰度值的比较Fig.6 Comparison of the gray value of cyr61protein in different groups
2.5 小鼠肺组织中cyr61表达与气道炎症间关系分析
通过相关性分析发现,cyr61与BALF中有核细胞总数(r=0.787 4)、淋巴细胞数(r=0.726 6)、嗜酸性粒细胞数(r=0.748 2)、IL-4(r=0.842 9)以及IL-17A 水平(r=0.715 7)均呈正相关(均P<0.05)。
3 讨论
在本实验中,我们通过传统方法,即以OVA 致敏及激发小鼠的方法,制作了以嗜酸性粒细胞肺浸润为主的哮喘小鼠模型。在此基础上,考虑到糖皮质激素和白三烯拮抗剂目前是《全球哮喘防治倡议》所推荐的控制轻度哮喘的一线用药,因而,被选取作为研究哮喘气道炎症变化的干预试剂。
通过免疫组化对cyr61蛋白进行检测,发现其主要表达于小气道上皮细胞的胞质中。在哮喘小鼠中,其表达明显增多,并且气道周围浸润的炎症细胞中亦有表达。在使用地塞米松或孟鲁司特治疗后,哮喘小鼠气道上皮细胞中cyr61蛋白表达均明显减少。在本实验中观察到cyr61在哮喘不同状态下,气道上皮细胞中含量有所变化,这提示cyr61可能参与了哮喘的病理生理过程。
目前研究表明:气道上皮细胞在哮喘的发病机制中扮演着重要角色。气道上皮细胞作为与呼吸道局部外来抗原接触的首道防线,对免疫反应的激活有重要作用。它可以合成并释放多种细胞因子和趋化因子,如IL-25、IL-33、IL-8、CC 型趋化因子配体(CC chemokine ligand,CCL)-6以及CCL20等,影响炎症细胞的趋化和功能活化[5-10]。cyr61 表达于气道上皮细胞,因而我们进一步分析它与有核细胞总数、淋巴细胞、嗜酸性粒细胞及炎症因子IL-4和IL-17的相关性。我们发现,cyr61与BALF中有核细胞总数、淋巴细胞数、嗜酸性粒细胞数呈正相关。同时针对性选择Th2细胞炎症的代表性因子IL-4和Th17细胞炎症的代表性因子IL-17A 进行分析,发现cyr61亦与之呈正相关。结合以上的数据和分析,cyr61可能参与了哮喘的气道炎症这一重要病理生理过程。
在既往的研究中,cyr61 被发现参与了肺损伤[11]和肺纤维化[12]的病理生理过程。cyr61 可以与多种细胞粘附分子受体如整合素α2β1,α6β1,αvβ5,αIIbβ3,αMβ2 以及αDβ2 等硫酸乙酰肝素蛋白多糖(heparan sulfate proteoglycans,HSPGs)结合发挥作用[13-15]。cyr61通过p53信号途径活化Bax和细胞色素C诱导纤维细胞凋亡。cyr61还可通过细胞外信号调节激酶(ERK)和核转录因子NF-κB 等信号途径影响细胞合成和分泌。在本实验中,哮喘小鼠气道上皮中cyr61异常增高,分析原因,有可能是通过粘附分子,或是通过影响ERK 或NF-κB,或是通过影响凋亡,或是通过其他途径影响气道炎症。其中的具体环节及可能的机制还有待进一步探讨。
[1] Lau L F.CCN1/CYR61:the very model of a modern matricellular protein[J].Cell Mol Life Sci,2011,68(19):3149-3163.
[2] Kular L,Pakradouni J,Kitabgi P,et al.The CCN family:a new class of inflammation modulators[J].Biochimie,2011,93(3):377-388.
[3] Zemans R L,McClendon J,Aschner Y,et al.Role ofβ-catenin-regulated CCN matricellular proteins in epithelial repair after inflammatory lung injury[J].Am J Physiol Lung Cell Mol Physiol,2013,304(6):L415-L427.
[4] Gu N,Kang G,Jin C,et al.Intelectin is required for IL-13-induced monocyte chemotactic protein-1 and-3 expression in lung epithelial cells and promotes allergic airway inflammation[J].Am J Physiol Lung Cell Mol Physiol,2010,298(3):L290-L296.
[5] Cardinale F,Giordano P,Chinellato I,et al.Respiratory epithelial imbalances in asthma pathophysiology [J].Allergy Asthma Proc,2013,34(2):143-149.
[6] Müller L,Jaspers I.Epithelial cells,the"switchboard"of respiratory immune defense responses:effects of air pollutants[J].Swiss Med Wkly,2012,142:w13653-w13659.
[7] Crosby L M,Waters C M.Epithelial repair mechanisms in the lung[J].Am J Physiol Lung Cell Mol Physiol,2010,298(6):L715-L731.
[8] 李丹,夏传生,李娜萍,等.p120连环蛋白表达变化对NF-κB信号通路的影响及有关机制[J].华中科技大学学报:医学版,2011,40(3):291-295.
[9] 孙晓丽,刘瑾,许淑云,等.纤维粘连蛋白在哮喘气道平滑肌细胞免疫功能调控中的作用[J].华中科技大学学报:医学版,2011,40(2):183-187.
[10] 王尧,杨青,郭锋,等.哮喘气道重塑与氧化应激的实验研究[J].华中科技大学学报:医学版,2011,40(4):457-462.
[11] Wallace M J,Probyn M E,Zahra V A,et al.Early biomarkers and potential mediators of ventilation-induced lung injury in very preterm lambs[J].Respir Res,2009,10(1):19-33.
[12] Ning W,Li C J,Kaminski N,et al.Comprehensive gene expression profiles reveal pathways related to the pathogenesis of chronic obstructive pulmonary disease[J].Proc Natl Acad Sci U S A,2004,101(41):14895-14900.
[13] Chuang J Y,Yu N Y,Chiang I P,et al.Cyr61increases matrix metalloproteinase-3expression and cell motility in human oral squamous cell carcinoma cells[J].J Cell Biochem,2012,113(6):1977-1986.
[14] Gery S,Xie D,Yin D,et al.Ovarian carcinomas:CCN genes are aberrantly expressed and CCN1promotes proliferation of these cells[J].Clin Cancer Res,2005,11(20):7243-7254.
[15] Su J L,Chiou J,Tang C H,et al.CYR61regulates BMP-2-dependent osteoblast differentiation through the{alpha}v{beta}3integrin/integrin-linked kinase/ERK pathway [J].J Biol Chem,2010,285(41):31325-31336.
——记华中科技大学哲学系教授欧阳康

