EGCG 对口腔鳞癌细胞增殖及信号传导通路的影响
刘晓亮, 袁长吉, 庄 平, 韩 薇, 赵 欣
1吉林大学第一医院肿瘤中心,长春 130021
2广东医学院附属南山医院儿科,深圳 518052
3吉林大学第一医院小儿呼吸二科,长春 130021
绿茶的水溶性提取物含有多酚类化合物儿茶素,儿茶素具有多种药用功效[1],其中表没食子儿茶素没食子酸(EGCG)是最主要的生物活性成分,也最具药用功效。早已发现EGCG 具有抗肿瘤活性,可抑制肿瘤细胞增殖、血管生成和诱导肿瘤细胞凋亡等,而对正常细胞无毒副作用[2-3]。本研究根据EGCG 对不同人口腔鳞癌细胞株增殖及信号传导通路的影响,探讨EGCG 的抗肿瘤的机制,为将EGCG 应用于临床肿瘤治疗奠定基础,并为EGCG的开发应用提供实验依据。
1 材料和方法
1.1 材料
EGCG 购于Sigma公司(E4143,≥95%)。将EGCG 溶解蒸馏水中,配置成浓度为5mg/mL的溶液。室温下涡旋1min,37℃孵育1h。离心机5 000 r/min离心10 min,取上清去除未溶解的物质,用0.22μm 的过滤器过滤上清以达到灭菌的目的,用培养液稀释EGCG 至终浓度0~200μg/mL。
1.2 细胞系及培养
鳞癌细胞系CAL-27、SCC-25、KB 来自于美国Type Culture Collection (Manassas,VA)。CAL-27细胞系为人类舌上皮细胞癌细胞系,细胞培养于含10%胎牛血清、100 U/mL 青霉素/链霉素的DMEM 培养液中,37℃、5%CO2条件下常规传代培养。KB细胞系为人类口腔上皮癌细胞系,SCC-25细胞系为舌鳞状上皮癌细胞系。KB 细胞和SCC-25细胞均培养于DMEM∶Ham’s F12=1∶1的培养液中,其中含10%胎牛血清、100U/mL 青霉素/链霉素,37℃、5%CO2条件下常规传代培养。每2~3天传代1次,取对数生长期细胞用于实验。
1.3 细胞增殖抑制实验及筛选敏感细胞株
应用MTT 方法测定EGCG 对鳞癌细胞的生长抑制作用。将对数生长期的细胞分别种在96孔培养板中,密度为5×103/孔,5%CO2条件下培养24h后,分别给予不同浓度的EGCG (0、5、12.5、25、50、100、200μg/mL),每组均为3 个复孔,共培养72h。72h后每孔中加入8μL浓度为5mg/mL的MTT,孵育3h后弃孔内上清液,加入100μL二甲基亚砜(DMSO)溶解结晶物,立即应用酶标仪ELx800 (Bio-Tek Instruments,Inc.,Winooski,VT)在波长570nm 测定吸光度(A)值,以上实验至少重复2次。
1.4 流式细胞术检测
将对数生长期细胞种于6孔培养板内,密度为5×105/孔,培养24h 后,加入不同浓度的EGCG(0、12.5、25、50μg/mL),共培养72h。PBS洗涤离心2 次,加入70%冷乙醇固定30 min,染色前用PBS离心沉淀去除固定液,加入200μL RNase,在37℃水浴30min再加入800μL碘化丙啶(PI)染色液混匀,于4℃避光30min,用FCM 进行检测并用其软件分析结果。
1.5 Protein Pathway Array技术检测蛋白表达
在直径为10cm 的培养皿中培养细胞,密度至1×106/L。培养24h后加入50μg/mL 的EGCG,共孵育48h。48h后分别收集细胞,在4℃下1 000 r/min离心10 min,弃上清培养液,再用PBS 洗涤细胞2次,收集下层沉淀物。在沉淀的细胞中加入300μL 含有蛋白酶抑制剂(Roche Applied Science,Indianapolis,IN)的细胞裂解液(Cell Signaling Technology,Danvers,MA),裂解细胞3~5 min,超声处理裂解物15s,共2 次,然后4℃下14 000r/min离心15 min。用BCA 蛋白测定试剂盒(Pierce,Rockford,IL)测定蛋白浓度。把含300μg蛋白的细胞提取物加入到一个跨越全胶宽度的槽中,应用SDS聚丙烯酰胺凝胶电泳分离蛋白。将蛋白转到硝基纤维素膜上,在5%的牛奶或3%BSA中室温孵育1h,用带有20个泳道的装置(Bio-Rad,Hercules,CA)夹膜。在每个泳道中加入2 或3 种一抗,4℃过夜。洗膜后加入二抗,室温孵育45 min。用ChemiDoc XRS系统显像,扫描吸光度,不同吸光度值对应的蛋白表达水平。每种样品以上实验至少重复2次。
1.6 蛋白印迹分析
应用Western blot进一步验证Protein Pathway Array技术检测蛋白表达变化。选择CAL-27细胞系作为代表验证Cdk4、Cdk6、p-PDK1几种蛋白的表达改变。在直径为10cm 的培养皿中培养细胞,密度至1×106/L。培养24h后加入EGCG(浓度为0、5、12.5、25、50μg/mL),共孵育48h。48h后分别收集细胞,在4℃下1 000r/min 离心10 min,弃掉上清培养液,再用PBS洗涤细胞2次,收集下层沉淀物。按照上述方法提取蛋白,将20μg蛋白经10%的SDS聚丙烯酰胺凝胶电泳转移到硝基纤维素膜上。在硝基纤维素膜上加入Cdk4、Cdk6、p-PDK1(1∶1 000稀释;Santa Cruz Biotechnology,Santa Cruz,CA)的一抗,4℃过夜。洗膜后加入抗鼠的二抗,室温孵育1h后应用放射自显影技术检测蛋白发射信号,以β-actin(1∶10 000 稀释,Sigma)作为内参照。
1.7 裸鼠移植瘤模型建立
取对数生长期KB 细胞经0.25%胰酶消化,吹打成单细胞悬液并离心,用无血清培养液离心洗涤1~2次,并计数,PBS调整细胞密度至1.0×107个/mL。戴无菌手套,75%乙醇棉球消毒接种部位。用1mL注射器抽取瘤细胞悬液0.2 mL(含细胞2×106个),接种于裸鼠右侧前肢肩背部皮下,共接种20只。每只接种1个点。接种后观察并记录肿瘤发生的时间。用精密游标卡尺测量肿瘤的大小。
1.8 实验动物的分组和处理方法
当肿瘤长至4~6mm 大小时,将成瘤裸鼠按随机数字表随机分为2组:对照组、EGCG 组,每组10只。EGCG 组:按25mg/kg灌胃,每日1次。对照组:等量生理盐水灌胃,每日1次。连续给药并观察4周,每周测量裸鼠肿瘤最长径(a,mm)和与长径垂直的短径(b,mm),以公式V(mm3)=ab2/2计算肿瘤体积。4 周后处死裸鼠,剥取瘤体并称重(W)。计算体积抑制率=(1-V实验组/V对照组)×100%,质量抑制率=(1-W实验组/W对照组)×100%。
1.9 统计学分析
所有体外实验重复3次,Protein Pathway Array重复2次。应用统计学软件包SPSS 10.0,数据用均数±标准差(±s)表示,用方差分析(ANOVA)对结果进行统计处理,以P<0.05为差异有统计学意义。
2 结果
2.1 EGCG 对不同鳞癌细胞株的抑制作用
不同浓度的EGCG(0、5、12.5、25、50、100、200 μg/mL)对CAL-27、SCC-25、KB 细胞作用72h 的增殖抑制率见图1。对CAL-27、KB、SCC-25的IC50值分别为59.0、102.5、102.5μg/mL。由此可见,EGCG 对3种类型的人鳞癌细胞系均有抑制作用,并呈剂量依赖性,对CAL-27细胞抑制作用最强,对SCC-25和KB细胞的抑制作用相似。
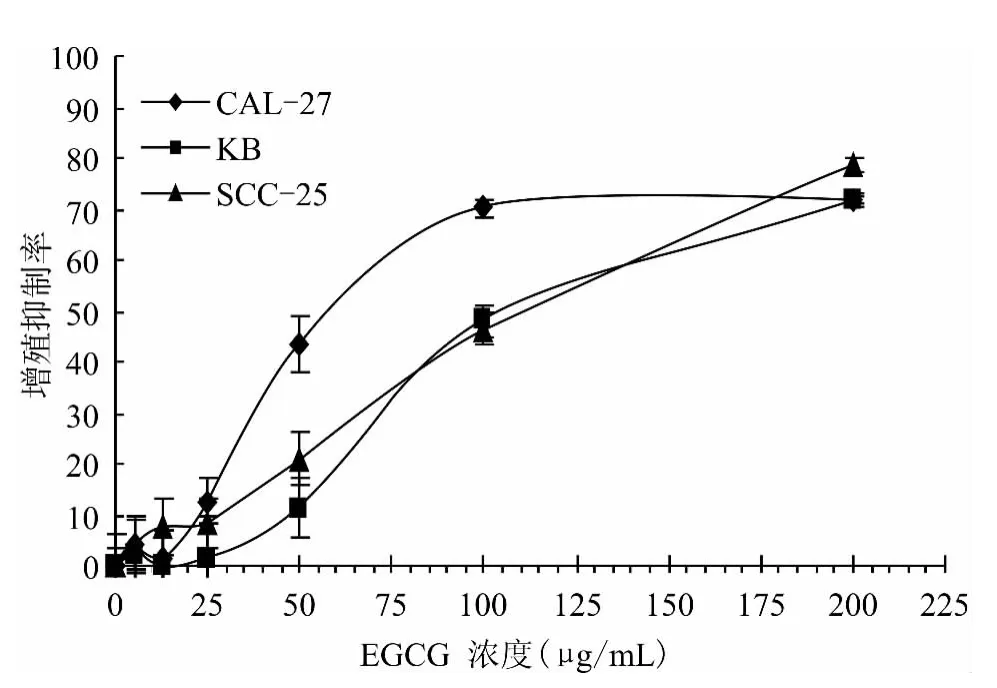
图1 不同浓度的EGCG 对CAL-27、KB、SCC-25细胞的生长抑制作用Fig.1 Inhibitory effect of EGCG of different concentrations on the growth of CAL-27,KB and SCC-25cells
2.2 EGCG 对CAL-27细胞周期的影响
由于CAL-27对EGCG 最为敏感,因此我们选择了CAL-27 细胞进一步研究了EGCG 对其在细胞周期方面的影响。CAL-27 细胞经不同浓度EGCG(0、12.5、25、50μg/mL)作用72h后,进行流式细胞仪细胞周期检测,细胞周期分析显示,EGCG可以介导CAL-27 细胞S 期和G2/M 期阻滞,而G0/G1期细胞减少(与对照组相比,P<0.05)(图2和表1)。EGCG(50μg/mL)作用于CAL-27 细胞后,阻滞在S期的细胞升至10.67%,阻滞在G2/M期的细胞升至12.80%(图2)。
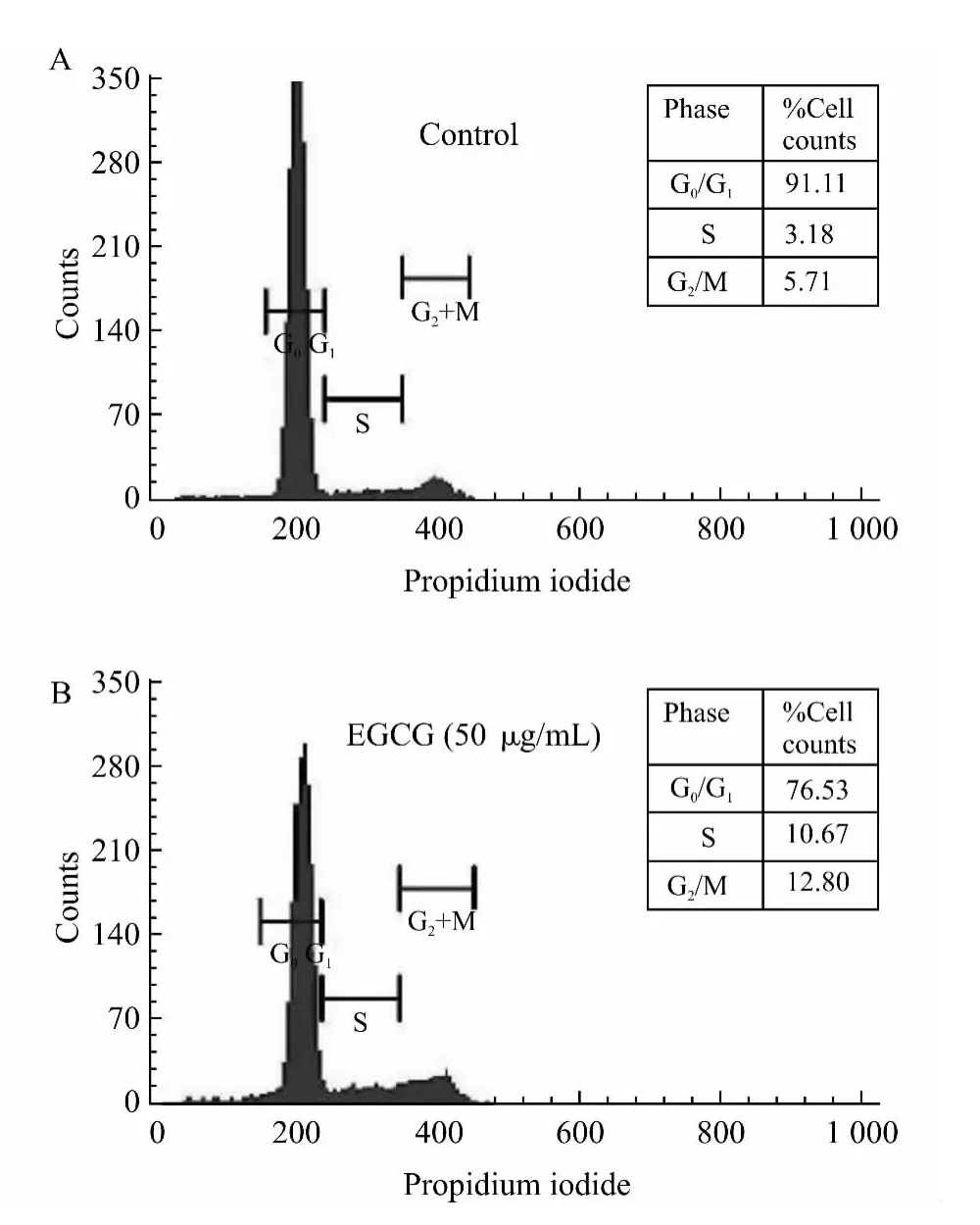
图2 EGCG 处理CAL-27细胞后的周期分布Fig.2 Effect of EGCG on the cell cycle distribution of CAL-27 cells
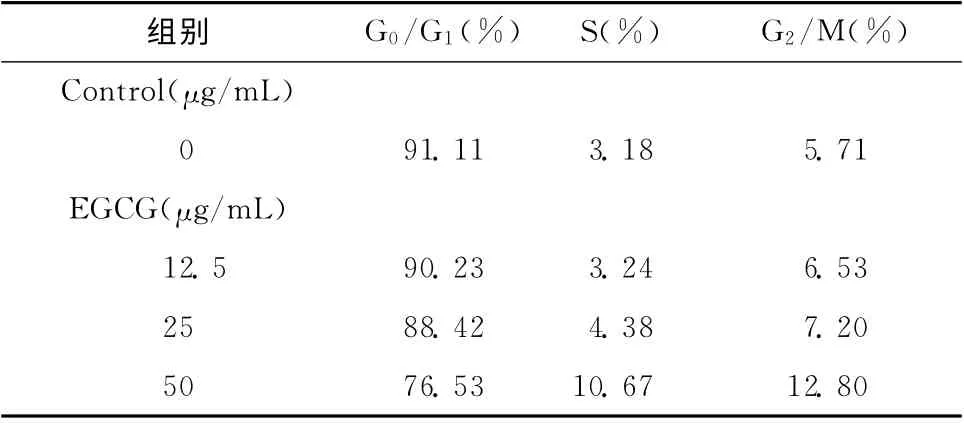
表1 不同浓度EGCG 处理CAL-27细胞后的周期分布Table 1 Effects of EGCG of different concentrations on the cell cycle distribution of CAL-27cells
2.3 EGCG 对CAL-27细胞蛋白表达的影响
应用Protein Pathway Array技术分析EGCG对CAL-27细胞蛋白表达的影响,共检测107个磷酸化和非磷酸化蛋白,共有15种蛋白发生了明显变化(图3、4)。其中XIAP、Akt蛋白表达水平上调,p-ERK、p-PDK1、p-cdc2、p-RB、Cdk6、Cdk4、Cdk2、Cdc2P34、Cyclin D1、Cyclin E、cPKCα、PTEN、p53蛋白表达水平下调。Western blot确认了以下结果:在CAL-27 细胞中EGCG 对p-PDK1、Cdk4、Cdk6的表达抑制是呈剂量依赖性的(图5)。

图3 应用Pathway Array技术检测信号传导相关蛋白表达示例图Fig.3 Pathway Array showing the expression of the signaling-related proteins
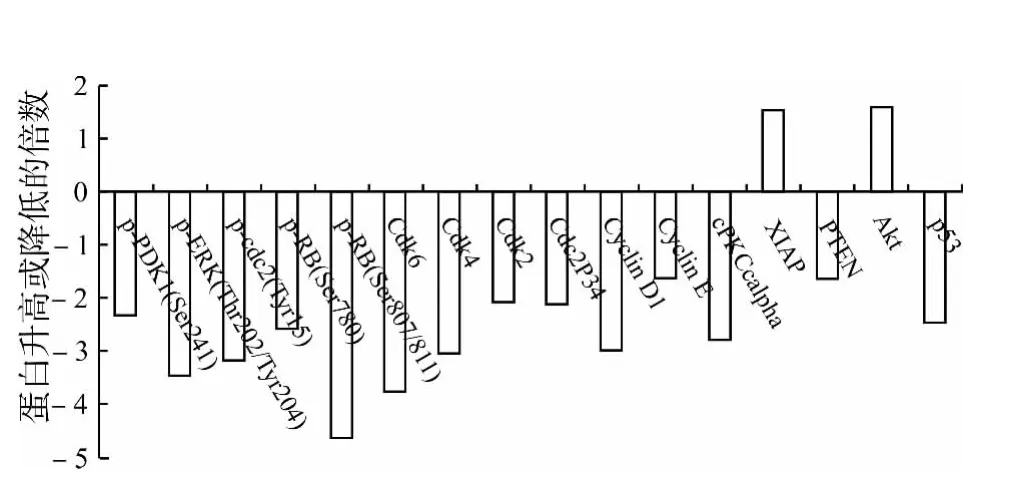
图4 EGCG(50μg/mL)处理CAL-27细胞48h后的蛋白表达变化Fig.4 Differential expression of proteins of CAL-27cells treated with 50μg/mL EGCG for 48h
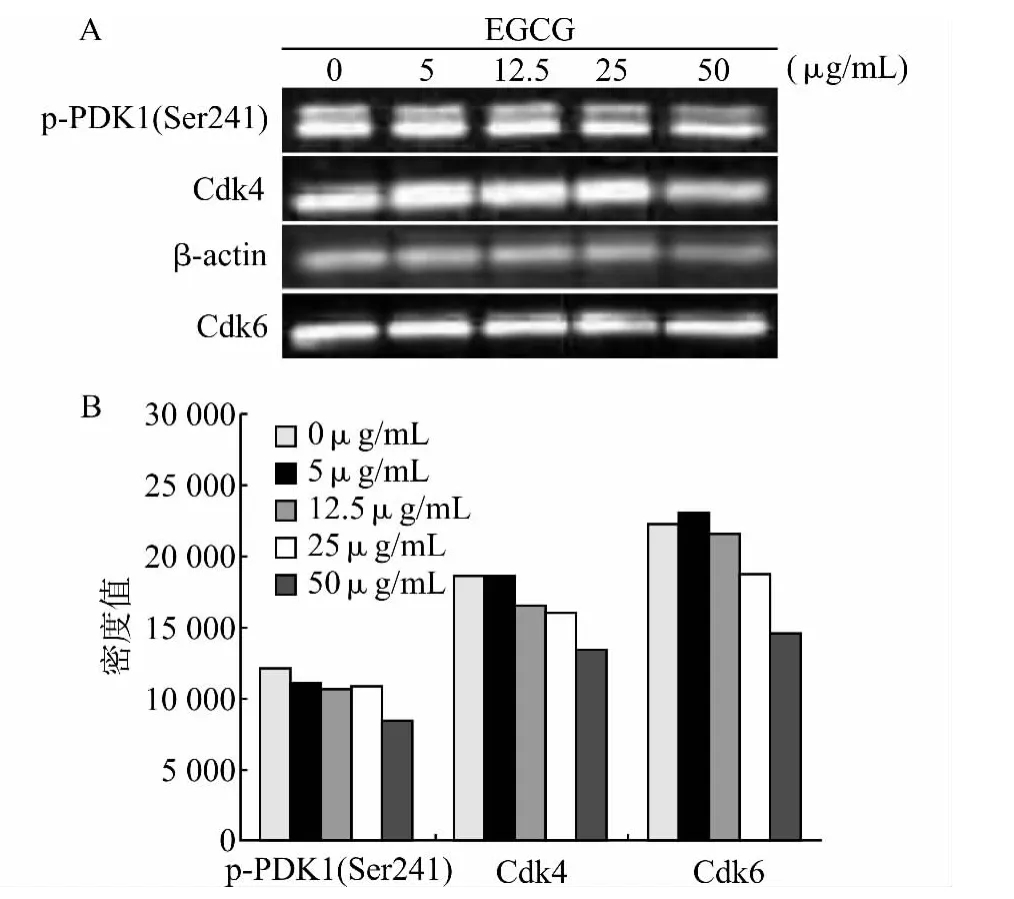
图5 应用Western blot技术检测不同浓度EGCG 处理CAL-27细胞后Cdk6、Cdk4、p-PDK1的表达情况Fig.5 Western blot analysis of expression of Cdk6,Cdk4and p-PDK1in CAL-27cells treated with various concentrations of EGCG
2.4 EGCG 对裸鼠移植瘤的影响
EGCG 对移植瘤的生长有显著的抑制作用,见表2。
表2 EGCG 组、对照组裸鼠移植瘤生长情况比较(±s,n=10)Table 2 Comparison of growth of tumor xenografts between EGCG and control groups(±s,n=10)

表2 EGCG 组、对照组裸鼠移植瘤生长情况比较(±s,n=10)Table 2 Comparison of growth of tumor xenografts between EGCG and control groups(±s,n=10)
组别瘤体积(cm3)体积抑制率(%)瘤重(g)质量抑制率(%5.259±0.457-2.992±0.240-EGCG 组对照组1.482±0.324 71.82 0.763±0.210 74.50
3 讨论
传统的化疗药物具有副作用大,患者依从性差等缺点,因而有必要研究开发低毒而有效的抗癌药物。茶多酚是从绿茶中提取出来的多酚类化合物,其成分包括儿茶素、黄烷双醇、黄酮类和茶多酚酸类,其中儿茶素是茶多酚的主要成分。EGCG 是儿茶素主要组成部分,亦是其最主要的活性成分[4]。大量的流行病学调查及体内外的实验研究证实EGCG 对皮肤癌、肺癌、前列腺癌、膀胱癌、胃癌等具有明显的抗癌活性[5-7],并且对正常的细胞无明显的毒副作用。
Rieger-Christ等[8]的研究发现EGCG 在体外实验中对多种肿瘤细胞均有抑制作用,本研究结果显示EGCG 在体外对人口腔鳞癌细胞有明显的抑制作用,EGCG 对CAL-27、KB、SCC-25细胞的增殖均有抑制作用,并呈剂量依赖性,EGCG 对CAL-27细胞抑制作用最强。本研究动物体内实验显示EGCG 对口腔鳞癌移植瘤肿瘤的生长有显著的抑制作用。我们通过流式细胞术观察EGCG 对细胞周期的影响,EGCG 可以介导CAL-27细胞周期S期和G2/M 期阻滞,G0/G1期细胞减少。虽然发现细胞在亚-G1期也有轻度的增加(图2),但影响凋亡仍不是EGCG 抑制细胞生长的主要机制,实验结果显示EGCG 处理细胞并未导致前凋亡蛋白的表达上调也进一步证实了这一观点(图4)。细胞周期与肿瘤发生之间存在密切的联系,细胞周期调控机制的紊乱可导致细胞失控性增长,最终导致肿瘤的发生。
应用Protein Pathway Array技术分析蛋白表达显示EGCG 可以激活许多信号传导通路或导致其蛋白表达的变化,EGCG 主要影响CAL-27 的EGFR 和Notch 信号传导通路。Notch、EGFR 信号通路是许多细胞信号传导通路的交汇点,在细胞增殖、分化及凋亡中起着重要作用,不仅影响正常组织和细胞生长、发育,而且和一些肿瘤的发生、发展相关。信号传导通路网络复杂,EGCG 可以靶向多个细胞传导通路途径[9-11],通过多个靶点导致对CAL-27细胞株的抑制作用。实验结果显示EGCG作用于CAL-27细胞系后,有多种蛋白表达水平发生改变(图3、5),其中包括与信号传导有关的蛋白、与细胞周期或细胞增殖相关蛋白、肿瘤抑制基因、细胞凋亡抑制蛋白等,而且还有许多蛋白的磷酸化水平受到影响。Sadava等[12]研究发现EGCG 可以抑制细胞周期相关蛋白Cyclin D1、Cdk4、Cdk6 的表达从而抑制细胞增殖,本研究中EGCG 导致p-PDK1、p-ERK、p-Cdc2、Cdk6、Cdk4、Cdk2、Cyclin E等与细胞增殖相关蛋白表达下调,而且Western blot确认了EGCG 对p-PDK1、Cdk4、Cdk6的表达抑制是呈剂量依赖性的(图5)。EGCG 也可导致一些与增殖相关的蛋白表达上调,例如Notch4 表达上调,分析原因可能是细胞通过信号传导通路的改变来对生长抑制进行代偿。本实验发现EGCG 明显抑制了CAL-27 细胞中ERK 的磷酸化,与Lu等[13]报道的关于致癌物(NNK)介导的鼠肺癌模型中EGCG 可以减少ERK 磷酸化的结果一致。EGCG 引起CAL-27 细胞周期蛋白水平的改变(Cdc2、Cdk6、Cdk4、Cdk2、Cyclin D1、Cyclin E)导致S 期和G2/M 期阻滞。EGCG 处理细胞后只有一种凋亡相关蛋白XIAP 发生改变,与细胞周期分析结果一致,提示抑制凋亡并非EGCG 抑制细胞增殖的主要途径,EGCG 主要是通过改变细胞周期蛋白水平、抑制细胞增殖来发挥其抗癌效应的。
综上,EGCG 能够抑制人口腔鳞癌细胞增殖,对细胞信号传导通路的全面检测及评价显示EGCG对信号传导网络影响显著。信号传导网络的改变是复杂的,不能用单一某种信号通路的改变来解释EGCG 的作用。EGCG 作用于肿瘤细胞整体的信号网络的多条信号传导通路,从而抑制了肿瘤细胞的生长。
[1] Suganuma M,Saha A,Fujiki H.New cancer treatment strategy using combination of green tea catechins and anticancer drugs[J].Cancer Sci,2011,102(2):317-323.
[2] Khan N,Maq F,Saleem M,et al.Targeting multiple signaling pathways by green tea polyphenol(-)-epigallocateehin-3-galhte[J].Cancer Res,2006,66(5):2500-2505.
[3] Shankar S,Ganapathy S,Srivastava R K.Green tea polyphenols:Biology and therapeutic implications in cancer[J].Front Biosci,2007,12:4881-4899.
[4] Ravindranath M H,Saravanan T S,Monteclaro C C,et al.Epicatechins purified from green tea(eamelliasinensis)differentially suppress growth of gender-dependent human cancer cell lines[J].Evid Based Complement Ahemat Med,2006,3(2):237-247.
[5] Suganuma M,Okabe S,Sueoka N,et al.Green tea and cancer chemoprevention[J].Mutat Res,1999,428(5):339-344.
[6] Yang C S,Chung J Y,Yang G Y,et al.Tea and tea polyphenols in cancer prevention[J].J Nutr,2000,130(5):472-478.
[7] Clark J,You M.Chemoprevention of lung cancer by tea[J].Mol Nutr Food Res,2006,50(2):144-151.
[8] Rieger-Christ K M,Hanley R,Lodowsky C,et al.The green tea compound,(-)-epigallocatechin-3-gallate downregulates N-cad herin and suppresses migration of bladder carcinoma cells[J].J Cell Biochem,2007,102(2):377-388.
[9] Koukourakis M I,Giatromanolaki A,Sivridis E,et al.Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma[J].Neoplasia,2005,7(1):1-6.
[10] Qi W,Liu X,Qiao D,et al.Isoform-specific expression of 14-3-3proteins in human lung cancer tissues[J].Int J Cancer,2005,113(3):359-363.
[11] 高漓,张天禹,尤剑鹏,等.EGCG 诱导前列腺癌细胞PC-3凋亡及对Survivin蛋白表达的影响[J].华中科技大学学报:医学版,2011,40(5):580-584.
[12] Sadava D,Whitlock E,Kane S E.The green tea polyphenol,epigallocatechin-3-gallate inhibits telomerase and induces apoptosis in drug-resistant lung cancer cells[J].Biochem Biophys Res Commun,2007,360(1):233-237.
[13] Lu G,Liao J,Yang G,et al.Inhibition of adenoma progression to adenocarcinoma in a 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone-induced lung tumorigenesis model in A/J mice by tea polyphenols and caffeine[J].Cancer Res,2006,66(23):11 494-11 501.

