苯那普利对5/6肾切除大鼠肾脏血管紧张素Ⅱ及时钟基因表达节律的影响*
黄小妹, 陈文莉, 袁静萍, 杨月红, 王 银, 胡晓松, 曾星若, 方 询
武汉市中心医院1肾病科2病理科,武汉 430014
近日节律是生物体24h当中生理及行为的变化规律。在哺乳动物,近日节律的控制器——时钟基因主要在视上核交叉系统(suprachiasmatic nucleus,SCN),近年研究认为在外周组织如心肌细胞、肝脏、肾脏等也有时钟基因的表达,并与生物体的生理及病理变化有关系。目前已发现的哺乳动物时钟基因包括周期基因1-3(period1-3,per1-3)、羟受体核转位蛋白基因(brain and muscle Arnt-Like protein-1,bmal1)、时钟基因(clock)、隐花色素基因(cryptochrome,cry),以及时钟输出基因白蛋白Dbox 结合蛋白基因(Albumin D-element-binding protein,dbp)等[1-3]。
血管紧张素Ⅱ(Angiotensin Ⅱ,AngⅡ)作为一种授时因子可以诱导外周组织时钟基因的表达[4-5],并且作为肾素-血管紧张素系统(renin-angiotensin system,RAS)中的重要成员在慢性肾病(chronic kidney disease,CKD)的病理和发病机制中起重要作用。血管紧张素转换酶抑制剂(Angiotensin-converting enzyme inhibitor,ACEI)不仅抑制循环中AngⅡ活性,还抑制肾组织局部AngⅡ的活性。本研究拟用ACEI类药物苯那普利治疗5/6肾切除大鼠(5/6subtotal nephrectomy,STNx),观察其对肾组织时钟基因per2、bmal1及dbp 及其蛋白产物表达节律的影响。
1 材料和方法
1.1 实验动物
SPF级雄性Wistar大鼠95只,体重200~220 g,由湖北省疾控中心实验动物中心提供并饲养于SPF动物实验室。
1.2 主要试剂
兔抗大鼠PER2 多克隆抗体(sc-25363,美国Santa Cruz公司),兔抗大鼠DBP 多克隆抗体(sc-98411,美国Santa Cruz公司)及兔抗BMAL1多克隆抗体(sc-48790,美国Santa Cruz公司),苯那普利(北京诺华制药有限公司,x1483),AngⅡ放免试剂盒(碘125放射免疫分析药盒,北京科美东雅)。所用引物per2,bmal1及dbp及内参18sRNA 的基因序列通过GenBank获得,见表1。
1.3 造模及分组
Wistar大鼠先适应性喂养7d,随机分为3组,假手术组(30 只),5/6 肾大部切除组(模型组,32只),苯那普利治疗组(BM 组,33只)。造模方法参见以往报道[6-7]。
1.4 取标本
造模后次日将大鼠置于12h-12h明暗交替的环境饲养。7AM 开灯,7PM 关灯。7AM 记为ZT0时,8AM 记为ZT1时,依次类推。造模次日苯那普利治疗组每天早上7AM (ZT0)用苯那普利10mg/kg灌胃,其余两组用等量生理盐水灌胃。大鼠自由进食及饮水。造模后第11周留取24h尿标本检测尿蛋白定量。第12 周处死大鼠。分别在7AM(ZT0),11AM(ZT4),3PM(ZT8),7PM(ZT12),11PM(ZT16),3AM(ZT20)各时间点3组各处死5只大鼠,取出肾组织及血标本。肾组织标本用冰盐水灌洗后置于冻存管中,立即置于液氮罐中,再转移至-80℃冰箱保存备检,检测前将肾组织取出,制备组织均浆。血标本置于肝素钠抗凝管中用于检测肾功能。

表1 引物序列Table 1 Primer Sequences
1.5 放免检测
放免法检测AngⅡ。检测前将肾组织取出,制备组织均浆。分别检测血浆及肾组织均浆中AngⅡ浓度(pg/mL)。由武汉大学附属湖北省人民医院核医学科检测。
1.6 real-time PCR检测
检测肾组织per2,bmal1及dbp基因mRNA 表达。检测方法参见以往报道[6-7]。
1.7 Western blot检测
剪取全肾组织约200mg,加入50μL蛋白裂解液,制备肾组织匀浆,12 000g、4℃,离心30 min。取1μL上清加入99μL 三蒸水中混匀,加500μL考马斯亮蓝混匀,10 min后测浓度,取余下上清与样品缓冲液混合。中高火煮沸7 min,放入-80℃冻存。检测时将样本点在SDS-聚丙酰胺凝胶跑胶,初用60V 跑胶,待跑至分离胶后改用100V,直到溴酚蓝接近跳水。用PVDF 膜转膜,350 mA 30 min。室温条件下,5%脱脂奶粉封闭1h,放在摇床上摇,封一抗,4℃过夜;室温复温20 min PBST 洗膜1h(摇床上摇),封二抗。PBST 洗膜(摇床上摇)1~3h,BCIP∶NBT∶AP buffer按1∶1∶250配成4mL在小皿里避光显色,以β-actin为内参,计算相对吸光度值。
1.8 统计学处理
全部数据采用SPSS 16.0及Matlab7.1统计软件进行处理,计量资料用均数±标准差(±s)表示。组间资料比较采用双因素方差分析(two-way ANOVA)。当时钟基因mRNA 表达符合近日节律时,采用Halberg 余弦法(cosinor)分析,当检测指标不符合余弦函数时,用非配对t检验(unpaired ttest)。研究血浆及肾组织中AngⅡ与肾组织时钟基因及时钟基因蛋白相关性时采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肾功能及24h尿蛋白定量
5/6 肾大部切除大鼠(模型组)12 周时肾功能BUN、Scr明显高于假手术组,尿蛋白排泄量也明显高于假手术组,苯那普利(BM 组)治疗后BUN、Scr及尿蛋白排泄量低于模型组,差异有统计学意义。说明12周时慢性肾衰模型制备成功,苯那普利能改善肾功能,具有肾保护作用,见表2。
表2 各组大鼠肾功能及24h尿蛋白定量(±s,n=5)Table 2 BUN,Scr and 24-h urine protein excretion in each group(±s,n=5)

表2 各组大鼠肾功能及24h尿蛋白定量(±s,n=5)Table 2 BUN,Scr and 24-h urine protein excretion in each group(±s,n=5)
与假手术组比较,*P<0.01;与BM 组比较,#P<0.01
组别 BUN(mmol/L) Scr(mmol/L) 24h尿蛋白定量(mg)假手术组8.2±1.9 35.2±7.4 4.1±1.5模型组28.5±7.6*# 131.2±24.5*#73.8±11.4*#BM 组16.9±5.3*92.4±17.9*32.7±5.3*
2.2 各组大鼠循环及肾组织AngⅡ的表达节律
假手术组肾AngⅡ谷(T)、峰值(P)时间分别在ZT12、ZT4,P/T 为8.48;模型组ZT4 时达峰值,ZT12~ZT20 等时间均在谷值附近波动,P/T 为9.08。用苯那普利治疗后肾AngⅡ水平明显降低,振幅减弱,P/T 为4.74。假手术和模型组间肾AngⅡ水平无统计学差异(P=0.306),BM 组肾AngⅡ水平明显低于假手术和模型组(P=0.012);各组不同时间点肾AngⅡ表达有统计学差异(P<0.05),见图1A。血浆AngⅡ水平假手术组谷、峰值时间分别为ZT0、ZT20,P/T 为1.51;模型组峰值提前至ZT16,P/T 为1.95;BM 组用苯那普利治疗后血浆AngⅡZT4~ZT20均在低水平波动,明显低于假手术和模型组(P<0.05),谷、峰值点分别在ZT4、ZT0,P/T 为3.41。各组不同时间点血浆AngⅡ节律有统计学差异(P=0.018),见图1B。
将图1A 与图1B结合看,肾局部AngⅡ节律与血浆中不一致:假手术组与模型组的肾组织及血浆AngⅡ在各时间点的波动趋势相反,而且AngⅡ在肾局部的水平明显高于血浆。
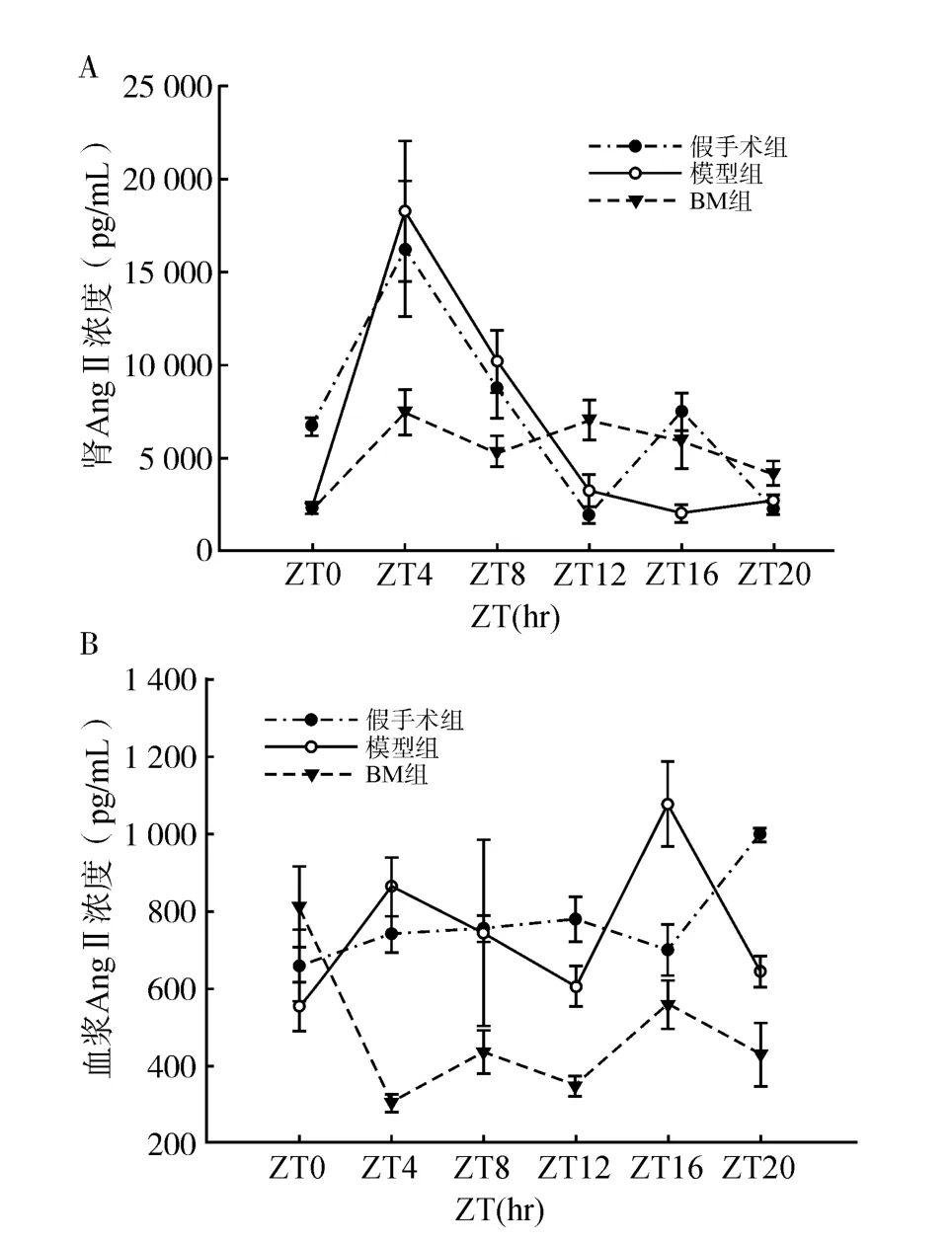
图1 各组肾组织(A)及血浆(B)AngⅡ节律Fig.1 Daily profile of AngⅡin the kidney(A)and plasma(B)in each group
2.3 各组大鼠各时点时钟基因mRNA 表达
见图2。假手术组合模型组bmal1 mRNA 谷峰值点相同,模型组per2 mRNA 峰值时间提前4 h;BM 组bmal1 mRNA 峰值时间后移4h;dbp 及per2mRNA 近日节律消失。具体描述见以往报道[6-7]。
2.4 各组大鼠各时点BMAL1、DBP、PER2蛋白表达
BMAL1蛋白假手术组谷值(T)时间在ZT0时,随后表达逐渐增强,在ZT12达到峰值(P),P/T为2.88;而模型组峰值时间提前到ZT8,振幅增强,P/T 为38.34;BM 组表达趋势及谷、峰值时间与假手术组相似,P/T 为3.16,各组不同时点间差异有统计学意义(P<0.05)。DBP 蛋白假手术组自ZT0到ZT16时均在较高水平表达,谷、峰值时间分别在ZT20及ZT8 时,P/T 为12.29;模型组谷、峰值时间与假手术组相同,但表达水平增强,振幅明显增加,P/T 为103.2;与假手术组比较有统计学意义(P=0.028);BM 组DBP 表达趋势及谷、峰值时间也与假手术组相似,P/T 为21.23,各组不同时点间差异有统计学意义(P<0.05)。PER2假手术组谷、峰值时间分别在ZT16、ZT4,P/T 为8.79,模型组谷、峰值时间均前移4h,分别在ZT12及ZT0,P/T 为9.33,而BM 组PER2谷、峰值时间与模型组相似,P/T 为11.28;各组不同时点间差异有统计学意义(P<0.05),见图3。

图2 各组时钟基因bmal1、dbp及per2mRNA 表达节律(real-time PCR)Fig.2 Daily profile of bmal1,dbp and per2mRNA expression in the kidney in each group(real-time PCR)

图3 各组时钟蛋白BMAL1、DBP及PER2的表达节律(Western blot)Fig.3 Daily profile of the expression of BMAL1,DBP and PER2proteins in the kidney in each group(Western blot)
2.5 各组大鼠血浆及肾AngⅡ、肾时钟基因mRNA及时钟基因蛋白24h表达节律的余弦分析
各组肾AngⅡ呈现近日节律,BM 组肾AngⅡ峰值位相较假手术和模型组后移约6h;假手术和模型组时钟基因per2、bmal1mRNA 表达呈近日节律,BM 组per2 mRNA 近日节律消失,bmal1峰值位相后移4h;3组dbp mRNA 节律不符合余弦规律;3组时钟蛋白PER2、DBP、BMAL1均表现出近日节律,其中模型组DBP、BMAL1 振幅增强,峰值位相各组也有区别,见表3。
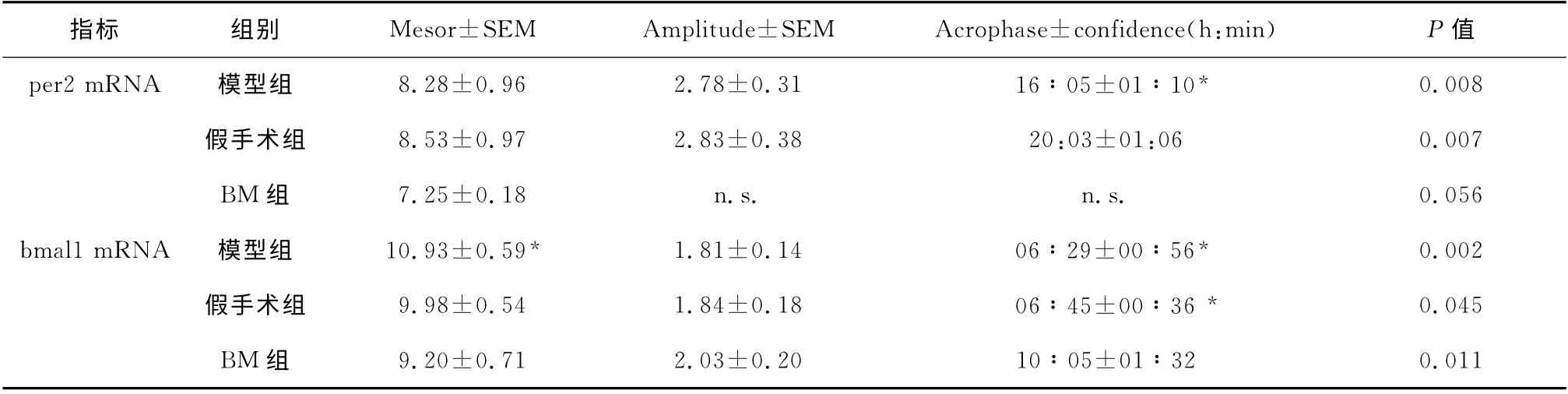
表3 各组大鼠肾时钟基因mRNA 24h表达节律的余弦分析Table 3 Cosinor analysis of 24-h pattern of clock gene mRNA and protein expression in each group
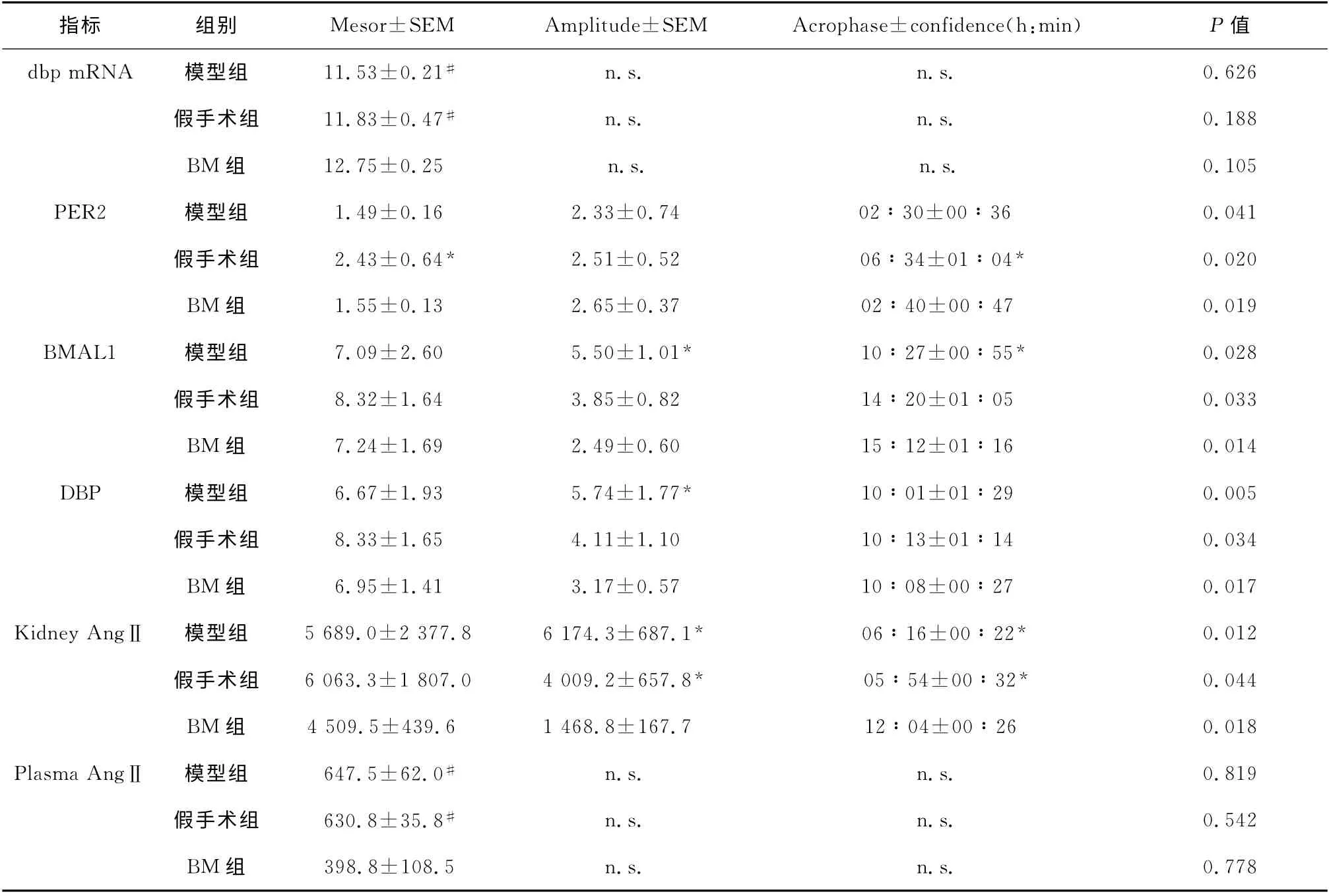
续表
2.6 相关分析
将血浆及肾组织中AngⅡ与组织中per2、bmal1及时钟基因蛋白PER2、BMAL1、DBP 行Spearman相关性检验,结果发现假手术组和模型组肾组织AngⅡ与肾时钟基因bmal1呈正相关,rs=0.532,P=0.015,其余指标无相关性。
3 讨论
肾组织中时钟基因的表达呈近日节律,蛋白质表达的峰值时间比mRNA 滞后4~8h。肾组织中时钟基因蛋白的近日节律与肾脏生理功能的近日节律性比较吻合:如肾小球滤过率(GFR)及肾血流量的峰值在17∶00,谷值时间在5∶00[8-9],与BMAL1及DBP的谷峰值时间较为吻合;肾脏电解质排泄(如尿钾、尿钠排泄)白天(8∶00~16∶00)明显高于夜晚[10],这与PER2 及DBP 的表达水平及时间也比较吻合。我们的结果说明肾脏生理功能的近日节律性是受肾内在的时钟基因控制的。
5/6肾切除大鼠时钟基因及其蛋白质表达节律及水平发生改变。在蛋白质水平,5/6 肾切除大鼠PER2 的谷、峰值时间均提前4h,而BMAL1 及DBP的振幅明显增加。慢性肾衰时肾脏功能表现出的异常节律与时钟基因及其蛋白质的近日节律及表达水平发生变化有关。国外学者证实clock基因敲除小鼠或dbp/hlf/tef缺乏小鼠在涉及水、钠平衡的关键性调节因子如血管加压素V2受体、水通道-2、水通道-4等的表达发生改变,相应地表现出糖尿病性尿崩症、钠排泄失调及低血压等[11]。而涉及电解质及酸碱平衡的关键NHE3 是直接受肾内clock:bmal1 异质二聚体调节的时钟控制基因,在CRY1/2(-/-)小鼠NHE3 近日节律表达被阻断[12]。
以往的研究证实,循环RAAS 存在近日节律[13-14]。本研究证实,肾组织AngⅡ存在近日节律,而且肾AngⅡ节律与循环节律不相同,假手术及模型组血浆及肾局部AngⅡ的谷峰趋势相反。苯那普利治疗后血浆及肾组织中AngⅡ水平明显下降,说明ACEI药物对循环及组织中AngⅡ水平均有明显抑制作用,并改变了其表达节律性。
肾局部AngⅡ与肾脏近日节律系统之间有相关性。中枢性时钟基因与外周组织时钟基因的分子学机制相同,但是授时因子不同。中枢节律系统(SCN)的授时因子是光线,而外周器官节律器的授时因子是神经内分泌因子[15-16]。用原代细胞培养体系,Nonaka等[5]已证实AngⅡ是血管平滑肌细胞内近日节律器的授时因子,另有一些研究提示AngⅡ是通过血管紧张素1型或2型受体(AT1/2-R)影响中枢或外周组织近日节律系统[3-4]。本文用在体动物研究循环及肾组织局部AngⅡ与肾脏时钟基因表达的关系。结果发现,循环AngⅡ水平及节律与肾组织时钟基因bmal1、per2 及dbp 及其蛋白BMAL1、PER2、DBP之间无关;而肾局部AngⅡ水平及节律与bmal1 mRNA 表达水平及节律呈正相关:肾组织AngⅡ及bmal1 mRNA 表达趋势及其谷、峰值时间均一致。用苯那普利抑制肾组织AngⅡ水平后,bmal1 的峰值后移。肾组织AngⅡ与per2 mRNA 的表达趋势相反,但是其峰值时间与per2mRNA 谷值时间相差4h,提示两者之间有一定关联。我们的结果提示肾局部AngⅡ与肾脏近日节律系统间的相关性,而循环AngⅡ对肾时基因影响不大,但肾AngⅡ与近日节律系统之间的因果关系还不清楚。我们猜测5/6肾切除大鼠肾组织中异常的AngⅡ节律及水平作为内部授时因子通过AT1/2型受体影响肾组织近日节律系统,而肾近日节律系统发生改变后通过时钟控制基因等途径改变其下游靶基因的近日节律性,并最终导致肾脏的各项功能发生变化。
本研究中dbp mRNA 不符合余弦曲线表达形式。dbp表达最丰富的组织不是肾脏而是肝脏,而不同组织中时钟基因的表达节律及水平会有差别,以后的研究需进一步深入。
值得注意的是,我们用苯那普利抑制肾脏AngⅡ水平后发现肾脏时钟基因及时钟基因蛋白的表达节律及时相发生变化,但是mRNA 与蛋白的变化不同:per2及dbp的mRNA 表达节律性消失,bmal1的峰值后移4h,近日节律性仍保持;但是,PER2及DBP蛋白表达仍维持近日节律性。我们推测原因可能有以下几点:bmal1、per2及dbp的转录后调节还有除AngⅡ外的其他因素参与;肾时钟基因系统的调节还受中枢神经系统[17]及其他内分泌因子如糖皮质激素[18]以及RAAS 系统其他组分的影响;AngⅡ除是肾时钟基因的授时因子外,其本身表现出的近日节律性很可能也是时钟基因控制基因的产物,从而与时钟基因形成反馈环。对此我们将进一步深入研究。
致谢:感谢武汉大学生命科学院郑凌教授对本研究的大力帮助;感谢EYE 统计工作室段凌对本研究提供的统计帮助。
[1] Balsalobre A.Clock genes in mammalian peripheral tissues[J].Cell Tissue Res,2002,309(1):193-199.
[2] Liu S,Cai Y,Sothern R B,et al.Chronobiological analysis of circadian patterns in transcription of seven key clock genes in six peripheral tissues in mice[J].Chronobiol Int,2007,24(5):793-820.
[3] HerichováI,Mravec B,Stebelová K,et al.Rhythmic clock gene expression in heart,kidney and some brain nuclei involved in blood pressure control in hypertensive TGR(mREN-2)27rats[J].Mol Cell Biochem,2007,296(1/2):25-34.
[4] Naito Y,Tsujino T,Kawasaki D,et al.Circadian gene expression of clock genes and plasminogen activator inhibitor-1in heart and aorta of spontaneously hypertensive and Wistar-Kyoto rats[J].J Hypertens,2003,21(6):1107-1115.
[5] Nonaka H,Emoto N,Ikeda K,et al.Angiotensin Ⅱinduces circadian gene expression of clock genes in cultured vascular smooth muscle cells[J].Circulation,2001,104(15):1746-1748.
[6] 黄小妹,陈文莉.5/6肾切除大鼠肾组织时钟基因的表达[J].华中科技大学学报:医学版,2012,41(1):80-83.
[7] 黄小妹,陈文莉,丁国华,等.苯那普利对5/6肾切除大鼠肾组织时钟基因表达的影响[J].中华肾脏病杂志,2012,28(4):327-328.
[8] Wesson L G.Diurnal circadian rhythms of renal function and electrolyte excretion in heart failure[J].Int J Chronobiol,1979,6(2):109-117.
[9] Wesson L G.Diurnal circadian rhythms of electrolyte excretion and filtration rate in end-stage renal disease[J].Nephron,1980,26(5):211-214.
[10] Cohn C,Webb L,Joseph D.Diurnal rhythms in urinary electrolyte excretions by the rat:Influence of feeding habits[J].Life Sci I,1970,9(14):803-809.
[11] Zuber A M,Centeno G,Pradervand S,et al.Molecular clock is involved in predictive circadian adjustment of renal function[J].Proc Natl Acad Sci U S A,2009,106(38):16523-16528.
[12] Saifur Rohman M,Emoto N,Nonaka H,et al.Circadian clock genes directly regulate expression of the Na(+)/H(+)exchanger NHE3in the kidney[J].Kidney Int,2005,67(4):1410-1419.
[13] Portaluppi F,Bagni B,degli Uberti E,et al.Circadian rhythms of atrial natriuretic peptide,renin,aldosterone,cortisol,blood pressure and heart rate in normal and hypertensive subjects[J].J Hypertens,1990,8(1):85-95.
[14] Brandenberger G,Follenius M,Goichot B,et al.Twenty-fourhour profis of plasma renin activity in relation to the sleepwake cycle[J].J Hypertens,1994,12(3):277-283.
[15] Mahoney C E,Brewer D,Costello M K,et al.Lateralization of the central circadian pacemaker output:a test of neural control of peripheral oscillator phase[J].Am J Physiol,2010,299(3):R751-R761.
[16] Durgan D J,Hotze M A,Tomlin T M,et al.The intrinsic circadian clock within the cardiomyocyte[J].Am J Physiol,2005,289(4):H1530-H1541.
[17] Eleswarapu S,Jiang H.Growth hormone regulates the expression of hepatocyte nuclear factor-3gamma and other liver-enriched transcription factors in the bovine liver[J].J Endocrinol,2005,184(1):95-105.
[18] Balsalobre A,Brown S A,Marcacci L,et al.Resetting of circadian time in peripheral tissues by glucocorticoid signaling[J].Science,2000,29;289(5488):2344-2347.

