糖蛋白非转移性黑色素瘤蛋白B 对人肝癌细胞增殖、凋亡和侵袭能力的影响及其分子机制
张承彦, 谢 鑫, 张春喜, 高登升
(1陕西能源职业技术学院,陕西 西安710613;2西北大学,陕西 西安710069;3西安航天总医院麻醉科,陕西 西安710100;4西安市第四医院新生儿科,陕西 西安710014)
肝癌是我国最为常见的恶性肿瘤之一,尤其在40 ~50 岁的壮年男性发病较多,在各种肿瘤中恶性程度较高,严重影响人类的健康[1-2]。近年来尽管肝癌的诊治取得了较大进展,但关于肝癌细胞的增殖、侵袭机制至今尚未完全阐明,肝癌手术切除后的复发转移是影响疗效的主要原因之一。因此,肝癌细胞增殖、侵袭转移这一领域的实验研究不仅有重要的理论意义,而且有重要的应用价值。
糖蛋白非转移性黑色素瘤蛋白B(glycoprotein nonmetastatic melanoma protein B,GPNMB)是一种Ⅰ型跨膜糖蛋白,在结构上分为胞外区、跨膜区和胞浆区,其胞内段具有整合素识别位点——精氨酸-甘氨酸- 天冬氨酸(arginine-glycine-asparagine,RGD)序列,具有细胞黏附功能。gpnmb 广泛表达于多种组织,如皮肤基底层、毛囊生发细胞、乳腺癌细胞、肝癌细胞、黑素瘤细胞、破骨细胞等[3]。近年来的研究表明,它参与了多种细胞的生长、增殖、分化和凋亡等生理过程,而异常表达的GPNMB 还与多种疾病的病理、生理过程相关[4]。但GPNMB 在肝细胞癌中的作用及其机制如何,目前国内外研究报道还较少。因此,本研究通过GPNMB 基因转染和小干扰RNA(small interfering RNA,siRNA)技术刺激体外培养的肝癌细胞,观察GPNMB 过表达和GPNMB-siRNA 对肝癌细胞增殖、凋亡、侵袭转移能力的变化,进一步明确GPNMB 在肝癌细胞侵袭转移过程中的作用。
材 料 和 方 法
1 材料
1.1 细胞 人肝癌细胞株HepG2 购于中科院上海细胞所,由本实验室保存。
1.2 主要仪器及试剂 CO2细胞培养箱(Binder),酶联免疫检测仪(Sheldon),流式细胞仪(Olympus),iQ5 实时定量PCR 仪和激光共聚焦显微镜(Bio-Rad),ECL 化学发光试剂盒(Boehringer Mannheim),BCA 蛋白浓度测定试剂盒、RNAiso Plus、PrimeScript®RT reagent Kit、SYBR® Premix Ex TaqTMI、EcoR I、Xho I 和T4 DNA 连接酶(TaKaRa),抗β-肌动蛋白抗体、抗整合素β1抗体、辣根过氧化物酶标记羊抗兔IgG、LipofectamineTMRNAiMAX、载体pMD19-T、pcDNA3.1(+)和抗GPNMB 抗体(Abcam),M254 培养基、MTT、二甲基亚砜(demethylsulfoxide,DMSO)、TBST 缓冲液、胎牛血清(fetal bovine serum,FBS)和碘化丙啶(propidium iodide,PI;Gibco-BRL)。
1.3 引物 所有引物均由上海生工合成,其序列见表1。
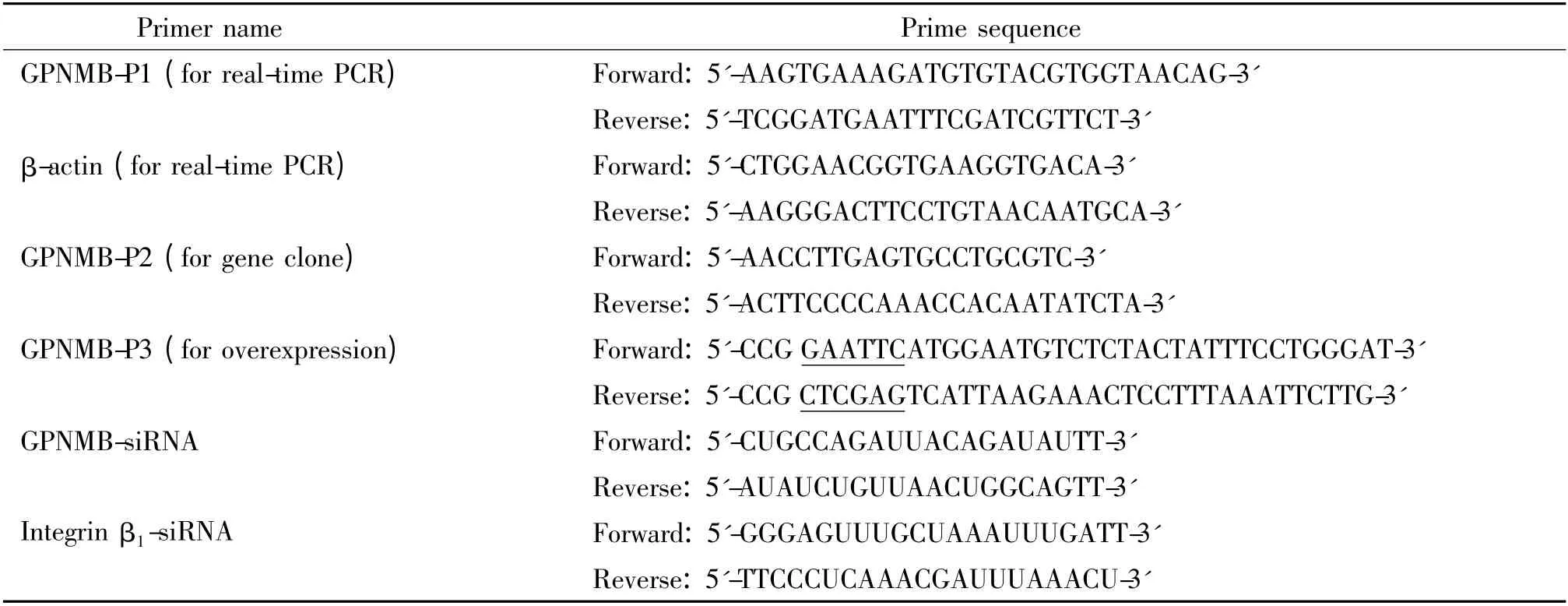
表1 引物序列Table 1. Primer sequences
2 方法
2.1 表达载体的构建 将以GPNMB-P2 为引物扩增的GPNMB 目的片段,与pMD19-T 载体在16 ℃条件下进行连接反应,并将连接产物转化于感受态大肠杆菌DH5α,培养后进行筛选,挑选阳性菌落摇菌并提取质粒,电泳鉴定后获得重组质粒pMD19TGPNMB。以重组质粒为模板,以GPNMB-P3 为引物,扩增GPNMB 编码区序列,扩增产物以EcoRI 和Xho I 双酶切,并用T4 DNA 连接酶将其与真核表达载体pcDNA3.1(+)连接,获得重组表达载体pcDNA3.1(+)-GPNMB。
2.2 转染 按5 ×104cells/well 接种HepG2 细胞至24 孔培养板中,待其长至60% 融合时,采用LipofectamineTM2000 将siRNA 或重组表达载体pcDNA 3.1(+)-GPNMB 转染细胞,混匀后于5% CO2、37℃恒温培养箱中孵育。24 h 后采用Western blotting法检测各组的转染效率。
2.3 RNA 的提取与real-time PCR 检测 采用RNAiso Plus 试剂盒提取HepG2 细胞中的总RNA,按照试剂盒要求操作。按实验室常规方法进行逆转录和PCR 扩增。Real-time PCR 采用的体系为:dNTPs 2 μL,10 ×buffer 5 μL,上、下游引物各10 pmol/L,Pfu酶0.5 μL,模板2 μL,加三蒸水至总体积50 μL;扩增条件为:预变性94 ℃5 min,进入循环,94 ℃1 min,60 ℃1 min,延伸72 ℃3 min,30 个循环后,72℃5 min。以β-actin 为内参照,依据2-ΔΔCt法计算各组细胞mRNA 的相对表达量。
2.4 Western blotting 检测样品的蛋白水平 每个样品取40 μg 蛋白进行常规SDS-PAGE 电泳,蛋白浓度采用BCA 试剂盒测定。经电泳后转移至PVDF 膜,10%脱脂奶粉4 ℃封闭PVDF 膜过夜,加10%脱脂奶粉稀释好的Ⅰ抗加于膜上,室温反应60 min;用TBST 缓冲液(0.05 mol/L Tris,0. 15 mol/L NaCl,0.05% Tween 200)洗膜10 min ×3 次;加Ⅱ抗37 ℃孵育45 min,TBST 缓冲液洗膜10 min ×3 次,滴加ECL 试剂,将PVDF 膜放入X 光片暗盒,在暗室中压片,显影。以β-actin 作为内参照。
2.5 细胞增殖实验 分别取对数生长期HepG2 细胞接种于96 孔培养板,每孔1 ×104,共100 μL,每组3 孔,置于37 ℃、5% CO2培养箱中培养48 h。将实验分为正常对照组、GPNMB 过表达组、GPNMB-siRNA 组及scrambled 组(即空质粒转染细胞组,主要是为了说明干扰试验的特异性),0.25%胰酶消化各组细胞,吸去胰酶,加入正常培养液继续培养60 min。每孔加入MTT 溶液(5 g/L)20 μL,继续孵育4 h,弃上清,每孔加入150 μL DMSO,振荡10 min 后进行比色测定,酶联免疫检测仪在490 nm 波长下读取吸光度(absorbance,A)。
2.6 细胞凋亡测定 用PBS 洗涤HepG2 细胞1 次,加入Annexin V-FITC,室温避光放置20 min,用PBS洗涤2 次,加500 μL 甲醛,冰浴25 min,用磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤2 次,加入含有10 mg/L PI 和1 mg/L RNA 酶的PBS 缓冲液,室温避光孵育20 min,进行流式细胞仪检测。
2.7 细胞侵袭能力测定 实验分为正常对照组、GPNMB 过表达组、GPNMB-siRNA 组以及scrambled组,将培养的人肝癌细胞HepG2 细胞消化成单细胞悬液,无血清培养基洗3 次,将细胞悬液密度调整成2 ×108cells/L 备用。预先将Matrigel(提前12 h)用无血清培养基DMEM 稀释成1∶3 浓度,均匀地铺满Transwell 小室上室的聚碳酸酯膜,室温放置1 h,使Matrigel 凝固形成基质膜。Transwell 下室加入700 μL 含10%胎牛血清的培养基,小室内接种200 μL无血清细胞悬液,培养18 h 后取出Transwell膜,预冷的PBS 洗涤2 次,4%多聚甲醛固定15 min,0.1%结晶紫染色5 ~10 min,显微镜下拍照,统计穿过Transwell 膜的细胞数[5]。实验重复3 次。
3 统计学处理
采用SPSS 11.0 统计软件分析。数据以均数±标准差(mean ±SD)表示,组间比较采用方差分析,以P <0.05 为差异有统计学意义。
结 果
1 转染效率的测定
取转染后各组细胞总RNA 和蛋白,采用realtime PCR 和Western blotting 检测GPNMB 的mRNA和蛋白水平的表达。Scrambled 组HepG2 细胞中GPNMB 的mRNA 表达水平较对照组无明显变化,而GPNMB 过表达组和GPNMB-siRNA 组HepG2 细胞中GPNMB 的mRNA 表达水平分别为1.28 ±0.09 和0.62 ±0.03,与对照组相比差异显著(P <0.05),见图1。与对照组相比,scrambled 组HepG2 细胞中GPNMB 蛋白表达水平几乎无变化,而GPNMB 过表达组蛋白表达水平显著升高,GPNMB-siRNA 组蛋白表达水平明显降低,见图2。
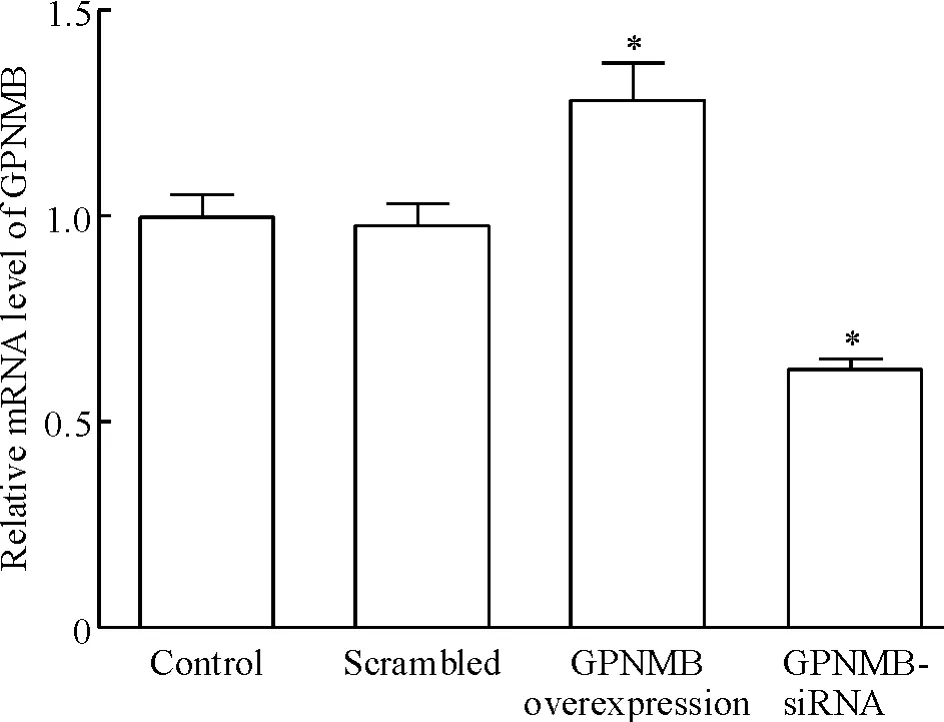
Figure 1. The mRMA expression of GPNMB detected by realtime PCR.Mean±SD.n=3. * P <0.05 vs control.图1 Real-time PCR 检测GPNMB mRNA 表达
2 GPNMB 对HepG2 细胞增殖的影响
MTT 法测定各组细胞的A 值,结果见图3。与对照组相比,scrambled 组基本无变化,GPNMB 过表达可以显著促进HepG2 细胞的增殖,其A 值是对照组的1.4 倍,差异显著(P <0.05);而GPNMB-siRNA则可以显著抑制HepG2 细胞的增殖,其A 值仅为对照组的0.4 倍,差异显著(P <0.05)。

Figure 2. The protein expression of GPNMB detected by Western blotting.Mean±SD.n=3. * P <0.05 vs control.图2 Western blotting 检测GPNMB 蛋白表达

Figure 3. The effect of GPNMB on HepG2 cell proliferation.Mean±SD.n=3. * P <0.05 vs control.图3 GPNMB 对HepG2 细胞增殖的影响
3 GPNMB 对HepG2 细胞凋亡的影响
流式细胞术检测Annexin V/PI 荧光强度的结果见图4。与对照组相比,scrambled 组、GPNMB 过表达及GPNMB-siRNA 组的总细胞凋亡率均无明显差异(P >0.05)。
4 GPNMB 对HepG2 细胞侵袭的影响
与对照组相比,scrambled 组基本无变化,GPNMB 过表达组细胞发生侵袭的个数为124 ±9,显著增多(P <0.05),GPNMB-siRNA 组细胞发生侵袭的个数为36 ±3,显著减少(P <0.05),见图5。
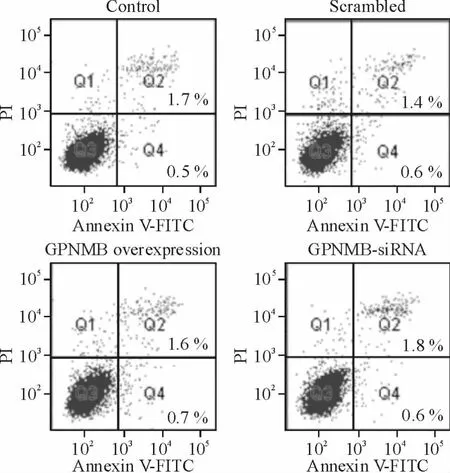
Figure 4. Effect of GPNMB on HepG2 cell apoptosis.图4 GPNMB 对HepG2 细胞凋亡的影响

Figure 5. Effect of GPNMB on HepG2 cell invasion.Mean±SD.n=3. * P <0.05 vs control.图5 GPNMB 对HepG2 细胞侵袭的影响
5 GPNMB 通过整合素β1 调控HepG2 细胞增殖与侵袭
仅用整合素β1-siRNA 处理时,HepG2 细胞的GPNMB 蛋白表达水平较对照组和scrambled 组下调;而同时用整合素β1-siRNA 和GPNMB 过表达处理时,HepG2 细胞的GPNMB 蛋白表达水平较整合素β1-siRNA 组上调,见图6。仅用整合素β1-siRNA 处理时,细胞增殖与侵袭能力均显著下降(P <0.05);而同时用整合素β1-siRNA 和GPNMB 过表达处理细胞,则可促进细胞增殖与侵袭(P <0.05)。
讨 论
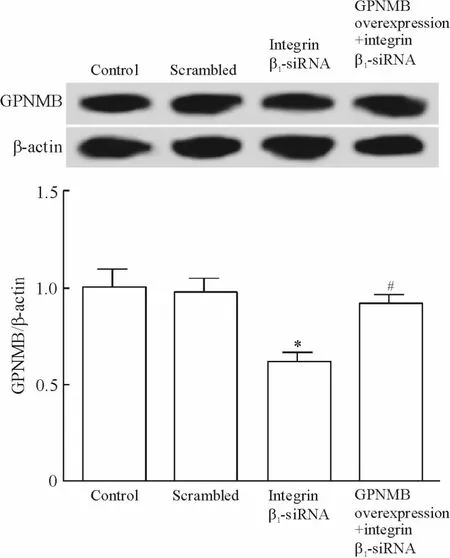
Figure 6. The GPNMB protein levels in HepG2 cells with different treatments.Mean±SD. n =3. * P <0.05 vs control;#P <0.05 vs integrin β1-siRNA.图6 不同处理因素作用下HepG2 细胞GPNMB 蛋白表达水平的变化
癌症患者死亡的主要原因是肿瘤细胞的增殖和侵袭,增殖和侵袭是所有恶性肿瘤的共同特征,也是导致恶性肿瘤患者临床治疗预后差,易复发的主要原因[6]。肿瘤细胞的增殖和侵袭是癌基因与抑癌基因共同参与调节的复杂过程,可以通过肿瘤增殖、侵袭相关基因的过度表达或下调,以及一系列基因产物的参与,对肿瘤增殖、侵袭转移整个过程进行调控[7]。在MTT 实验中,HepG2 细胞在GPNMB 表达被特异性沉默后增殖速率明显下降,这表明GPNMB直接影响肝癌细胞的生长活力,对肝癌细胞的增殖起着重要作用。Annexin V/PI 双染色法流式细胞术检测显示,GPNMB 对HepG2 细胞凋亡基本无影响,这说明GPNMB 在肝癌细胞增殖过程中的影响不是决定性的。文献也表明,正常肝脏组织的肝细胞GPNMB 蛋白低表达,但在肝癌细胞中高度表达[8],即正常肝细胞在GPNMB 蛋白表达水平很低的情况下能正常增殖,而在增殖速率较快的肝癌细胞中降低GPNMB 蛋白表达水平只会减慢细胞的增殖,但不会引起致死性的变化。

Figure 7. GPNMB regulated the proliferation and invasion of HepG2 cells through interaction with integrin β1.Mean±SD.n=3. * P <0.05 vs control;#P <0.05 vs integrin β1-siRNA.图7 GPNMB 通过整合素β1 调控HepG2 细胞的增殖与侵袭
整合素为α 和β 亚基非共价键连接而形成的异二聚体的跨膜糖蛋白,是一类重要的细胞表面受体,其配体主要为细胞外基质蛋白,整合素通过识别胞外基质蛋白,介导细胞与细胞外基质、细胞与细胞间的黏附反应,并接受、转导级联信号以及调节细胞的存活、运动、增殖等生物学过程,在肿瘤发生、侵袭和转移等过程中起重要的作用[9-10]。正常成人肝细胞没有基膜,仅低水平表达3 种整合素:α1β1、α5β1和α9β1,但当肝细胞癌变时,上述几种整合素受体有较大改变。肝癌细胞整合素β1亚基在肝癌细胞株的细胞膜表面具有较强的表达,其表达明显高于正常肝细胞[11]。本研究采用RNA 干扰技术沉默整合素β1亚基,研究GPNMB 对HepG2 细胞增殖和侵袭的分子机制。结果发现,仅用整合素β1-siRNA 处理时,细胞增殖和侵袭能力均显著下降;而同时用整合素β1-siRNA 和GPNMB 过表达处理细胞,则可促进其增殖和侵袭。有文献报道,CD151(四跨膜蛋白超家族中的一重要分子)在体外可通过整合素通路促进HepG2 细胞的增殖、迁移和侵袭[12],由此我们推测,GPNMB 对肝癌细胞增殖和侵袭能力的影响可能也是通过整合素β1起作用。由于肿瘤细胞的增殖和侵袭机制是一个复杂的、多步骤的过程,其幕后的细胞信号转导机制起着决定性作用,而本研究仅考察了整合素β1在肝癌细胞上的表达及影响,其它整合素亚型的表达及贡献大小、多种胞外配体分子协同作用机制还需要进一步研究。
[1] 华赟鹏,李宝金,汪 勇,等. ATP 启动子驱动的yCD/TK 双自杀基因靶向杀伤肝癌细胞的体内外研究[J]. 中国病理生理杂志,2009,25(6):1111-1116.
[2] Lyra-González I,Flores-Fong LE,González-García I,et al. Adenoviral gene therapy in hepatocellular carcinoma:a review[J]. Hepatol Int,2013,7(1):48-58.
[3] Hoashi T,Sato S,Yamaguchi Y,et al. Glycoprotein nonmetastatic melanoma protein b,a melanocytic cell marker,is a melanosome-specific and proteolytically released protein[J]. FASEB J,2010,24(5):1616-1629.
[4] Tomihari M,Hwang SH,Chung JS,et al. Gpnmb is a melanosome-associated glycoprotein that contributes to melanocyte/keratinocyte adhesion in a RGD-dependent fashion[J]. Exp Dermatol,2009,18(7):586-595.
[5] Choi ET,Engel L,Callow AD,et al. Inhibition of neointimal hyperplasia by blocking αVβ3integrin with a small peptide antagonist GpenGRGDSPCA[J]. J Vasc Surg,1994,19(1):125-134.
[6] Tsujimoto M,Aozasa K,Nakajima Y,et al. Hepatocellular carcinoma with sarcomatous proliferation showing an unusual and wide-spread metastasis[J]. Acta Pathol Jpn,1984,34(4):839-845.
[7] 郭晓鹤,张彩凤,夏永华,等. CADM 过表达对人胃癌MKN-45 细胞增殖和侵袭的影响及其分子机制[J]. 中国病理生理杂志,2012,28(12):2283-2287.
[8] Zhou L,Liu F,Li Y,et al. Gpnmb/osteoactivin,an attractive target in cancer immunotherapy[J]. Neoplasma,2012,59(1):1-5.
[9] Desgrosellier JS,Cheresh DA. Integrins in cancer:biological implications and therapeutic opportunities[J]. Nat Rev Cancer,2010,10(1):9-22.
[10]Raymond K,Faraldo MM,Deugnier MA,et al. Integrins in mammary development[J]. Semin Cell Dev Biol,2012,23(5):599-605.
[11]Sahin AO,Buitenhuis M. Molecular mechanisms underlying adhesion and migration of hematopoietic stem cells[J]. Cell Adh Migr,2012,6(1):39-48.
[12]Sadej R,Romanska H,Kavanagh D,et al. Tetraspanin CD151 regulates transforming growth factor β signaling:implication in tumor metastasis[J]. Cancer Res,2010,70(14):6059-6070.

