不同采收期木芙蓉叶总黄酮的含量测定
万定荣,梅 青,盘 珊
(1 中南民族大学 药学院,武汉 430074;2武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉 430074)
木芙蓉叶系锦葵科植物木芙蓉HibiscusmutabilisL.的干燥叶,其性平味辛,具有凉血、解毒、消肿、止痛的功效,用于治疗痈疽焮肿、缠身蛇丹、烫伤、目赤肿痛、跌打损伤[1].不同民族地区还将其分别用于治疗偏头痛、中耳炎(侗族),肺痈咯血(畲族),月经过多、白带(畲族、景颇族、傈僳族),以及颈淋巴结核、阑尾炎(瑶族);外用治腮腺炎(傈僳族、瑶族)[2].木芙蓉叶含黄酮苷、酚类、鞣质、苯丙酸类及甾醇类化合物、挥发油类[3]等.其中,苯丙酸类化合物中的阿魏酸具有抗淋巴丝虫的作用[4].木芙蓉叶醇提物具有良好的抑菌作用[5],黄酮苷类化合物包括芦丁(芸香苷)、山柰酚-3-O-β-芸香糖苷、山柰酚-3-O-β-刺槐双糖苷等是木芙蓉叶的主要活性成分,具有显著的抗炎[6]、保肝[7]、抗肾缺血再灌注损伤[8,9]、抗糖尿病[10]等作用.文献报道,新鲜木芙蓉叶经低温烘干处理后总黄酮含量最高[11],但关于不同采收期样品总黄酮的含量测定未见报道.笔者采用分光光度法对木芙蓉叶进行了总黄酮含量测定的研究,比较分析了经阴干处理的不同采收期的木芙蓉叶样品总黄酮的含量,为木芙蓉叶的质量控制及最佳采收期的确定提供了可靠依据.
1 材料与仪器
1.1 材料
木芙蓉叶样品共8批,其中7批采于中南民族大学校园内,另1批购于安徽亳州,均经笔者鉴定为锦葵科植物木芙蓉HibiscusmutabilisL.的新鲜叶.采集后,阴干,备用.
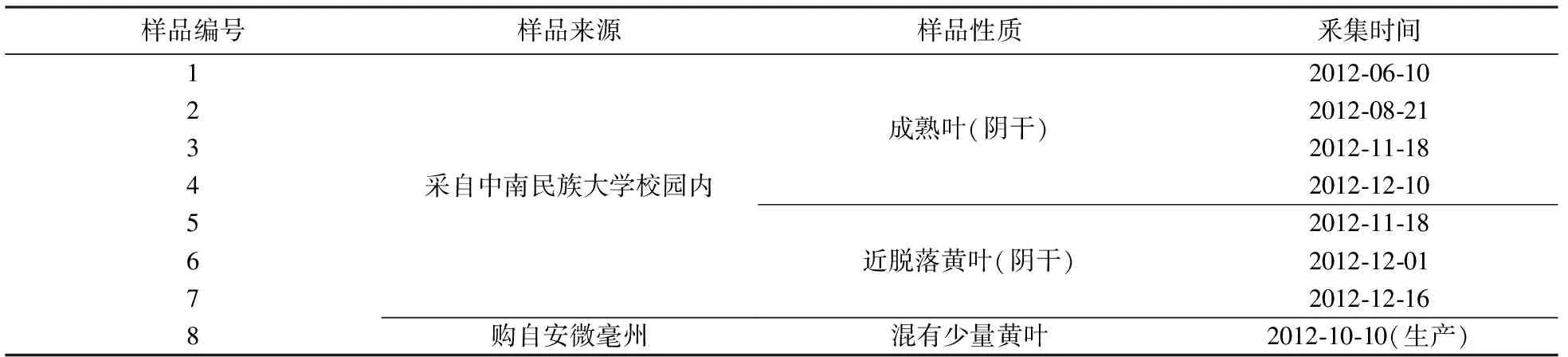
表1 药材样品及其来源
1.2 仪器与试药
UV-1800CP型紫外-可见分光光度计(上海美谱达仪器有限公司),芦丁对照品(中国食品药品检定研究院,10080-200707),无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠均为国产分析纯.
2 方法与结果
2.1 对照品溶液的制备
取芦丁对照品适量,精密称定,加30%乙醇制成0.971mg/mL的对照品溶液.
2.2 供试品溶液的制备
经过样品提取条件的考察与选择,确定供试品溶液的制备方法如下:将阴干的药材样品粉碎,过60目筛,取样品粉末1.0 g,精密称定,置于圆底烧瓶中,精密加入30%的乙醇30 mL,称定重量,加热回流提取80 min,放冷,再次称定重量,用30%乙醇补足减失重量,摇匀、静置、滤过.精密量取续滤液5.0 mL,置10mL量瓶中,再用30%乙醇定容至刻度,摇匀即得.
2.3 显色与测定方法
精密量取供试品溶液3.0 mL、对照品溶液适量,分别置25 mL容量瓶中,加5% NaNO2溶液1.0 mL,混匀,放置6 min,加10% A1(NO3)31.0mL,混匀,放置6 min,加4% NaOH 溶液10 mL,再用30%乙醇定容至刻度,摇匀,静置15min,并以相应溶剂加入显色剂的溶液作空白,在一定的波长处测定吸光度.
2.4 测定波长的选择
精密量取对照品及供试品溶液各1.0mL,按“2.3”项下的操作方法,于400~700nm波长范围内分别扫描(扫描间隔为1 nm)测定吸收光谱.结果对照品溶液和供试品溶液均在500 nm波长附近有最大吸收,故以500 nm为测定波长.
2.5 标准曲线的绘制
精密量取对照品溶液0.2,0.5,1.0,2.0,3.0,4.0 mL,分别置入25mL容量瓶中,按“2.3”项下的显色及测定方法,于500nm波长处分别测定吸光度.以吸光度值A为纵坐标,浓度ρ(mg/mL)为横坐标,绘制标准曲线,得到线性回归方程为:A=10.566ρ+0.0056 (r= 0.9999).结果表明,芦丁对照品溶液在7.8~155.4 μg/mL的浓度范围内与其吸光度值呈良好的线性关系.
2.6 供试品溶液的制备方法
2.6.1 提取方法
取4号样品粉末(过60目筛)1.0 g,共2份,分别精密称定,各加50%乙醇30 mL,分别以回流、超声处理2种方法提取40min,滤过,取续滤液制得供试液,按“2.3”项下的方法操作,于500 nm波长处测定吸光度值,计算测得的样品中的总黄酮的量.结果测得前者总黄酮的提取量是后者的1.73倍,说明相同条件下,回流提取法的提取效果远优于超声提取法.
2.6.2 提取溶剂
取4号样品粉末(过60目筛)1.0 g,共7份,分别精密称定,各加入20%,30%,40%,50%,60%,70%,95% 的乙醇溶液30 mL,回流提取40 min,依“2.2”项下的方法制备供试液,按“2.3”项下的方法进行显色,定容溶剂为各浓度的乙醇溶液.并以各浓度的乙醇溶液加入显色剂作空白,于500 nm波长处测定吸光度,计算样品的总黄酮的量.结果表明:不同浓度的乙醇溶液所提取制备的供试液对吸光度值影响较大,用30%乙醇作提取溶剂提取的总黄酮的量最高.随着乙醇体积分数的增加,黄酮苷的溶出量逐渐减少,而某些脂溶性杂质溶出量随之增加,从而干扰总黄酮的提取.
2.6.3 提取时间
取4号样品粉末(过60目筛)1.0 g,共5份,精密称定,分别加入30%乙醇溶液30 mL,各回流提取40,60,80,100,120 min,滤过,精密量取续滤液5.0 mL稀释至10 mL,按“2.3”项下的显色和测定方法,于500 nm波长处测定吸光度,计算提得样品的总黄酮的量.结果表明:木芙蓉叶样品的最佳提取时间为80 min,之后随着时间的延长其总黄酮的量逐渐降低.可见提取时间长短影响总黄酮量,时间过短黄酮类成分不能充分溶出,时间太长部分对热不稳定的黄酮类成分分解损失,使总黄酮含量下降.
2.6.4 溶剂用量考察
取4号样品粉末(过60目筛)1.0 g,共3份,分别精密称定,固定乙醇浓度为30%,料液比(g/mL)分别为1︰10、1︰20、1︰30,回流提取80 min,滤过.分别精密量取续滤液5.0 mL稀释至10 mL,按“2.3”项下的方法显色,在500 nm波长处测定吸光度,计算出总黄酮的量.结果显示,料液比从1︰20至1︰30过渡时,提取量仅略有增加,考虑到实验成本,故料液比以1︰30为宜.
2.7 方法学考察
2.7.1 精密度实验
取4号样品粉末(过60目筛)1.0 g,精密称定,按“2.2”项下方法制备供试品溶液.精密量取供试品溶液3.0 mL,置于25 mL容量瓶中,按“2.3”项下的方法显色,于500 nm波长处依法测定吸光度,计算总黄酮含量,RSD为0.51%,表明本实验仪器精密度良好.
2.7.2 重现性实验
取4号样品粉末(过60目筛)1.0g ,共6份,精密称定,按“2.2”项下方法制备供试品溶液.精密量取供试品溶液3.0mL,置于25mL容量瓶中,按“2.3”项下的方法显色,于500 nm波长处测定吸光度,分别计算6份样品的总黄酮含量,并计算得RSD为2.03%,表明本方法重现性好.
2.7.3 稳定性实验
取4号样品粉末(过60目筛)1.0g ,精密称定,按“2.2”项下方法制备供试品溶液.精密量取供试品溶液3.0mL,置于25 mL容量瓶中,按“2.3”项下的方法显色.室温放置0,1,2,4,8,12,24 h,均于500 nm波长处测定吸光度,计算出总黄酮含量,结果12 h内的总黄酮含量的RSD为2.68%,表明供试品溶液显色后在12 h内稳定.
2.7.4 加样回收率实验
精密量取适量已知含量的4号样品溶液,共6份,分别加入相应量的芦丁对照品,依“2.3”项下的显色及测定方法,于500 nm波长处测定吸光度,计算得平均回收率为100.91%,RSD值为1.11%.结果见表2.
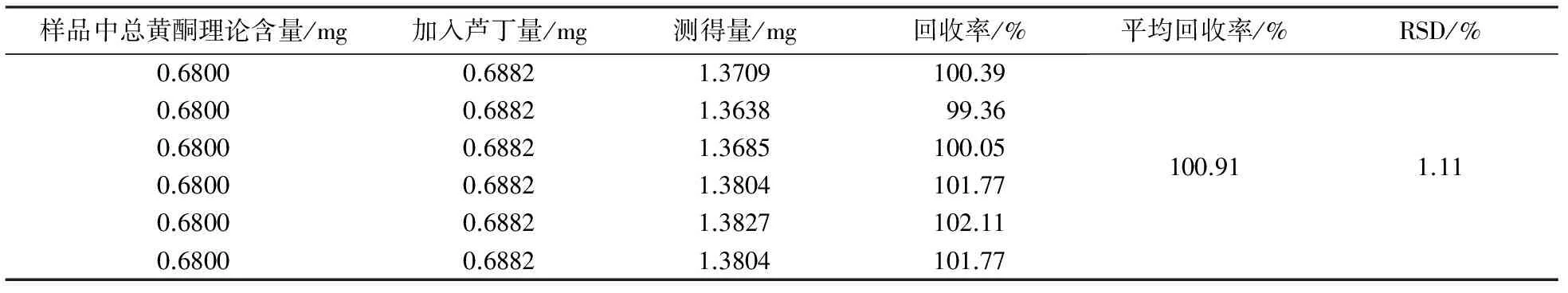
表2 加样回收率结果
2.8 不同采收期样品总黄酮含量测定
分别取8批木芙蓉叶样品粉末(过60目筛)1.0 g,精密称定,每批样品平行取3份,分别按最佳提取方案(加入30%乙醇30 mL,回流80 min)提取,精密量取续滤液5.0 mL,置10 mL容量瓶中,用30%乙醇定容至刻度,摇匀,即得各批样品的供试品溶液.按“2.3”项下的方法显色,于500 nm波长处测定吸光度.根据标准曲线计算8批木芙蓉叶样品(包括不同采收期收集的近枯萎的黄叶)的总黄酮含量.结果见表3,不同采收期样品的总黄酮含量的变化规律如图1.

表3 不同采收期药材中总黄酮含量

图1 不同采收期样品的总黄酮含量的变化规律
3 讨论
黄酮类化合物分别具有抗菌、抗氧化、抗肿瘤、抗糖尿病、抗病毒等作用.本研究采用分光光度法测定木芙蓉叶不同采收期样品(包括近枯萎脱落的黄叶)的主要活性成分(总黄酮)的含量,以30倍量的30%乙醇溶液回流提取样品80 min,以木芙蓉叶的主要活性成分之一芦丁作为对照品,采用亚硝酸钠-硝酸铝显色法,在500 nm波长处测定木芙蓉叶样品溶液的吸光度.该含量测定方法准确度高,重现性好,可作为木芙蓉叶总黄酮的含量测定方法.
从6月中旬到12月中旬采自本校的4批成熟叶阴干样品,其总黄酮含量随采收期的推延而逐渐增加,并于12月中旬骤然达到最高;同采于本校的3批近脱落黄叶阴干样品中的总黄酮含量也有这一变化规律;但同一采收期成熟叶的总黄酮含量普遍比近脱落黄叶略高.中国药典2010年版(第一增补本)规定木芙蓉叶在“夏、秋二季采收”,综合以上研究结果,笔者认为该品以冬初采收成熟叶为宜.此外,叶片的总黄酮含量远高于叶柄,成熟叶的叶片含量是叶柄的5倍,近脱落黄叶的叶片的含量高出叶柄的10倍.此外,总黄酮含量的高低与木芙蓉叶样品采摘时是否有嫩叶混杂有关,嫩叶的比例愈大,所测得总黄酮的含量愈低.10月中旬购自安徽亳州的木芙蓉叶样品的总黄酮含量明显低于采自本校的样品,说明产地和药材部位也是影响总黄酮含量的重要因素.
[1] 国家药典委员会.中华人民共和国药典(2010年版)(第一增补本)[M].北京:中国医药科技出版社,2010:3.
[2] 贾敏如,李兴炜.中国民族药志要[M].北京: 中国医药科技出版社,2005: 324.
[3] 张 丽,周长征.木芙蓉叶的研究进展[J].中国医药指南,2013,11(1):453-455.
[4] Saini P ,Gayen P ,Nayak A ,et al. Effect of ferulic acid fromHibiscusmutabilison filarial parasite Setaria cervi: molecular and biochemical approaches[J]. Parasitol Int,2012,61(4):520-531.
[5] 李昌灵,刘胜贵,吴 镝,等.木芙蓉叶提取物的抑菌作用研究[J].食品工业科技,2009,30(11):97-98,101.
[6] 沈钦海,秦召敏,孙志军.木芙蓉叶提取物对大鼠慢性肝损伤的实验性研究[J]. 时珍国医国药,2010,(21)5:1273-1274.
[7] 符诗聪,张凤华,史炜镔,等.木芙蓉有效成分的抗炎实验研究初步报告[J].上海第二医科大学报,2001,21(1):14.
[8] 符诗聪,罗仕华,周玲珠,等.木芙蓉叶有效组分对大鼠肾缺血再灌注损伤的保护作用[J].广西科学,2004,11(2):131-133.
[9] 罗仕华,符诗聪,张凤华,等.木芙蓉叶有效组分对大鼠肾缺血再灌注损伤中TNF-α的影响[J].中国中西医结合杂志,2005,6(25):78-81.
[10] Kumar D ,Kumar H ,Vedasiromoni J R,et al. Bio-assay guided isolation ofα-Glucosidase inhibitory constituents fromHibiscusmutabilisLeaves[J]. Phytochem Anal ,2012,23(5): 421-425.
[11] 傅军霞,吴坚可,汪国丽.木芙蓉叶不同加工方法对总黄酮含量的影响[J].西北药学杂志,2006,21(3):110-111.

