奈达铂腔内灌注治疗恶性心包积液疗效观察
周 焱 朱莹莹 夏秋燕 张 卫 石 慧 周 云
据临床资料报道,晚期恶性肿瘤有15%~30%并发心包转移,原发疾病多见于肺癌,其次为乳腺癌、黑色素瘤、恶性淋巴瘤及白血病,且心包转移的发病率呈明显上升趋势[1]。恶性心包积液迅猛增长可致心包填塞,若不能及时控制病情发展,患者大多在短期内死亡,有效地控制恶性心包积液成为姑息性治疗晚期恶性肿瘤的必要措施之一[2]。我科于2007年2月~2011年4月,采用心包腔内中心静脉导管留置引流并注射奈达铂治疗恶性心包积液16例,疗效满意,现报告如下。
1 资料与方法
1.1 一般资料
本组男性11例,女性5例,年龄48~78岁,中位年龄65岁。全部病例均在心包积液中找到癌细胞,其中肺癌13例(鳞癌4例,腺癌8例,小细胞肺癌1例)、乳腺癌2例、恶性淋巴瘤1例。原发肿瘤均经病理检查证实。
1.2 心包穿刺治疗
置管前常规心脏彩超定位,通常尽量取心尖区为穿刺点,以免长期留置导管影响患者休息。患者取坐位或端坐位,引流导管为美国Arrow公司生产的单腔单孔16G中心静脉导管,埋管深度为8~15 cm。穿刺成功后将引流管体外一侧连接于50 ml注射器,首次抽液量不宜超过200 ml,第1天累积抽液量不宜超过500 ml;随后每天抽液量应少于1000 ml(分次缓慢抽液),直至每天抽液量少于30 ml为止,复查心脏彩超并记录心包积液量。抽取积液送检查找恶性细胞。
1.3 心包内注射药物治疗
在尽量抽尽心包积液(彩超证实)和心包填塞症状、体征明显改善后,经引流管向心包腔内注射地塞米松5 mg和奈达铂40 mg(溶于生理盐水10 ml稀释后缓慢注入)。注射奈达铂前给予止吐等对症处理。心包内药物注射每间隔3~4天重复1次,连续3次后夹闭导管,复查心脏彩超并记录心包积液量。治疗有效者拨除导管;治疗无效者继续抽取积液,间隔21天后重复上述治疗。
1.4 评价标准
参照WHO判定实体瘤疗效标准[3],分为完全缓解(CR):心包积液消失持续30天以上,临床症状完全缓解;部分缓解(PR):心包积液部分消失持续30天以上;无效(NC):心包积液无减少甚至增多,临床症状持续加重。总有效率:CR+PR。生存时间:穿刺置管日起始,直至死亡。
2 结果
2.1 疗效
16例患者均一次性成功置管,总引流量为600~2 500 ml(中位引流量950 ml)。完全缓解13例(81.3%),部分缓解2例(12.5%),总有效率(CR+PR)为93.8%,无效1例(6.2%)。15例患者经治疗后生活质量明显改善。15例患者中位生存期为8.5个月,死因见于肿瘤全身播散所致全身衰竭、恶液质等。1例患者截止随访时已存活45个月。
2.2 不良反应
本研究中,毒副作用主要表现为骨髓抑制、消化道、心脏的不良反应和疲乏感。评估依据WHO标准[3],骨髓抑制以Ⅰ、Ⅱ度粒细胞减少和血小板下降为主要表现,Ⅲ度血小板减少发生率6.3%(1/16)。非血液不良反应中,Ⅰ、Ⅱ度恶心、呕吐发生率37.5%(6/16),无Ⅲ、Ⅳ度发生;Ⅰ、Ⅱ度肝功能损害发生率为37.5%(6/16),Ⅲ、Ⅳ度肝功能损害发生率12.5%(2/16);无肾功能损害;1例出现心脏节律改变(房性搏动),2例出现心脏功能改变(心前区痛),对症处理后好转,无严重心律失常、血流动力学紊乱发生。Ⅰ、Ⅱ度疲乏感发生率31.3%(5/16),无Ⅲ、Ⅳ度发生。所有病例心脏彩超随访均未见感染及缩窄性心包炎发生,见表1。
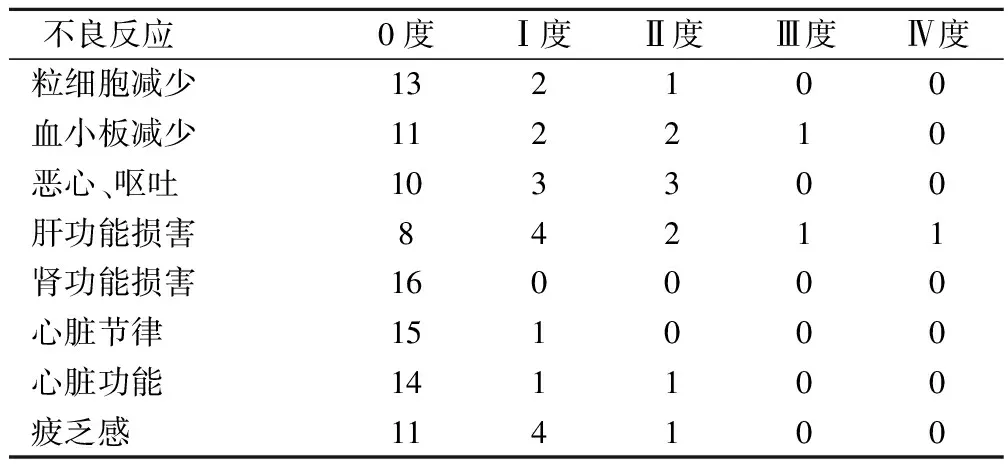
表1 奈达铂腔内灌注治疗恶性心包积液的不良反应(例)
3 讨论
恶性心包积液虽被视为晚期癌症患者的终末表现,但临床文献均表明,恶性心包积液的疗效优于其他浆膜腔积液,即使是对化学治疗、放射治疗不敏感的肿瘤,也应积极给予姑息性治疗,以减轻患者痛苦,提高生存质量和延长生存时间,为进一步治疗原发肿瘤创造机会[4]。通常,恶性心包积液的治疗包括全身和局部治疗。单纯的全身化疗分布到心包腔内的药物十分有限,疗效远低于局部化疗。而局部治疗通过充分引流心包积液后注射化疗药物,药物可随心脏搏动而广泛分布于心包腔内,并通过淋巴途径吸收,抑制肿瘤心包转移,阻止积液复发。因此心包腔内置管并注射化疗药物被认为是1种有效的方法[5]。
长期以来,顺铂应用于治疗恶性浆膜腔积液(胸腔、心包腔等)的疗效已获肯定。文献报道,顺铂心包内灌注化疗可以有效控制心包积液,临床缓解率可达93%[6]。但顺铂的肾毒性和严重的消化道反应限制了其临床的广泛应用。奈达铂的化学名称为顺-二氨基甘醇酸铂,其抗癌作用机制与顺铂相同,主要是与核苷发生反应生成核苷-铂结合物,以顺铂同样的途径与DNA结合抑制DNA复制,其溶出度大约是顺铂的10倍,是1种广谱、高效、毒性小的第二代铂类药物,临床试验也显示奈达铂的抗肿瘤疗效等于或优于顺铂,与顺铂无交叉耐药性,部分对顺铂耐药的病例,应用奈达铂后仍可取得疗效[7]。但临床尚未见奈达铂治疗恶性心包积液报道。本研究采用奈达铂心包内灌注化疗治疗心包积液,总有效率为93.8%(15/16),其中完全缓解率达81.3%(13/16),疗效满意。其中1例激素依赖型乳腺癌心包积液患者,经连续3个疗效治疗、临床症状完全缓解后,继续口服“来曲唑”治疗,截止随访时已存活45个月,心脏彩超随访无复发迹象。仅有1例肺癌(腺癌)患者,重复2个疗程奈达铂治疗无效后,更换其他药物继续心包注射(恩度+顺铂)治疗,仍然无效,最终因纵隔广泛淋巴结转移,妨碍心脏和心包淋巴回流,病情进展,死于心包填塞。
本组研究显示,奈达铂心包腔内灌注化疗治疗心包积液毒副作用轻,患者均能顺利完成治疗。奈达铂的剂量限制性毒性是骨髓抑制,尤其是血小板下降明显(需要4周才能恢复)[8]。在我们的研究中,血液学毒性的发生率还是比较低的,主要以Ⅰ、Ⅱ度粒细胞减少和血小板下降为表现,仅出现1例Ⅲ度血小板减少。我们推测,心包上形成转移癌结节直接堵塞淋巴管或静脉,阻碍淋巴和静脉回流,心包腔内注射奈达铂后在其尚未吸收进入血循环之前,在心包内已被部分代谢,从而使其进入血循环的原形药量减少,从而减轻了骨髓抑制。非血液学毒性主要为恶心呕吐、肝功能损害、心脏不良反应和疲乏感,其中恶心呕吐、心脏不良反应和疲乏感均表现为Ⅰ、Ⅱ度反应,经对症处理后好转;肝功能以Ⅰ、Ⅱ度损害为主,Ⅲ、Ⅳ度损害各出现1例,其中Ⅰ、Ⅱ、Ⅲ度损害者经保肝治疗后好转,另1例Ⅳ度肝功能损害者,临床诊断乙肝病毒激活,经传染科会诊,给予抗乙肝病毒、保肝等对症治疗,症状得以缓解。文献报道[9],化疗后肝功能损害和乙肝病毒(HBV)激活在临床上越来越受到重视,在接受化疗的乙肝表面抗原阳性的癌症患者中,14%~50%的患者体内HBV被重新激活,肝功能损害较非HBV感染明显,激素和细胞毒类化疗药物是HBV激活的高危因素。因此,我们在为癌症患者化疗前做准备工作时,应对乙肝病毒激活提高警惕,必要时行乙肝病毒检测,预防使用抗乙肝病毒药。总之,本研究结果显示奈达铂心包腔内灌注治疗恶性心包积液不仅有良好的疗效,而且耐受性好,安全性较高,适合临床推广应用。
[1] Little W C,Freeman G L.Pericardial disease〔J〕.Circulation,2006,113(12):1622.
[2] 张 颖,曹信杰,李会兰,等.心包腔内置管腔内化疗联合放疗治疗恶性心包积液的临床研究〔J〕.中国综合临床,2006,22(12):1123.
[3] 周际昌.实用肿瘤内科学〔M〕.北京:人民卫生出版社,2005:29.
[4] 郭建峰,张向淼,董 林,等.微创置管心包内给药及引流治疗恶性心包积液〔J〕.中国临床研究,2010,23(8):704.
[5] 林 丽,徐 杰,刘卫民,等.心包置管引流并注入药物治疗恶性心包积液的临床研究〔J〕.中国煤炭工业医学杂志,2011,14(4):521.
[6] 黄章洲,黄 诚,庄 武.顺铂治疗恶性心包积液临床观察〔J〕.中国实用医药,2010,5(3):144.
[7] 邓 颖,邓春美,胡洪林,等.奈达铂或顺铂联合紫杉醇同步放化疗局部晚期鼻咽癌的疗效比较〔J〕.实用癌症杂志,2011,26(2):167.
[8] 周 焱,周 云,石 慧,等.奈达铂腔内灌注联合热疗治疗肺癌胸腔积液的临床观察〔J〕.现代肿瘤医学,2011,19(10):2016.
[9] 陈彦帆,韦 燕,龚建忠,等.恶性肿瘤化疗与乙肝病毒再激活及相关高危因素的临床分析〔J〕.实用癌症杂志,2012,27(1):47.
——再论奈达对翻译本质属性的认知

