替吉奥胶囊治疗老年晚期胃癌的临床疗效观察
吴 军 沈 丰 曹银辉 葛海蓉
胃癌是最常见的恶性肿瘤之一,因其早期缺乏特异性症状,确诊时50%以上患者已无手术机会,而进展期胃癌对化学治疗相对敏感,因此化疗是其主要治疗手段。但老年晚期胃癌患者多有伴随疾病,对化疗耐受性较差。我们采用口服替吉奥胶囊,效果肯定,不良反应轻,现报告如下。
1 资料与方法
1.1 一般资料
选取我科于2011年3月至2012年3月收治的老年晚期胃癌患者30例,均经胃镜病理学检查确诊,病理类型为腺癌,确诊时介于Ⅲb~Ⅳ期,不能手术或手术后复发转移。30例中男性17例,女性13例,年龄66~83岁,中位年龄71岁。所有病例心、肝、肾、肺等功能无明显异常,血常规检查无明显异常,Karnofsky评分60分以上,预期生存期3个月以上。所有病例均有至少1个以上可测量病灶,且无严重并发症(如消化道出血、梗阻、穿孔等)。病例随机均分为观察组和对照组,2组病例一般资料比较无显著性差异(P>0.05),具有可比性。
1.2 治疗方法
观察组予以口服替吉奥胶囊,其中体表面积<1.25 m2者,初始剂量为40 mg/次,每日2次,体表面积1.25 ~1.50 m2者,剂量为50 mg/次,每日2次,体表面积>1.50 m2者,初始剂量为60 mg/次,每日2次,连续服用14天,停7天,为1个周期。对照组予FOLFOX4方案治疗,奥沙利铂85 mg/m2,首日静脉滴注2 h以上,亚叶酸钙200 mg/m2,第1~2天静脉滴注,氟尿嘧啶400 mg/m2,第1~2天静脉推注,然后600 mg/m2,第1~2天持续22 h静脉滴注,每2周重复1次,为1个周期。2组病例均在治疗3个周期后进行疗效评估。
1.3 疗效评价
按照世界卫生组织(WHO)实体瘤近期疗效评价标准[1]进行评定,分为完全缓解(CR)、部分缓解(PR)、无变化(SD)和疾病进展(PD),总有效率为CR+PR。不良反应按照世界卫生组织抗癌药物急性与亚急性毒性表现和分度标准[2]进行评定,分为0~Ⅳ度。
1.4 统计学方法
采用χ2检验,P值<0.05为差异有统计学意义。
2 结果
2.1 疗效
30例均可进行疗效评价。观察组15例中CR 0例,PR 6例,SD 7例,PD 2例,总有效率40.0%;对照组15例中CR 0例,PR 5例,SD 7例,PD 3例,总有效率33.3%。2组有效率无统计学差异(P>0.05)。
2.2 不良反应
观察组主要不良反应为血液学毒性,分别为白细胞减少、血红蛋白减少、血小板减少,但与对照组比较,血液学毒性发生率低且轻,其中白细胞减少、血红蛋白减少发生率2组比较,P<0.05,差异有统计学意义。2组中非血液学毒性主要表现为恶心呕吐、食欲减退及腹泻、手足麻木、肝肾功能异常,大部分程度仅为Ⅰ~Ⅱ度。2组相比,在手足麻木、恶心呕吐、食欲减退及腹泻等方面不良反应发生率,2组比较,P<0.05,有统计学意义。但在血小板减少及肝肾功能异常方面,2组比较,P>0.05,无统计学意义,见表1。
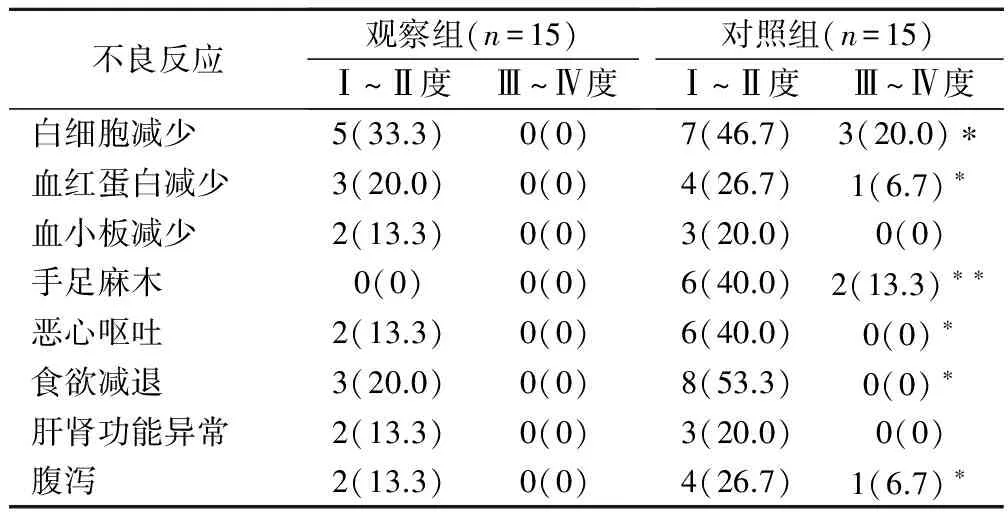
表1 2组患者不良反应发生情况比较(例,%)
3 讨论
在我国,胃癌的发病率和死亡率高居各种恶性肿瘤之首,每年新确诊胃癌患者达30多万,约占全球的1/3,死亡者占所有恶性肿瘤死亡人数的23%[3],严重威胁国民身体健康。由于早期胃癌缺乏特异性症状及有效的筛查机制,约2/3的胃癌在确诊时已属于不可切除的进展期胃癌,失去了手术治疗机会。即使能够行胃癌根治术的患者,也有50%以上在5年内出现原位复发及远处转移,因此以化疗为主的综合治疗已成为晚期胃癌的重要治疗手段。
胃癌对化疗药物相对敏感,联合化疗的有效率为30%~50%,5-FU单药或与铂类联合应用方案,目前仍然是治疗胃癌的基本用药。近年来,随着紫杉类、奥沙利铂、伊立替康等新药的不断开发,化疗药物有效率有所提高,患者生存期有所延长。几项Ⅲ期临床研究选用含多西他赛、奥沙利铂、希罗达、伊立替康及S1方案,中位生存期仅接近或略超过1年[4]。晚期胃癌目前仍缺乏公认的高效低毒的“金标准”方案。
尽管晚期胃癌至今尚无标准规范的化疗方案,但目前5-FU仍然是公认的基本治疗药物[5]。5-FU是抗代谢类肿瘤药,为细胞周期特异性药物,主要抑制S期细胞,但半衰期短(10~20 min),为时间依赖性药物,易被正常器官和肿瘤组织产生的二氢嘧啶脱氢酶快速降解(达85%以上)而失活[6]。
替吉奥是近年来新型的1种氟脲嘧啶类抗癌药物,口服后经肝脏转化为5-FU,从而起到抗癌效果。有关实验表明:替吉奥服用后,其毒性仅为5-FU的1/4~1/7,化疗指数却为5-FU的2倍[7]。替吉奥最早在日本研发上市,2004年被推荐联合DDP作为胃癌治疗基本方案,目前已成为日本治疗胃癌的首选药物,治疗晚期胃癌有效率达44%[8]。替吉奥由替加氟(FT)、吉美拉西(CDHP)和奥替拉西钾(OXO)通过1∶0.4∶1合成,FT作为5-FU的前体药物,口服吸收好,具有优良的生物利用度,能在体内经肝微粒体的细胞色素P-450酶系统作用转化为5-FU,从而发挥抗癌作用[9]。CDHP则能够选择性抑制肝二氢嘧啶脱氢酶(DPD),阻止5-FU在体内的分解代谢,使5-FU在血浆和肿瘤组织中能够更长时间地保持较高的稳定血药浓度,从而增强其抗肿瘤活性,克服了5-FU半衰期短、代谢快的不足。此外,OXO作为S-1的重要成分之一,口服给药后在消化道分布浓度高,对消化道内分布的乳清酸磷酸核糖转移酶(ORPT)有选择性拮抗作用,并通过抑制ORPT阻止5-FU磷酸化转变为5-FU脱氧核苷酸(5-FUMR),从而降低5-FU在胃肠道的毒性及不良反应。与5-FU相比,替吉奥因能持续维持较高的血药浓度进而取得更佳的疗效,因抑制了5-FU的磷酸化而降低了5-FU在消化道的不良反应,口服给药途径较之静脉持续滴注更方便。
据统计,日本目前晚期胃癌的化疗,80%使用替吉奥[10]。日本对S-1进行了较长时间大规模的临床研究。Koizumi等在完成的一项进展期胃癌Ⅱ期临床研究中(SPIRITS试验)发现,S-1总有效率为46%[11]。FLAGS试验为一项Ⅲ期多中心研究,招募1053例进展期胃癌患者,比较顺铂联合S-1与顺铂联合5-FU方案作为一线治疗的疗效,主要研究终点是总生存率。结果发现,S-1组的总生存率并没有比5-FU组高,但是,其不良反应发生率低于5-FU组,S-1组中弥漫型胃癌患者的生存率有所提高[12]。JCOG 9912研究[13]比较5-FU、伊立替康联合顺铂或S-1 3种方案作为一线治疗方案治疗进展期胃癌的疗效。结果显示,3组中位生存时间分别为10.8个月、12.3个月和11.5个月。在S-1不良反应及对生存影响方面,有研究提示:在亚洲患者中,S-1的不良反应主要为粒细胞减少、贫血[14]。S-1联合顺铂作为新辅助化疗方案,Ⅲ~Ⅳ级不良反应发生率仅为7%[15,16]。S-1最常见Ⅲ~Ⅳ级不良反应主要为恶心、呕吐、腹泻、食欲不振和血液学毒性,总发生率约6%[17]。Boku等[18]报道S-1单一给药与连续5-Fu静脉给药治疗无法切除的或转移性胃癌相比较,S-1具有一定优势(P<0.01)。
本组研究表明,口服单药替吉奥胶囊与目前常规化疗(氟尿嘧啶类联合铂类-FOLFOX方案)的总有效率相近,疗效比较无统计学差异,但在不良反应方面,无论血液学毒性或非血液学毒性,口服替吉奥均优于后者,尤其在神经毒性方面,优势更为明显。
综上所述,口服单药替吉奥治疗老年晚期胃癌,疗效肯定,不良反应轻微,口服给药方便,患者依从性好,值得进一步推广使用。
[1] Miller A B,Hoogstraten B,Staquet M,et al.Reporting results of cancer treatment〔J〕.Cancer,1981,47(1):207.
[2] 周际昌.实用肿瘤内科学〔M〕.第2版.北京:人民卫生出版社,2005:28.
[3] 于世英.临床肿瘤学〔M〕.北京:科学出版社,2006:164.
[4] Wesolowski R,Lee C,Kim R.Is there a role for second-line chemotherapy in adavanced gastric cancer?〔J〕.Lancet Oncol,2009,10(9):903.
[5] 秦叔逵,龚新雷.晚期胃癌化疗的现状和新进展〔J〕.临床肿瘤学杂志,2006,11(9):641.
[6] M Malet-Martino,R Martino.Clinical studies of three oral prodrugs of 5-Fluorouracil(Capecitabine,UFT,S-1):a review〔J〕.The oncologist,2002,7(4):288.
[7] Koizumi W.S-1 plus cisplatin vel~us S-1 alone for first line treatment of advanced gastric cancer.(SPIRI TS trial):a phaseⅢ trial〔J〕.Lancet Oncol,2008,9(3):215.
[8] 王东建.单药替吉奥治疗老年晚期胃癌患者的疗效观察〔J〕.实用癌症杂志,2012,27(2):203.
[9] 刘 莉,郑 盈,张智勇,等.替吉奥单药口服治疗老年晚期胃癌的临床观察〔J〕.实用癌症杂志,2011,26(3):294.
[10] 白坂哲彦,佃守犬山,夫他新规.经口抗癌剂TS-1(S-1)〔J〕.癌症化学疗法,2001,28(6):855.
[11] Koizumi W,Kurihara M,Nakano S,et al.PhaseⅡ study of S-1,a novel oral derivative of 5-fluorouracil,in advanced gastric cancer.For the S-1 Cooperative Gastric Cancer Study Group〔J〕.Oncology,2000,58(3):191.
[12] Ajani JA,Rodriquez W,Bodoky G,et al.Multicenter phaseⅢcomparison of cisplatin/S-1 with cisplatin/infu-sional fluorouracil in advanced gastric or gastroesophageal adenocarcinoma study:the FLAGS trial〔J〕.J Clin Oncol,2010,28(9):1547.
[13] Fuse N,Fukuda H,Yamada Y,et al.Updated results of randomized phaseⅢstudy of 5-fluorouracil alone versus combination of irinotecan and cisplatin versus S-1 alone in advanced gastric cancer(JCOG 9912)〔J〕.J Clin Oncol (Meeting Abstracts),2009,27(15s):4514.
[14] Kawai H,Ohtsu A,Boku N,et al.Efficacy and safety profile of S-1 in patients with metastatic gastric cancer in clinical practice:results from a post-marketing survey〔J〕.Gastric Cancer,2003,6(Suppl 1):19.
[15] Kochi M,Fujii M,Kanamori N,et al.Neoadjuvant chemotherapy with S-1 and CDDP in advanced gastric cancer〔J〕.J Cancer Res Clin Oncol,2006,132(12):781.
[16] Satoh S,Hasegawa S,Ozaki N,et al.Retrospective analysis of 45 consecutive patients with advanced gastric cancer treated with neoadjuvant chemotherapy using an S-1/CDDP combination〔J〕.Gastric Cancer,2006,9(2):129.
[17] Sakuramoto S,Mitsuru S,Toshiharu Y,et al.Adjuvant c-hemotherapy for gastric cancer with S-1,an oral fluoropy-rimidine〔J〕.N Engl J Med,2007,357(18):1810.
[18] Boku N,Yamamoto S,Fukuda H,et al.Fluorouracil versus combination of irinotecan plus cisplatin versus S-1 in metastatic gastric cancer:a randomised phase 3 study 〔J〕.Lancet Oncol,2009,10(11):1063.

