交替氧化酶在果蔬抗氰呼吸途径的调控机制
郭 芹, 李庆鹏, 靳 婧, 李伟明, 哈益明
中国农业科学院农产品加工研究所, 农业部农产品加工重点实验室, 北京 100193
抗氰呼吸与果蔬的总呼吸、品质劣变、成熟衰老、贮藏寿命、采后生理性病害、采后处理和贮藏技术密切相关,其末端氧化酶,即交替氧化酶(alternative oxidase,AOX),在果蔬生长发育过程及果蔬对外界刺激的响应过程发挥重要作用,而这些作用又与AOX本身的生理结构有着密切的联系[1]。AOX最初是在天南星科植物佛焰花序开花的产热现象中被发现,新的研究认为抗氰呼吸途径存在于除细菌外的整个生物界中,包括真菌、藻类和酵母等[2,3]。在果蔬中,线粒体电子传递链主要有细胞色素主路和抗氰交替支路两条途径[3,4],其中抗氰呼吸途径(交替途径)是以交替氧化酶为末端氧化酶的氰不敏感电子传递链途径,从线粒体内膜电子传递链的主呼吸途径的泛醌(ubiquinone,UQ)处分支,电子不进行跨膜运输直接传递到末端氧化酶,并催化分子氧还原成水,与电子传递链主路途径中的复合体CⅠ、复合体CⅢ和复合体CⅣ不同,不产生质子电化学势能,不能驱动ATP的合成,只能产生少量的能量(图1)[5,6]。目前,果蔬抗氰呼吸的调空机理以及外界胁迫下果蔬交替氧化酶运行的生理学意义已成为果蔬采后成熟衰老领域的研究热点。近年来,随着抗氰呼吸之谜的逐步解开,现对抗氰呼吸运行和功能的了解也越来越多。本文主要是将近年来国内外关于抗氰呼吸末端交替氧化酶的结构、生理功能、抗氰呼吸的运行机制及其在果蔬中研究现状加以综述,以期得出对抗氰呼吸在果蔬中的研究有新的认识,同时对采取有效方法延缓果蔬成熟、延长货架期等均具有重要的意义。
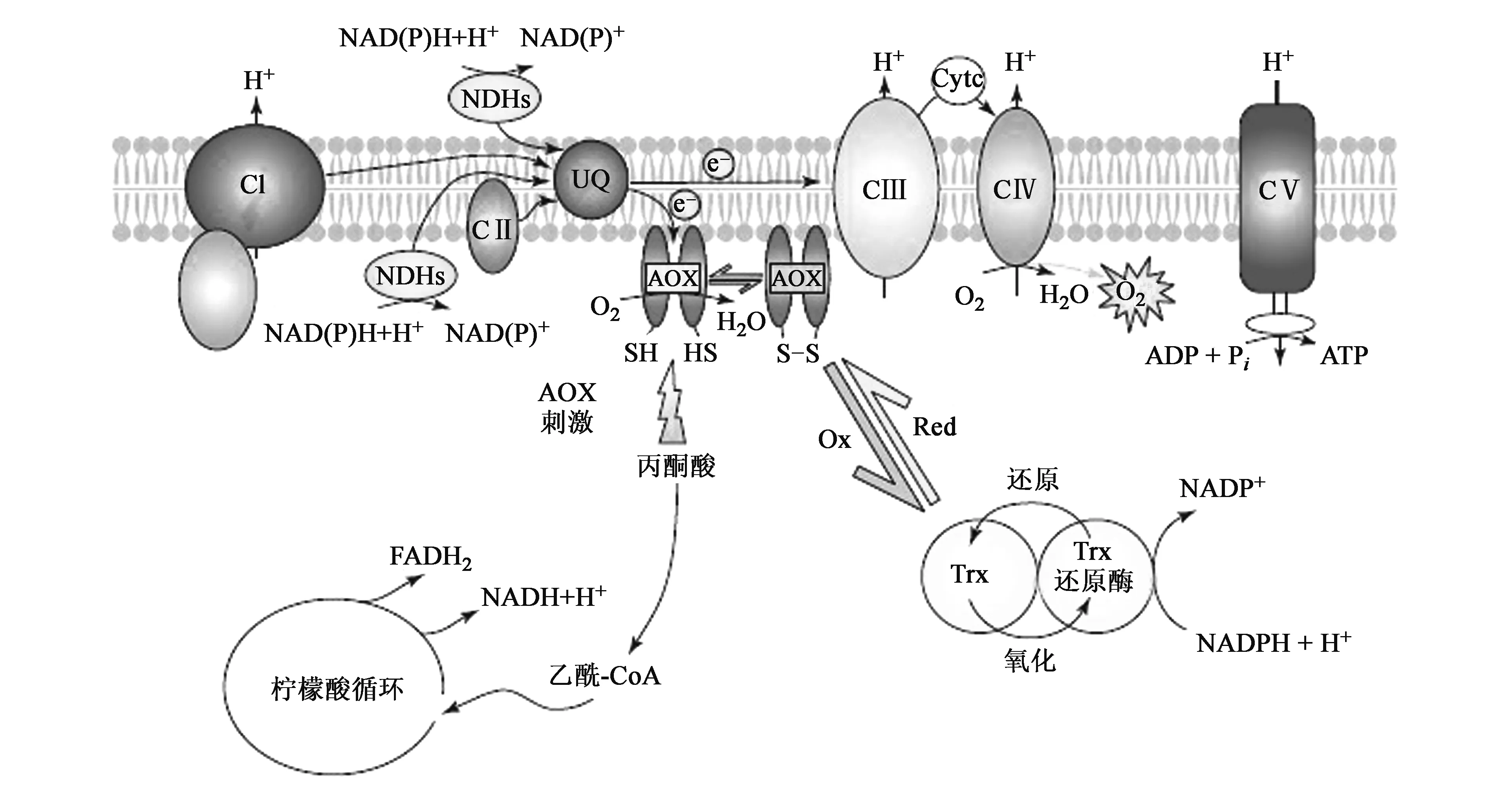
图1 抗氰呼吸途径在植物线粒体电子传递链途径的代谢[4]Fig.1 Cyanide-resistant respiration pathway in plant mitochondrial electron transport chain metabolism[4].AOX:交替氧化酶;CⅠ:NADH-泛醌氧化还原酶;CⅡ:琥珀酸-泛醌氧化还原酶;CⅢ:泛醌-细胞色素C氧化还原酶;CⅣ:细胞色素C氧化酶;UQ:泛醌库
1 AOX的结构及编码基因
1995年,Siedow等[7]首先提出了AOX蛋白在膜上的结构模型,认为AOX是一种膜整合蛋白,有2个跨膜的α-螺旋镶嵌在线粒体内膜,其活性位点包含一个不含血红素的双铁中心[3]。修正模型认为AOX是一种膜间蛋白,具有双铁活性中心,它的活性位点在长螺旋柱上,但不存在跨膜螺旋结构,不是跨膜蛋白[1]。后来的研究以AOX与核苷酸还原酶(RNR)R2型双铁蛋白具有相似的结构和催化作用,提出了AOX的泛醌结合位点的结构,认为AOX是双铁羧基蛋白家族中的一员[4]。目前新观点认为AOX是一种定位于线粒体内膜中的双铁羧基蛋白,所有的双铁蛋白都是由4个螺旋束组成,其中第1和第4个螺旋均包含一个保守的E-X-X-H单元,形成了双铁中心,并且这些双铁蛋白还能够激活分子氧[1]。随着对AOX研究的逐步深入,人们对其结构模型的建立有了一个新的认识,但在线粒体膜间蛋白的双铁中心,AOX的具体存在形式以及作用方式还需要大量的实验证明。
AOX在果蔬中是由核基因编码的多基因家族,分为两个亚家族,AOX1和AOX2,编码蛋白分子质量在32~39 kDa之间,一般都具有4个外显子和3个内含子。单子叶和双子叶植物中都有AOX1家族,但AOX2家族仅存在于双子叶植物[3]。研究表明,胡萝卜有4个不同的AOX基因,分别为AOX1基因家族的AOX1a、AOX1b和AOX2基因家族的AOX2a、AOX2b基因,它们在胡萝卜的生长发育过程都表达[8];番茄AOX1a和AOX1b基因在根、叶和果实中表达,而AOX1c基因只在根中表达[2];荔枝AOX1在根和叶中表达量高,在茎中表达较弱,在果实中表达弱[9];西瓜AOX2在生长发育的各个过程都表达,且在果实中表达量较高[10]。葡萄的AOX1a在果实和根中表达,AOX1b在花期表达,AOX2在整个生长发育过程都表达[11]。这些结果表明AOX基因随着果蔬的生长发育而差异性表达,但在不同果蔬中的数目、序列信息及功能等还有待进一步研究。
2 AOX的生理功能
AOX在果蔬体内可以通过改变自身结构来主动调节抗氰呼吸和总呼吸的运行,进一步调控果蔬细胞的能量代谢和生理功能,以适应外界环境的改变。早期发现AOX在天南星科植物佛焰花序开花时能产生大量热,使花期产生的芳香物质快速散发,从而吸引喜热的昆虫前来传粉[3,6,12]。而在非产热组织中,AOX的功能以“溢流”假说得到广泛接受,即当主呼吸链活性受到抑制或细胞内还原力水平偏高时,电子通过AOX的传递可使三羧酸循环和糖酵解继续进行[1,3]。Considine等[13]发现AOX在采后芒果的呼吸跃变和衰老过程起重要作用,AOX基因和蛋白的表达量随着芒果的成熟逐渐增加,尤其是呼吸越变后大量表达。研究也发现抑制AOX基因表达可导致线粒体活性氧的大量积累,活性氧的积累能诱导细胞的迅速死亡;而过表达AOX基因则可以减少番茄果实贮藏过程活性氧的产生,降低由氧化伤害引起的细胞凋亡,可能是AOX能有效促使分子氧与还原醌相互作用生成水从而减少活性氧的生成量[14]。
也有研究表明,AOX途径的加强可以将超过细胞需求的底物消耗掉,通过调控ATP的合成来维持能荷的稳定和电子传递链的正常运行,使果蔬在不同环境胁迫下稳定生长[15,16]。当外界胁迫引起细胞内氧压升高,AOX就会参与形成抗氧化防御体系,保护果蔬细胞免受氧化损伤,维持正常的能量代谢,提高自身抵御逆境的能力[3]。这些研究都表明,AOX在果蔬生长发育过程具有清除活性氧、抑制细胞凋亡、稳定生长发育和增加抵御能力等功能,但其运行的信号调节机制和生理学意义尚不清楚。此外,AOX还与光合作用有关,强光能降低AOX基因的表达,诱导NAD(P)H的表达,因此调节抗氰呼吸途径运行使光合电子传递保持一个较高的水平,能减少胁迫环境对光系统的损伤,也有利于维持光合代谢的正常运行[15]。因此,了解AOX生理功能,解开AOX与其他物质之间的相互作用关系,阐明它们与果熟成熟衰老的作用机制将是今后研究的重点。
3 抗氰呼吸的运行机制
抗氰呼吸与果蔬的种类、生理过程及功能等密切相关,在果蔬体内的实际运行程度也有很大差异。果蔬体内关于AOX蛋白的调节也较为复杂,诸多因素都可能在各种水平上调节抗氰呼吸。除了研究已证明的AOX蛋白的还原状态和泛醌库的还原程度外,近年的研究又发现了对氧化还原状态敏感的巯基/二硫键系统的调节机制[4,15],该机制认为AOX在果蔬体内是单体以二硫键连接,形成同型二聚体形式存在,称为氧化态AOX(非活性或低活性状态),而单体则被认为是还原态AOX(活性或高活性状态)。果蔬体内氧化态和还原态之间的相互转化为抗氰呼吸的运行提供了一种快捷的调控机制。然而对于AOX二硫键氧化态与还原态在组织体内相互转变的运行机制有待研究。
第二种调节机制是α-酮酸(尤其是丙酮酸)对AOX活性的刺激[12,14], 这种作用独立于丙酮酸代谢,直接作用于AOX蛋白,使AOX的构象发生变化而导致活性增加。Carré等[17]用纯化的AOX与丙酮酸反应也证明了这一观点,并指出只有在丙酮酸存在的条件下,AOX的活性才能保持稳定。
还有研究提出了控制泛醌处流量的调节机制。主要通过两条途径:一是改变AOX蛋白的数量来控制从泛醌处溢流到交替途径的流量,从而进行粗略调节,而还原泛醌的水平则反应AOX的表达情况;二是通过AOX活性的改变来调控泛醌库的氧化还原的平衡、AOX分子内二硫键的状态、激活剂的浓度等因子,从而进行精确调控。然而AOX活性的调控相当复杂,因此AOX在不同果蔬中具体的运行调节机制仍有待研究。
4 抗氰呼吸对果蔬成熟衰老的作用
在果实呼吸跃变时,以抗氰呼吸为主,跃变过后主要以细胞色素途径为主,成熟衰老期间伴随着总呼吸的加强。抗氰呼吸途径在果实衰老初期升高,在很多果实切片陈化后发生的诱导呼吸中也占了很大比例,降低抗氰呼吸途径所占比例,能降低总呼吸强度,从而延缓果实的衰老。
研究发现[2,6,18],抗氰呼吸所占比例与荔枝果实成熟度有关,未熟荔枝果实中的抗氰呼吸比半熟果和成熟果的高;进入跃变期的苹果的呼吸作用发生了由细胞色素途径向抗氰呼吸途径转变的现象;鸭梨、黄冠梨的衰老也与抗氰呼吸所占比例有关。
对番茄果实的研究发现,果实对乙烯信号的响应并发生呼吸跃变是由于存在抗氰呼吸,抑制番茄的抗氰呼吸可降低乙烯合成基因及受体基因的表达量,延缓果实的呼吸跃变和成熟衰老[19]。Guo等[20]也发现抑制抗氰呼吸和AOX基因的表达量,乙烯释放量和乙烯合成基因的表达量会降低。相反,诱导抗氰呼吸能提高黄瓜叶片耐寒性,辣椒抗高温和抗旱能力。这些结果表明AOX参与果实的呼吸跃变和果实的成熟衰老,同时可能还存在其他物质与呼吸跃变和果实成熟有关,如解偶联蛋白,与AOX互补共同调节呼吸跃变和果实成熟[3]。在采后果实贮藏过程,各种生物和非生物胁迫都可以诱导AOX表达,如:低温、水杨酸、H2O2、机械伤等,但从分子水平研究以AOX为中心的抗氰呼吸调控网络及它们与果实成熟衰老的关系,对于采取有效措施调控果实的成熟衰老具有重要意义。
5 问题与展望
目前对抗氰呼吸途径AOX结构、生理功能、运行机制以及对果蔬成熟衰老作用方面的研究虽然已经取得了一定的成果,特别是已在果蔬中发现了编码AOX的基因,使抗氰呼吸在果蔬中的研究进入了分子水平,但还存在许多问题亟待解决,例如果蔬中关于抗氰呼吸相关基因的序列信息、数目、表达特性等问题的研究,抗氰呼吸基因表达与贮藏过程细胞代谢之间的相互影响尚不清楚,尤其是与调控果蔬生长及贮藏的氧化还原信号途径及胁迫应答之间的关联,这些问题的研究将有助于阐明抗氰呼吸的在果蔬细胞内的调控路径,也为进一步研究胁迫环境下果蔬的适应性调节奠定了基础。已有的研究虽然已经打破了AOX在果蔬体内只是被动调节呼吸链电子传递的认识,但AOX如何在果蔬体内主动地调节细胞与能量代谢之间的平衡使果蔬在逆境胁迫下正常发育还不明确。此外,研究已发现乙烯生成与AOX的调节有关,但AOX在乙烯合成路径的作用位点以及乙烯对AOX结构、生理功能及信号转导途径的影响也是需要进一步研究的问题。随着抗氰呼吸途径末端氧化酶AOX新的研究方向的开展,将有助于阐明它在果蔬体内更多的生理功能,以拓展人们对AOX这一功能蛋白的认识,也有利于明确以AOX为中心抗氰呼吸的作用网络,对采取有效方法调控果蔬的呼吸代谢具有重要意义,同时也为果蔬的高效、低碳贮运保鲜奠定理论基础。
参 考 文 献
[1] 雷 韬, 袁 澍, 刘文娟, 等. 交替氧化酶结构和功能研究进展[J]. 西北植物学报, 2006, 26(3): 649-654.
[2] Vanlerberghe G C. Alternative oxidase: a mitochondrial respiratory pathway to maintain metabolic and signaling homeostasis during abioticand biotic stress in plants[J]. Int. J. Mol. Sci., 2013, 14(4): 6805-6847.
[3] 徐 飞, 袁 澍, 梁厚果, 等. 交替氧化酶和解偶联蛋白在植物线粒体中的作用及其相互关系[J]. 植物生理学通讯, 2009, 45(2): 105-110.
[4] 吴 强, 李红玉, 张立新, 等. 环境胁迫与植物抗氰呼吸[J]. 西北植物学报, 2003, 23(1): 164-170.
[5] Arnholdt-Schmitt B, Costa J H, de Melo D F. AOX-a functional marker for efficient cell reprogramming under stress[J]? Trends Plant Sci., 2006, 11(6): 281-287.
[6] 孙文泰. 外源水杨酸对采后鸭梨果实呼吸途径的影响[D]. 河北保定: 河北农业大学, 硕士学位论文, 2010.
[7] Siedow J N, Umbach A I, Moore A I. The active site of the cyanide-resistant oxidase from plant mitochondria contains a coupled binuclear iron center[J]. FEBS Lett.,1995,362:10-14.
[8] Sircar D, Cardoso H G, Mukherjee C,etal.. Alternative oxidase (AOX) and phenolic metabolism in methyl jasmonate-treated hairy root cultures ofDaucuscarotaL[J]. J. Plant Physiol., 2012, 169: 657-663.
[9] Wang H, Qian Z, Ma S,etal.. Energy status of ripening and postharvest senescent fruit of litchi (LitchichinensisSonn.)[J]. BMC Plant Biol., 2013, 13(55): 1-16.
[10] 李严曼, 朱 磊, 杨 景, 等. 西瓜交替氧化酶AOX2基因的克隆与分析[J]. 果树学报, 2011, 28(5): 909-914.
[11] Costa J H, de Melo D F, Gouveia Z,etal.. The alternative oxidase family ofVitisviniferareveals an attractive model to study the importance of genomic design[J]. Physiol. Plant., 2009, 137(4):553-65.
[12] 魏潇潇. 几种切花不同衰老过程中抗氰呼吸变化的研究[D]. 北京: 北京林业大学, 硕士学位论文, 2007.
[13] Considine M J, Daley D O, Whelan J. The expression of alternative oxidase and uncoupling protein during fruit ripening in mango[J]. Plant Physiol., 2001, 126: 1619-1629.
[14] 韩 娜. 抗氰呼吸途径在水稻幼苗低温胁迫和黄化水稻幼苗转绿过程中的作用[D]. 兰州:兰州大学,硕士学位论文,2009.
[15] 于 芹. 自然休眠诱导期油桃芽体抗氰呼吸代谢研究[D]. 山东泰安: 山东农业大学, 硕士学位论文, 2008
[16] 晏婴才. 不同温度胁迫与水杨酸处理对烟草愈伤组织抗氰呼吸的影响及其交替氧化酶基因表达的分子生物学研究[D]. 成都: 四川大学, 硕士学位论文, 2002.
[17] Carre J E, Affourtit C, Moore A L. Interaction of purified alternative oxidase from thermogenic Arum maculatum with pyruvate[J]. FEBS Lett., 2011, 585: 397-401.
[18] 张淑玲. 外源水杨酸处理对采后黄冠梨果实呼吸途径的影响[D]. 河北保定: 河北农业大学, 硕士学位论文, 2008.
[19] Xu F, Yuan S, Zhang D W,etal.. The role of alternative oxidase in tomato fruit ripening and its regulatory interaction with ethylene[J]. J. Exp. Bot., 2012, 63(2): 695-709.
[20] Guo Q, Lv X, Xu F,etal.. Chlorine dioxide treatment decreases respiration and ethylene synthesis in fresh-cut ‘Hami’ melon fruit[J]. Int. J. Food Sci.Tech., 2013, 48(9): 1775-1782.

