超滤耦合径向流色谱分离纯化灵芝多糖的研究
邵 平, 刘 青, 陈纯彬, 秦敏朴, 孙培龙
1.浙江工业大学生物与环境工程学院, 杭州 310014;2.浙江一派食品有限公司, 浙江 金华 321100
灵芝是一类属于担子菌亚门的白腐真菌,在我国作为医药原材料已有上百年历史,目前已广泛用于保健品和中草药的开发[1,2]。研究表明,灵芝中含有三萜类、多糖甾醇类、氨基酸多肽类、呋喃类衍生物等活性物质,对糖尿病、心血管病、肿瘤等疾病的预防和治疗具有一定的功效[3~5]。而多糖作为灵芝中的主要活性成分,传统提取方法得率较低;若采用酶解法水解多糖,可有效破坏细胞壁,释放胞内多糖,从而增强多糖的提取率[6,7]。
研究表明[8,9],酶解后的多糖中,仍含有蛋白质、果胶等大分子,为了提高多糖纯度,需要进一步分离纯化。通过超滤,则能对这些杂质有效地去除,并能实现不同分子量多糖的分级[10],便于今后对多糖活性的研究。超滤是一种以选择性透过膜为分离介质,基于机械筛分原理,以膜两侧压差为动力,对双组分或多组分的液-液混合体系进行分离、分级、提纯和富集的溶液分离过程[11]。目前,超滤已用于多糖、中药、酶制剂等有效成分的提取分离应用中[12~14]。Li等[15]用切向流超滤海藻胞外聚合物取得了比较好的效果,并验证了中试规模化生产的可行性;肖如武等[16]采用超滤对蓝蛤蛋白酶解液中不同分子量的呈味肽实现了富集浓缩,其中,小于3 kU肽段的含量由47.26%提高到76.66%;张宁[17]通过截留分子量为50 kDa中空纤维超滤膜浓缩土壤杆菌胞外多糖的发酵液,去除了发酵液中的蔗糖、氮源及无机离子,多糖回收率达82.7%。因此,作为分离纯化多糖的一种重要手段,超滤越来越受到人们的重视。
本文采用超滤对灵芝多糖酶解液中的蛋白质进行脱除,确定了适宜的膜超滤参数。比较了超滤耦合径向流色谱法与其他方法脱蛋白的效率,为该法在多糖工业化生产中的应用提供理论依据和奠定基础。
1 材料与方法
1.1 材料与试剂
灵芝子实体;苯酚、浓硫酸、氢氧化钙、氢氧化钠、亚硫酸钠、3,5-二硝基水杨酸、碳酸钠、酒石酸钾钠、硫酸铜,葡萄糖等试剂均为分析纯;纤维素酶,8万U/g,张家港金源生物化工有限公司产品;木瓜蛋白酶,100万U/g,购自上海蓝季科技发展有限公司。
1.2 设备与仪器
紫外-可见分光光度计,752型,上海光学仪器有限公司;低速冷冻离心机,L535R型,长沙湘仪离心机有限公司;恒速搅拌器,S-212型,上海申胜生物技术有限公司;数显恒温水浴锅,HH-2型,荣华仪器制造有限公司;电子天平,PL602型,梅特勒-托利多仪器有限公司;pH计,PHSJ-4A型,上海精密科学仪器有限公司;电子分析天平,AR1140型,奥豪斯国际贸易有限公司;超滤系统,Congent M,美国密理博公司;超滤膜为改良聚醚砜复合膜(PES),膜面积0.1 m2,膜分子量分别为100 kDa、30 kDa和10 kDa,其中100 kDa膜为tpye C,30 kDa和10 kDa膜为type A。
1.3 实验方法
1.3.1灵芝多糖的酶解 使用复合酶(木瓜蛋白酶∶纤维素酶=2∶1)在56℃、pH 7.0条件下水解灵芝子实体多糖,多糖酶解液经8 000 r/min离心10 min后,上清液储存于4℃下备用[18]。
1.3.2超滤膜的选择 在室温及压力小于30 psi条件下,将酶解液依次通过截留分子量为100 kDa、30 kDa和10 kDa的超滤膜,然后测定每段分子量间的多糖含量,分析灵芝多糖的分子量分布。以多糖的截留率、蛋白质去除率及膜的性能为指标,综合评价不同孔径超滤膜的过滤效果。
1.3.3超滤耦合径向流色谱分离灵芝多糖工艺流程 在不同步骤分别采用径向流色谱法、轴向色谱法和Sevag法脱除灵芝子实体中的多糖蛋白。
径向流色谱法:上样量为100 mL,上样浓度为10 mL/min,上样流速为2 mL/min,洗脱流速为50 mL/min;色谱柱参数:柱体积250 mL,床层高度为3 cm,柱高5 cm。
轴向色谱法:上样量为100 mL,上样浓度为10 mL/min,上样流速为2 mL/min,洗脱流速为50 mL/min;色谱柱参数为:柱体积250 mL,床层高度为46 cm,柱高50 cm。
Sevag法:取截留液与Sevag试剂(3∶1)混合,分液漏斗中充分振荡30 min,静置3 h,取上清液测定蛋白质和多糖含量。
1.4 测定和计算方法
总糖含量的测定采用苯酚-硫酸法[19]。多糖浓度和吸光度的线性回归方程为:
y=0.007 6x+0.019,R2=0.999 3
其中,y为吸光值,x为葡萄糖含量(μg)。
蛋白质含量的测定采用Folin-酚法[20]。牛血清白蛋白浓度与吸光值的线性回归方程为:
y=0.003 4x+0.095 9,R2=0.998 6
其中,y为吸光值,x为牛血清蛋白含量(μg)。
多糖截留率[21]的计算公式为:
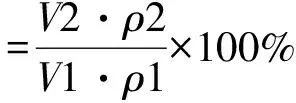
其中,V2,ρ2分别为超滤后浸提液的体积和多糖的质量浓度;V1,ρ1分别为超滤前浸提液的体积和多糖的质量浓度。
蛋白质脱除率的计算公式为:
超滤通量[21~23]用单位时间内通过单位面积的透过液量表示:
J=V/tA
其中:J为超滤通量[mL/(cm2·min)];V为透过液体积(mL);A为膜的有效面积(m2);t为超滤时间(min)。
2 结果与分析
2.1 灵芝多糖相对分子质量分布
将灵芝多糖酶解液依次通过不同孔径的超滤膜,超滤膜对多糖分子的截流效果见图1A,其相对分子质量分布如图1B。
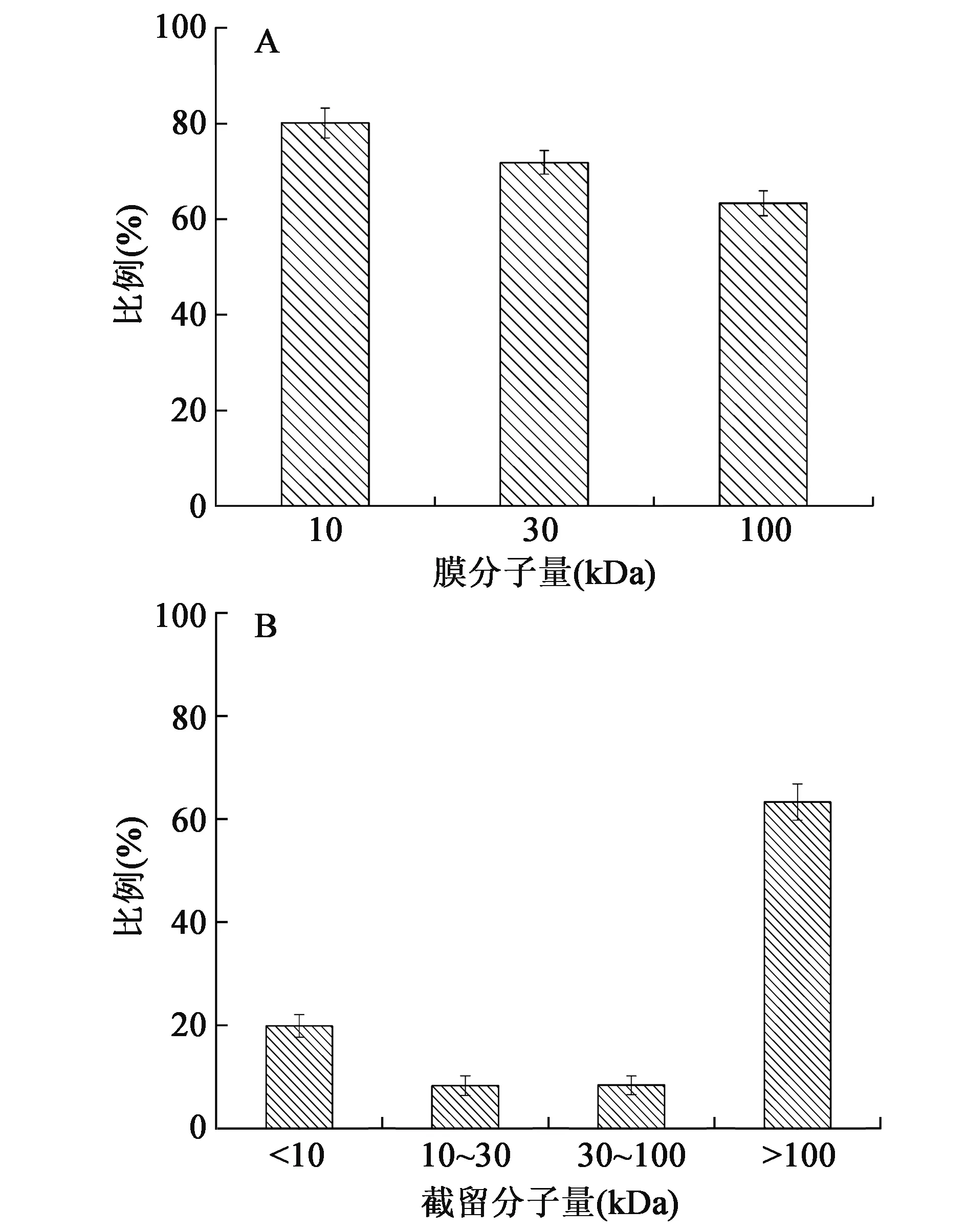
图1 灵芝子实体酶解液中多糖的膜截流率(A)和相对分子质量分布(B)Fig.1 Flow rate (A) and relative molecular mass distribution (B) of polysaccharide in hydrolyzate of Ganoderma lucidum fruiting bodies.
由图1可以看出,酶解液多糖以相对分子质量100 kDa以上为主,含量达63.32%;其次为分子量小于10 kDa的多糖,含量为19.96%;相对分子量30~100 kDa及10~30 kDa之间的多糖含量相当,分别为8.4%和8.32%。此外,不同分子量的超滤膜对灵芝子实体酶解液多糖的截留率差异显著,随着膜孔径的增大,多糖截留率降低。其中,10 kDa的超滤膜对多糖的截留率约为80.12%,而30 kDa和100 kDa的超滤膜对多糖的截留率分别为71.83%和63.32%。
2.2 不同分子量超滤膜的蛋白去除率
超滤膜在截留多糖的同时,也使得部分大分子蛋白质难以脱除。不同分子量的超滤膜对蛋白质的脱除效果如图2所示。
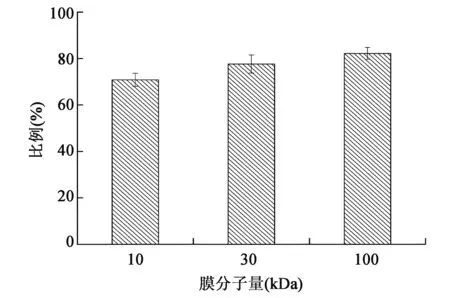
图2 不同分子量膜对灵芝子实体多糖酶解液的蛋白质去除率Fig.2 The protein removal rate of different ultrafiltration membranes from hydrolyzate of Ganoderma lucidum fruiting bodies.
分别对分子量100 kDa、30 kDa、10 kDa超滤膜超滤所得截留液以及滤过液进行蛋白质含量测定,结果显示,10 kDa和30 kDa超滤膜对蛋白质的脱除率分别为70.81%和77.62%,100 kDa超滤膜对蛋白质的脱除率最高,达82.21%。随着超滤膜分子量的增大,蛋白质去除率提高。这是由于实验中用于超滤的灵芝子实体多糖溶液是经过纤维素酶和蛋白酶复合酶解灵芝子实体所得,因此较其他提取方法所得粗多糖溶液,酶解液中含有相对较多的游离小分子蛋白质。
2.3 不同分子量超滤膜膜参数的测定
在料液浓度、超滤时间、料液体积流量等参数相同的条件下,分别研究纯水体积流量对超滤膜通量的影响及酶解液体积流速百分比对超滤系统压力的影响,结果如图3所示。
从图3A中可以看出,随着纯水体积流速的增加,超滤膜通量均不断增大,其中尤以100 kDa超滤膜的增速最快。此外,在相同的纯水体积流速下,100 kDa超滤膜具有最大的超滤通量。在图3B中,随着酶解液体积流速的增加,10 kDa超滤膜的压力增加最为显著,30 kDa超滤膜次之,而100 kDa超滤膜最小。30 kDa超滤膜与100 kDa超滤膜在小流速下较为接近,而随着流速的增加,100 kDa超滤膜的压力增幅较30 kDa超滤膜小。由于膜材料的不同(10 kDa和30 kDa超滤膜的材料为tpye A,而100 kDa超滤膜的材料为tpye C),因此三种膜在膜参数性质上并不成比例关系。
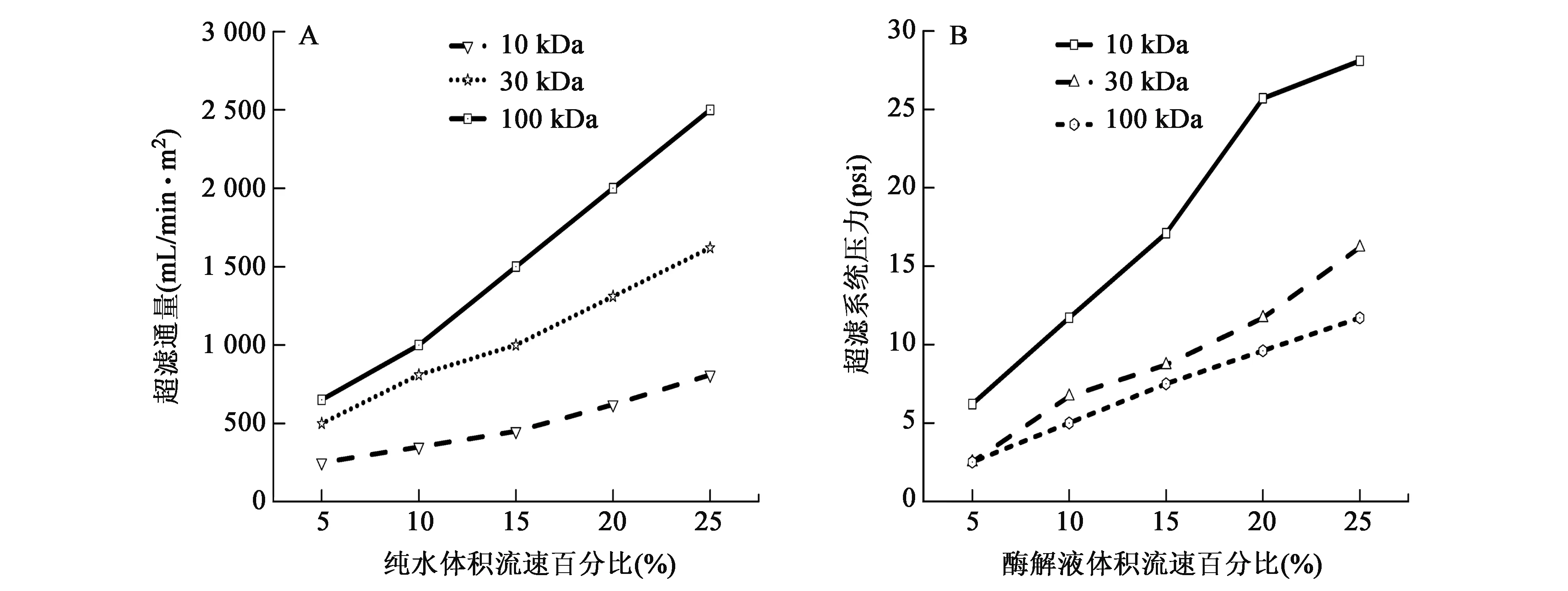
图3 不同分子量超滤膜的膜参数Fig.3 Parameters of ultrafiltration by membranes with different cut-off molecular mass.
2.4 料液体积流量对超滤通量及超滤压力的影响
在料液浓度、超滤时间、浓缩倍数等相同的条件下,研究了料液体积流量对膜通量及压力的影响,结果如图4所示。
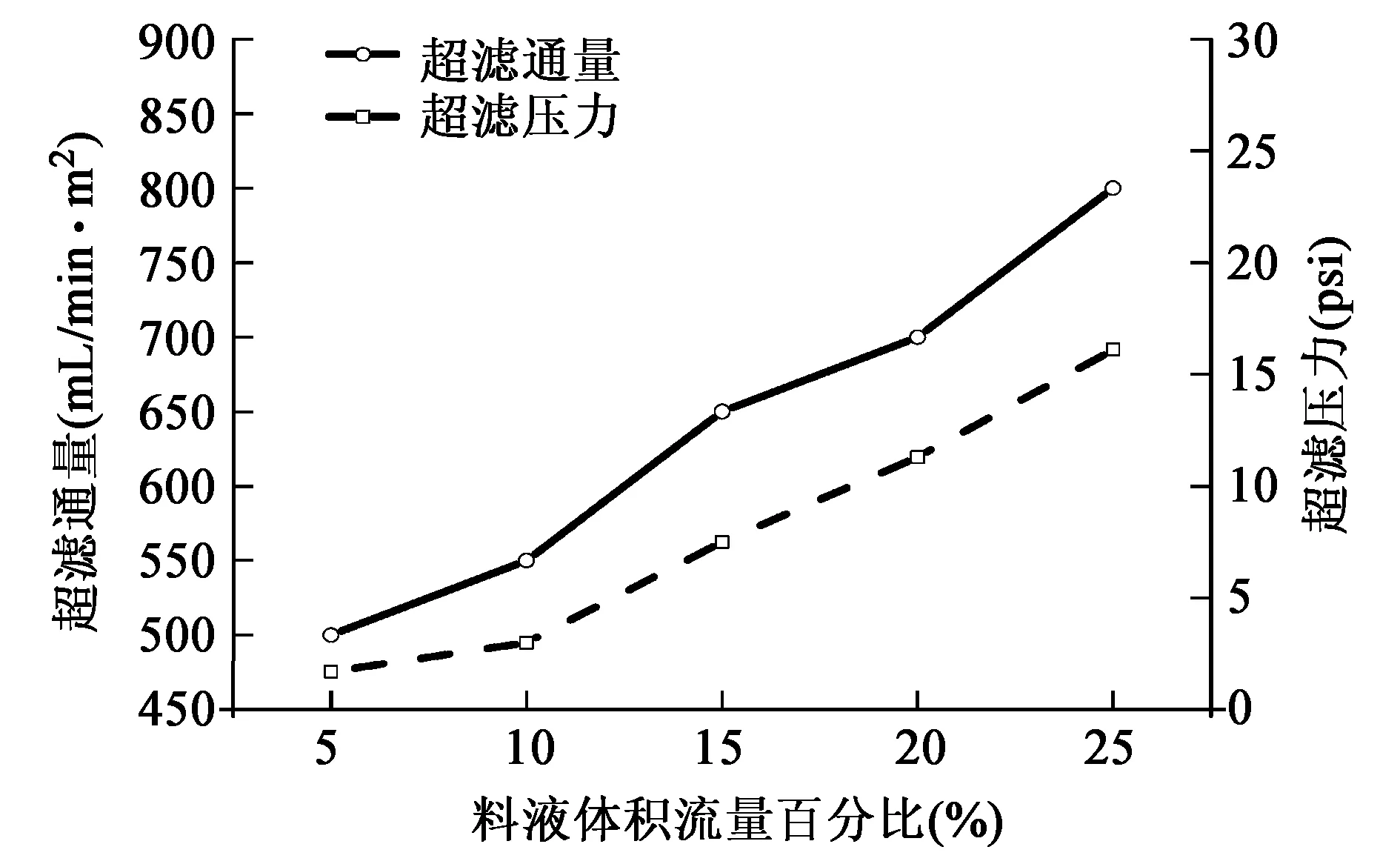
图4 料液体积流速对超滤性能的影响Fig.4 Effect of flow rate on the ultrafiltration performance.
料液体积流量对超滤通量的影响,主要是由体积流量的增大,料液流动状态发生变化所致。随着料液体积流量的增加,增大了流体主体湍流程度,减弱了膜面凝胶层和流动边界层厚度,使浓差极化现象减弱,超滤通量增加并趋于稳定[21]。料液体积流量对超滤压力的影响,主要是随着体积流量的增大,料液即时浓度的增大。当单位时间内流体中大分子物质含量越高,则超滤压力越大。如图4所示,当体积流量不断增加,虽然超滤通量不断增长,但随之超滤压力也不断上升。实验中,由于超滤膜的压力承受能力不高于30 psi,因此根据图4,选择20%泵速(500 mL/min)的料液体积流量,即100 mL/min。
2.5 超滤时间对超滤通量及超滤压力的影响
在料液浓度、料液体积流量、浓缩倍数等相同的条件下,研究了超滤时间对膜通量及压力的影响,结果如图5所示。
对于高分子溶液,在一定的超滤压力下,随着凝胶层厚度的增加,超滤通量会不断减少。如图5所示,本实验的超滤通量-超滤时间的关系基本符合这一规律。在超滤运行的初期,因为膜表面无其他物质,阻力较小,因此超滤通量维持较稳定状态;随着超滤的不断进行,在膜表面迅速吸附有机胶体等物质,超滤通量下降较快[21,22]。综合考虑超滤通量及压力,试验选择两条曲线交点的时间,即超滤时间60 min。
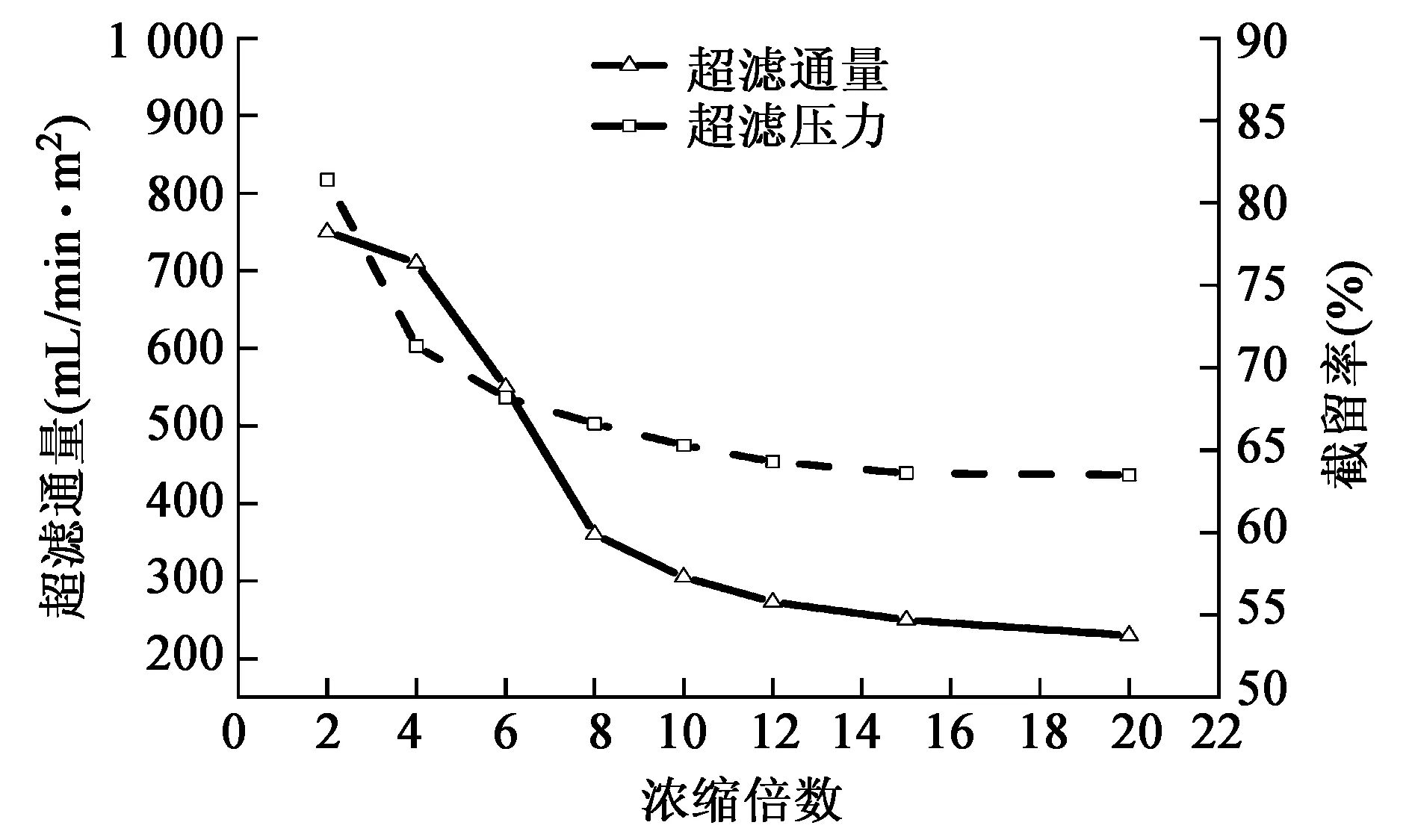
图5 超滤时间对超滤性能的影响Fig.5 Effect of time on ultrafiltration performance.
2.6 浓缩倍数对超滤分离性能的影响
在料液浓度、料液体积流量、超滤时间等相同的条件下,研究了浓缩倍数对膜通量及压力的影响,结果如图6所示。
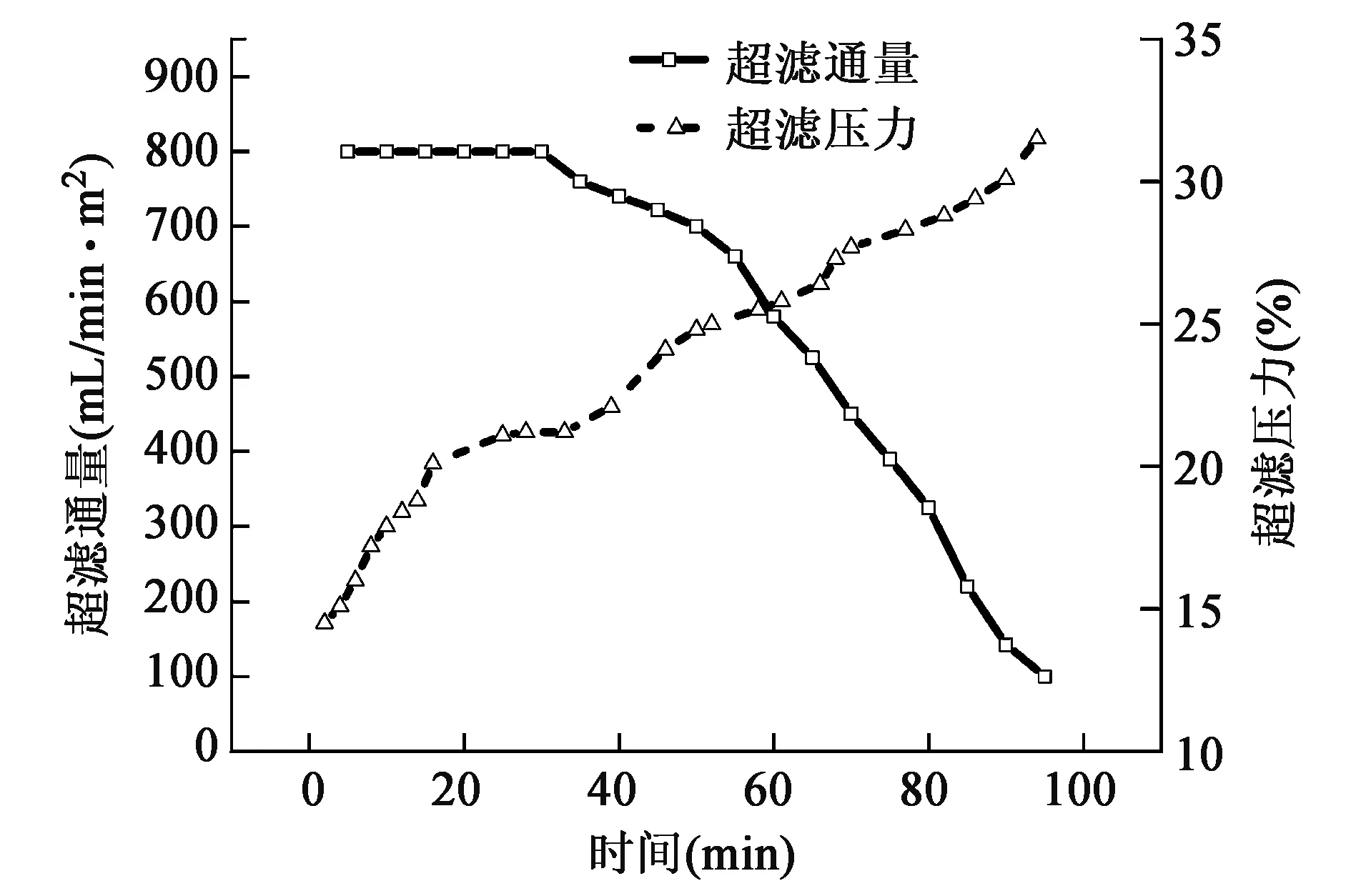
图6 浓缩倍数对超滤性能的影响Fig.6 Effect of concentration multiple on ultrafiltration performance.
超滤通量曲线显示,在浓缩倍数为2~8倍时,通量下降较为显著,10倍以后逐渐趋于稳定状态。一方面随着浓缩倍数的增加,膜表面的凝胶层形成加快及传质层增厚,产生浓差极化现象,使得膜面污染加重[21~23];此外,料液中溶质含量的增加引起渗透压增加,这两者均导致超滤通量迅速下降。截留率曲线显示了浓缩倍数对其影响,可以看到在浓缩倍数为2~6倍期间,多糖截留率迅速下降,而当浓缩倍数达到8~10倍后多糖截留率已趋于稳定。从生产效率和工艺要求上来考虑,适当的浓缩倍数,可以减少膜形成不可逆的凝胶层,便于清洗和下一阶段的醇沉工艺[21]。因此,综上所述,浓缩倍数为15~17倍时较为合适。
考察了三个参数对超滤通量、超滤压力及超滤分离性能的影响,得到了100 kDa超滤膜适宜的工艺参数为:室温,压力小于30 psi,料液体积流量100 mL/min,超滤时间60 min,浓缩倍数为15~17倍,此条件下多糖截留率为63.32%,蛋白质去除率为82.21%。
2.7 不同方法脱除灵芝子实体多糖蛋白质结果
实验研究比较了超滤耦合径向流色谱法与单一色谱法方法及Sevag法脱除蛋白质的效果,分别从蛋白质脱除率及多糖回收率两方面综合评价,结果如表1所示。
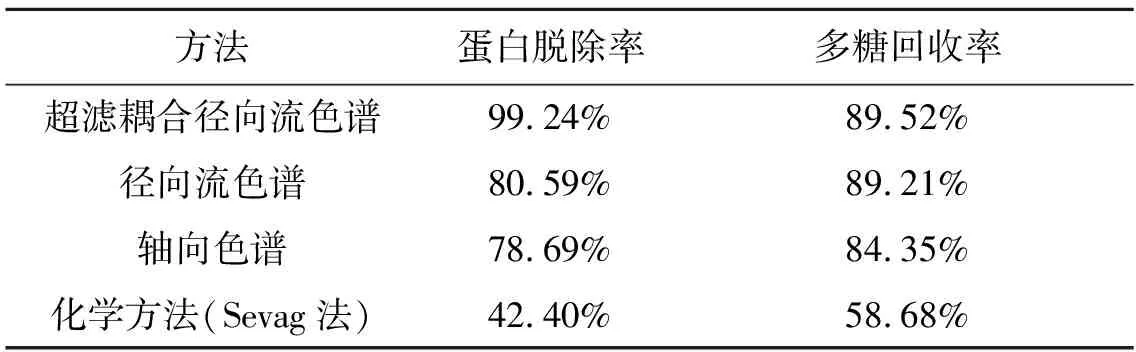
表1 不同方法脱除灵芝子实体多糖蛋白质试验结果比较Table 1 Comparison of different protein removal methods.
从表1中可以看出,超滤耦合径向流色谱脱除灵芝粗多糖中的蛋白质有显著效果,基本实现了完全脱除。单独使用径向流色谱脱除酶解液中的蛋白质,脱除率仅为80.59%;而同传统化学方法相比,蛋白脱除率与多糖回收率分别高出56.84%和30.84%;与轴向色谱比较,蛋白质脱除率提高了25%,而多糖回收率基本一致。
3 讨论
具有生理活性的多糖分子量一般较高(>10 kDa)[24,25],灵芝子实体酶解液中分子量10 kDa以下的多糖含量为19.96%,10~100 kDa之间的多糖含量仅有16.72%,酶解液多糖以分子量10010 kDa以上为主。本研究中,100 kDa超滤膜的多糖截留率约为63.32%,蛋白去除率可达82.21%,且在超滤通量及超滤压力等膜参数上均优于10 kDa和30 kDa超滤膜。因此,在综合考虑实验工作效率等的基础上,选择100 kDa超滤膜进行研究,而对分子量小于100 kDa的多糖暂不研究。
采用截留分子量为100 kDa的超滤膜对灵芝多糖酶解液中的蛋白质进行脱除,合适的工艺条件为:室温,压力小于30 psi,料液体积流量100 mL/min,超滤时间60 min,浓缩倍数为15~17倍,截留液通过超滤和径向流色谱纯化,无需经过醇沉工艺,即可达到高蛋白脱除率及多糖截留率。采用该耦合法,蛋白质脱除率及多糖截留率分别高达99.24%和89.52%,相比单一色谱法及Sevag法,明显改善了多糖中的蛋白质脱除效果及得率的提高。
参 考 文 献
[1] Russell R, Paterson M.Ganoderma-A therapeutic fungal biofactory[J]. Phytochemistry,2006, 67(18):1985-2001.
[2] Chan W K, Cheung C C H, Law H K W,etal..Ganodermalucidumpolysaccharides can induce human monocytic leukemia cells into dendritic cells with immuno-stimulatory function [J].J. Hematol. Oncol., 2008,1:9.
[3] Seto S W, Lam T Y, Tam H L,etal.. Novel hypoglycemic effects ofGanodermalucidumwater-extract in obese/diabetc (db/db) mice[J]. Phytomedicine, 2009, 16: 426-436.
[4] Hsu S C, Ou C C, Chuang T C,etal..Ganodermatsugaeextract inhibits expression of epidermal growth factor receptor and angiogenesis in human epidermoid carcinoma cells:invitroandinvivo[J]. Cancer Lett., 2009, 281(1): 108-116.
[5] Yuen J W, Gohel M D. Anticancer effects ofGanodermalucidum: a review of scientific evidence[J]. Nutr. Cancer, 2005, 53(1): 11-17.
[6] 程俊文,吴学谦,贺 亮,等.香菇子实体多糖分步酶解法提取研究[J].食用菌学报,2009, 16(2): 67-71.
[7] 王元凤,金征宇.酶法提取茶多糖工艺的研究[J].江苏农业科学,2005,(3): 122-124.
[8] 刘红梅,李 栋,樊梦丹,等.灰树花多糖的复合酶-微波提取、超滤纯化及生物学评价[J].中草药, 2011,33(4):594-599.
[9] 李 倩,田春芳,刘雯霞,等.超声波复合酶法提取软紫草多糖的工艺优化[J].中国现代应用药学, 2012, 29(6):498-503.
[10] 谢红旗.周春山.杜邵龙,等.酶法提取、超滤分离香菇多糖新工艺研究[J].食品科学,2007,28(4):217-219.
[11] 李锦生,傅晓琴,李 冰,等.功能性生物活性物质超滤分离纯化技术的研究现状与进展[J].中国食品学报, 2010,10(2): 174-179.
[12] Sun H J, Qi D, Xu J Y,etal.. Fractionation of polysaccharides from rapeseed by ultrafiltration: effect of molecular pore size and operation conditions on the membrane performance[J]. Sep. Purifi.Technol.,2011,80: 670-676.
[13] 陈 余. 膜分离技术在中药提取分离中的应用[J].化学工程与装备,2013,(2):126-128.
[14] Toussain G, Ding L H, Jaffrin M Y,etal.. Recover of alpha agarase enzyme from fermentation broths by membrane crossflow filtration [J].Sep. Sci. Technol.,2000,35(5): 795-809.
[15] Li H F, Li Z W, Xiong S Q,etal.. Pilot-scale isolation of bioactive extracellular polymeric substances from cell-freemedia of mass microalgal cultures using tangential-flow ultrafiltration [J]. Process Biochem.,2011,46: 1104-1109.
[16] 肖如武, 赵谋明.蓝蛤蛋白酶解液超滤分离特性的研究[J].食品与发酵工业,2010,36(5): 23-27.
[17] 张 宁,彭志英.中空纤维超滤膜浓缩胞外多糖PS-9415发酵液的研究[J].食品工业与科技,2003,24(2): 24-27.
[18] 林炳谊.径向流色谱过程动力学模型的建立及其在灵芝多糖分离纯化中的应用研究[D].杭州:浙江工业大学,硕士学位论文,2011.
[19] Monobe M, Ema K, Kato F,etal.. Immunostimulating activity of a crude polysaccharide derived from green tea (Camelliasinensis) extract[J].Agric. Food Chem.,2008,56(4): 1423-1427.
[20] Lowry O H, Rosebrough N J, Farr A L,etal.. Protein measurement with the Folin-Phenol reagents [J]. J. Biol. Chem.,1951, 193: 265-275.
[21] 杨 宁,赵谋明,崔春等. 仙人掌多糖的超滤膜分离提取及其影响因素[J]. 华南理工大学学报:自然科学版,2007,35(4): 42-45.
[22] 李 琳,朱 杰,傅晓琴,等.中试超滤系统浓缩分离南瓜多糖[J].食品科学,2009,30(22): 33-36.
[23] 孙 瑜,周永传,陈德煦.超滤法纯化大黄多糖的研究[J].中国中药杂志,2009,34(2): 165-168.
[24] Suarez E R, Syvitski R, Kralovec J A,etal.. Immunostimulatory polysaccharides fromChlorellapyrenoidosa. A new galactofuranan. measurement of molecular weight and molecular weight dispersion by DOSY NMR[J]. Biomacromolecules, 2006,7(8):2368-2376.
[25] Qiu T, Ma X J, Ye M,etal.. Purification, structure, lipid lowering and liver protecting effects of polysaccharide fromLachnumYM281[J]. Carbohydr. Polym., 2013,98: 922-930.

