固体发酵裂褶多糖免疫调节及抗肿瘤活性研究
钟 葵, 佟立涛, 刘丽娅, 周闲容, 钟 昕, 周素梅
中国农业科学院农产品加工研究所, 北京 100193
裂褶多糖(schizophyllan,SPG)是药用真菌裂褶菌(SchizophyllumcommuneFries)发酵产生的一种功能性葡聚糖,具有良好免疫调节和抗肿瘤活性[1]。研究表明SPG能增加迟发型皮肤过敏反应、提高小鼠脾淋巴细胞增殖反应和抗羊红细胞抗体数量,活化巨噬细胞和NK细胞活性,提高肝癌小鼠TNF-和IL-2含量,提升细胞免疫功能[2~4]。此外,SPG能通过增强机体免疫功能达到杀死或抑制肿瘤细胞的效果,对实验小鼠S180腹水瘤和实体瘤、Lewis肺癌等均表现出良好肿瘤抑制活性[5,6]。在日本,SPG已作为一种抗肿瘤辅助药品(西佐糖,Sizofiran)应用于临床,证实能够活化巨噬细胞和NK细胞活性,结合其他抗癌药物能有效延长胃癌和肺癌患者生命,与放疗结合能提高Ⅱ、Ⅲ期子宫颈癌的免疫功效[7]。
目前关于裂褶多糖生物学活性的研究是基于裂褶菌子实体和深层培养的培养液中提取的SPG展开的,而固体发酵制备的SPG生物学活性尚未明确。我国是农业生产大国,每年产生2 000万余t麦麸和4 000万余t玉米芯,这些资源大部分被作为饲料或者直接废弃、燃烧,造成资源浪费,并对环境造成压力。而采用麦麸和玉米芯等农副产品资源为原料固体发酵生产裂褶多糖,多糖得率高(>9%),原料成本低廉,经济和社会效益良好[8,9]。因此,采用小麦麸皮和玉米芯等农副产品资源固体发酵生产SPG,将废弃物转化为经济附加值高的多糖产品,具有良好经济和环境效益。
固体发酵制备SPG分子量较大(106~107Da),黏度高,溶解性较差,严重影响其应用,同时有报道表明大分子量SPG用于临床注射治疗时易出现肌肉疼痛和血栓等不良反应[9]。本研究采用辐照方法处理天然固体发酵制备的SPG,降解其分子量,研究天然SPG和辐照后SPG(irradiated schizophyllan,ISPG)两种裂褶多糖对体内免疫调节活性和抗肿瘤活性影响,为固体发酵制备SPG的产业化应用提供理论数据支撑,旨在推动其在保健食品和医药产业上应用。
1 材料与方法
1.1 试验菌种
裂褶菌(SchizophyllumcommuneFr.),购于中国农业科学院资源区划研究所,菌种编号为ACCC51174(来源于东北)。
1.2 原料和试剂
试验动物ICR小鼠(雄性,体重18~22 g)和豚鼠、绵羊血红细胞(SRBC)和S180肿瘤细胞均购于医学部实验动物中心;鸡血红细胞购于中国农业大学动物医学院;医药级香菇多糖购于山西泰盛制药有限公司;胎牛血清购于杭州四季青公司;其他常用化学试剂购于北京化学试剂公司(分析纯)。
1.3 主要仪器
电热恒温水箱,北京市长风仪器仪表公司;Lgbofuge 400R低温离心机,德国Thermo电子有限公司;TDL80-2B台式离心机,上海安亭科学仪器厂;DL-CI医用型洁净工作台,北京东联哈尔仪器制造有限公司;NAPCO恒温孵育箱,法国Jouang公司;正置荧光显微镜,德国Leica公司;CASY-TT细胞分析计数仪,德国Roche Innovatis AG公司;微孔板扫描酶标仪,美国BioTek公司;150 mm游标卡尺,台州市航宇工量刃具有限公司;XB-K-25血细胞计数仪,上海医用光学仪器厂;1815TC型二氧化碳培养箱,美国Shellab公司。
1.4 裂褶多糖SPG和ISPG制备
裂褶菌菌种在PDA试管斜面上27℃培养7 d,转接液体种子培养基,27℃、160 r/min培养48 h后,按5 mL/100g(V/W)接种到固体发酵培养基(麦麸∶玉米芯粉=2∶8,水分含量50%),27℃培养7~8 d,完成发酵。固体发酵菌块于60℃烘干6 h,粉碎后按料水比1∶20配成水溶液,80℃热水浴振荡提取1 h,4 200 r/min离心20 min,取上清液,3倍体积乙醇沉淀过夜,过滤取沉淀;60℃烘干得到目标多糖SPG[9]。10 kGy60Co辐照,得到目标多糖ISPG[8]。
SPG和ISPG纯度测定为78.25%±2.33%(干基计)。
1.5 裂褶多糖SPG和ISPG分子量测定
按照钟昕[8]方法测定裂褶多糖的重均分子量(Mw)、数均分子量(Mn)和分散系数(Mw/Mn)。采用Astra软件进行数据分析。
1.6 裂褶多糖SPG和ISPG免疫调节及抗肿瘤活性测定
1.6.1S180肿瘤细胞活化和动物模型建立 用生理盐水将S180肿瘤细胞调为浓度3×106个/mL,腹腔接种于小鼠体内,注射量为0.2 mL/只,饲养7 d进行传代。无菌条件下取接种S180细胞的小鼠腹水,加无菌生理盐水稀释,调节细胞浓度为4.5×106个/mL,于小鼠右前肢腋下进行无菌皮下接种,接种量为0.2 mL肿瘤细胞悬液。从取出腹水到接种完毕,时间控制2 h以内[10]。
1.6.2实验动物给药方式 建模成功的小鼠随机分为8组,每组10只,分别为模型组、阳性对照组、SPG样品组和ISPG样品组。两个样品组均设置高、中、低三个剂量,分别为1号(200 mg/kg体重·d)、2号(100 mg/kg体重·d)和3号(50 mg/kg体重·d)。模型组给予相同体积的蒸馏水,阳性对照组腹腔注射香菇多糖0.2 mg/kg,每2 d给药1次,给药时间为30 d。
1.7 疗效评价
1.7.1体重增加测定 计算公式如下:

1.7.2羊血红细胞(SRBC)诱导小鼠迟发型变态反应(DTH)测定 通过向给药小鼠注射SRBC致敏,测定迟发型变态反应情况。第一次注射在给药第5 d,按0.2 mL/只腹腔注射2%(V/V)SRBC。第二次注射为4 d后,测量小鼠左后足趾部厚度,并在测量部位按20 μL/只皮下注射20%(V/V)SRBC,24 h后用再次测量小鼠左后足趾部厚度,同一部位测定3次,取平均值。DTH值及处理前后足趾厚度差值。当受试样品组显著高于对照组时,判定实验结果阳性。
1.7.3脾细胞介导羊红细胞定量溶血分光度实验(QHS) 按照钟昕[8]方法,分别制备补体、SRBC悬液和脾细胞悬液。将0.25 mL SRBC,0.25 mL脾细胞悬液和0.25 mL补体混合,37℃反应60 min,3 000 r/min离心3 min,吸取上清测定413 nm吸光值。空白对照用生理盐水代替补体。
1.7.4小鼠腹腔巨噬细胞吞噬鸡血红细胞(CRBC)测定 按照Yang等[11]方法,通过向小鼠注射SRBC激活巨噬细胞,并在处死小鼠后,分离腹腔巨噬细胞,与鸡血红细胞(CRBC)悬液混合孵育,在载玻片上固定病染色后观察计数。计100个细胞,其中巨噬细胞的个数即为巨噬细胞百分率。受试样品组的巨噬细胞百分率与对照组比较,差异有显著性,方可判定该项实验结果阳性。
1.7.5抑瘤率测定实验 荷瘤小鼠给药30 d后,停药24 h颈椎脱臼处死,固定于手术蜡板上,将小鼠右前肢腋下肿瘤剖出,称量肿瘤重量并计算肿瘤抑制率,计算公式为:
肿瘤抑制率(%)=
1.8 数据分析
数据分析采用t检验方法, 显著性水平为P<0.05。整个数据处理采用SPSS 9.0软件,制图采用OriginPro 7.5。
2 结果与分析
2.1 裂褶多糖SPG和ISPG分子量测定
采用GPC-LLS联用技术测定SPG和ISPG重均分子量(Mw)和数均分子量(Mn),结果如表1所示。天然SPG和辐照处理后ISPG样品均含有3个级分,但两者分子量差异较大。SPG分子量在106~107Da之间,其中Mw为4.65×107Da的级分含量最高,质量百分比为55.5%;其他两个级分分子量较低,分别为8.43×106Da和3.56×106Da,质量百分比分别为21.2%和13.5%。10 kGy辐照处理后多糖分子量显著下降,质量百分比最高的级分(60.5%)分子量Mw下降至2.97×105Da;另外两个级分分子量均为104Da左右,分别为4.77×104Da(21.9%)和1.26×104Da(17.6%)。

表1 裂褶多糖分子量分布Table 1 Molecular weight distribution of SPG and ISPG.
2.2 裂褶多糖生物学活性研究
2.2.1小鼠体重变化结果分析 试验期间不同组别S180荷瘤小鼠体重增加结果如图1所示。试验30 d期间,模型组小鼠体重增加了12.37%±1.67%,SPG和ISPG不同剂量组体重增加与模型组没有显著差异,香菇多糖组体重平均增加13.99%±1.33%,与模型组体重增加差异不显著(P>0.05)。因此,试验期间各组别之间小鼠体重增加均没有显著差异(P>0.05)。
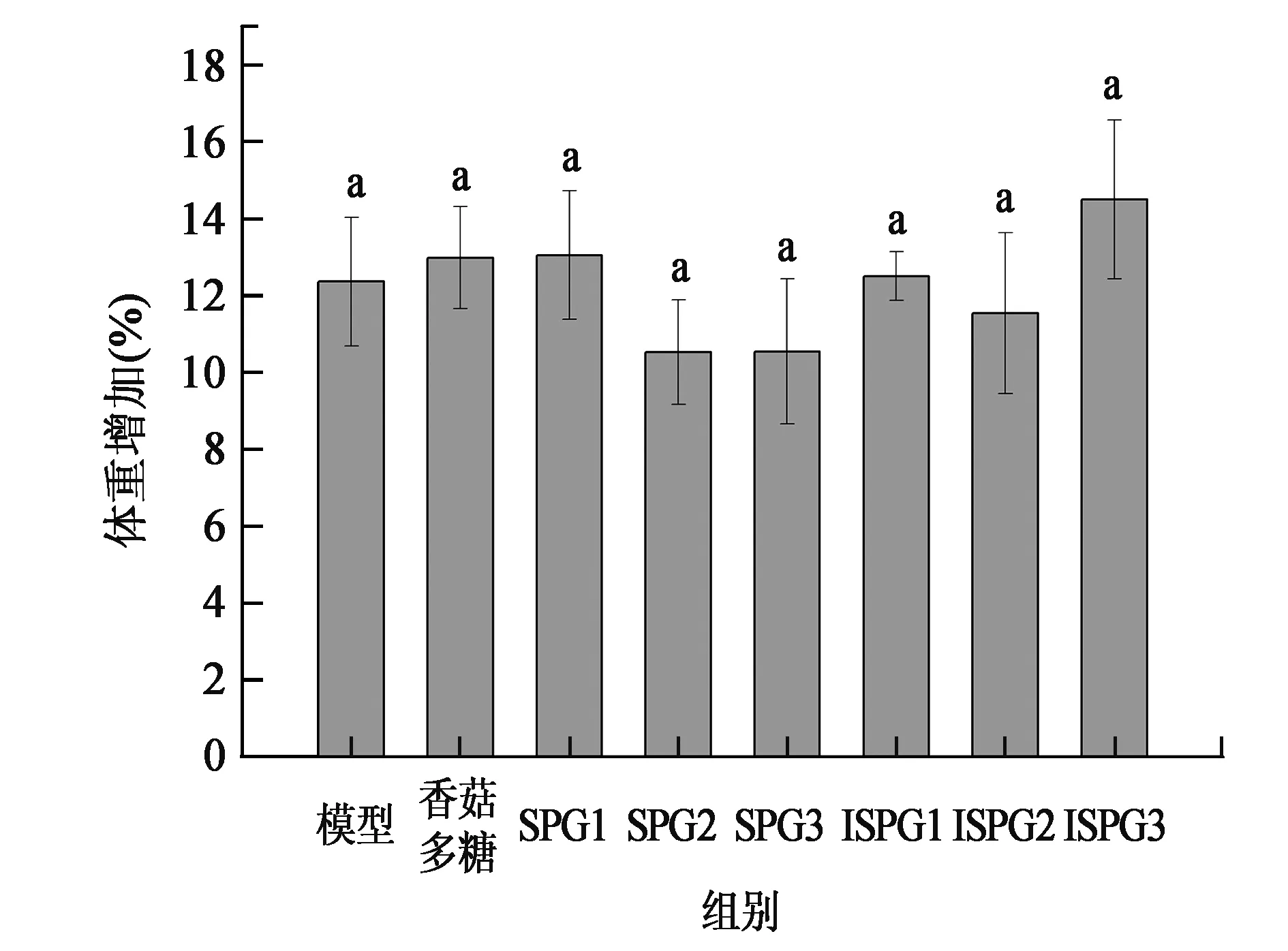
图1 裂褶多糖SPG和ISPG对S180荷瘤小鼠体重增加影响Fig.1 Effect of SPG and ISPG on weight gain of S180 tumor mice.注:SPG1/ISPG1:高剂量组200 mg/kg体重·d;SPG2/ISPG2:中剂量组100 mg/kg体重·d;SPG3/ISPG3:低剂量组50 mg/kg体重·d。不同小写字母代表差异显著(P<0.05)
2.2.2裂褶多糖对S180荷瘤小鼠羊血红细胞诱导小鼠迟发型变态反应(DTH)影响研究 DTH反应是由抗原诱导特异性T细胞激活并产生多种炎性细胞因子,介导以单个核细胞浸润和组织细胞损伤为主要特征的局部炎症反应[12]。SRBC可刺激T淋巴细胞增殖成致敏淋巴细胞, 4天后再以SRBC对小鼠足趾部细胞进行攻击时,该部位出现肿胀,且肿胀程度可反映细胞免疫功能增强程度[13]。图2是裂褶多糖SPG和ISPG对S180荷瘤小鼠SRBC诱导迟发型变态反应(DTH)的影响。由图可见,模型组的足趾肿胀度仅为0.33±0.05 mm,香菇多糖组和实验多糖组处理后小鼠足趾肿胀度均显著提高(P<0.05)。SPG三个剂量处理后小鼠足趾肿胀度均显著高于模型组(P<0.05),其中低剂量组(SPG3)足趾肿胀度最高(0.56±0.05 mm),但与中和低剂量组差异不显著(P>0.05)。ISPG中和低剂量处理组足趾肿胀度显著高于模型组(P<0.05),但高剂量组(0.40±0.08 mm)与模型组之间没有显著差异(P>0.05)。对照香菇多糖组小鼠足趾肿胀度为0.51±0.06 mm,显著高于模型组(P<0.05),但与SPG和ISPG各剂量组没有显著差异(P>0.05)。
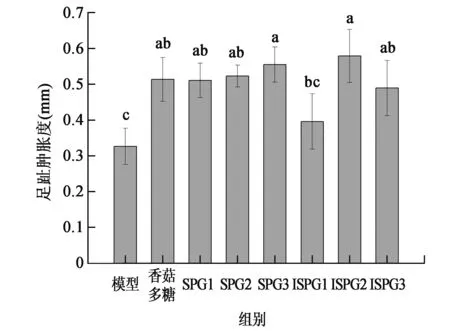
图2 裂褶多糖SPG和ISPG对S180荷瘤小鼠迟发型变态反应(DTH)影响Fig.2 Effect of SPG and ISPG on delayed type hypersensitivity(DTH)of S180 tumor mice.注:SPG1/ISPG1:高剂量组200 mg/kg体重·d;SPG2/ISPG2:中剂量组100 mg/kg体重·d;SPG3/ISPG3:低剂量组50 mg/kg体重·d。不同小写字母代表差异显著(P<0.05)
2.2.3裂褶多糖对S180荷瘤小鼠脾细胞介导羊红细胞定量溶血分光度影响研究 QHS值反映机体体液特异性免疫性能,数值越高表明机体免疫力越强。SPG和ISPG对S180荷瘤小鼠QHS值结果如图3所示。空白模型组QHS值为0.83±0.04,香菇多糖和裂褶多糖组的QHS值显著提高(P<0.05)。除SPG高剂量组外,SPG中和低剂量组、ISPG三个剂量组QHS值均显著高于模型组(P<0.05);其中ISPG中剂量组QHS值最高,达到1.06±0.14,但不同组别之间QHS值差异不显著(P>0.05)。对照香菇多糖组QHS值(1.03±0.06)显著高于模型组(P<0.05),但与SPG中和低剂量组、ISPG三个剂量组之间没有显著差异(P>0.05)。试验结果表明,SPG和ISPG均能显著提高小鼠体液特异性免疫性能。

图3 裂褶多糖SPG和ISPG对S180荷瘤小鼠脾细胞介导羊红细胞(QHS)影响Fig.3 Effect of SPG and ISPG on Spleen cell-mediated quantitative hemolysis spectrophotometry (QHS) of the S180 tumor mice.注:SPG1/ISPG1:高剂量组200 mg/kg体重·d;SPG2/ISPG2:中剂量组100 mg/kg体重·d;SPG3/ISPG3:低剂量组50 mg/kg体重·d。不同小写字母代表差异显著(P<0.05)
2.2.4裂褶多糖对S180荷瘤小鼠腹腔巨噬细胞吞噬鸡血红细胞影响研究 巨噬细胞(MФ)是具有多种功能的重要免疫细胞,通过处理抗原和释放可溶性因子达到调节免疫效果。激活的巨噬细胞不仅参与特异性和非特异性免疫反应,同时也是两种免疫反应的“桥梁细胞”[14]。裂褶多糖SPG和ISPG对S180荷瘤小鼠的腹腔巨噬细胞鸡血红细胞试验结果如图4所示。模型组小鼠腹腔巨噬细胞吞噬鸡红细胞百分比13.00%±0.91%,SPG三个剂量组的吞噬效果与模型组没有显著差异(P>0.05);ISPG中剂量组能显著增强小鼠腹腔巨噬细胞吞噬鸡红细胞(P<0.05)吞噬百分比达到18.33%±0.58%,但低剂量和高剂量组吞噬效果与模型组没有显著差异(P>0.05)。香菇多糖组吞噬鸡红细胞效果显著高于模型组(18.67±2.07%),但与ISPG中剂量组差异不显著(P>0.05)。试验结果表明,ISPG能显著增强小鼠的非特异性免疫功能。
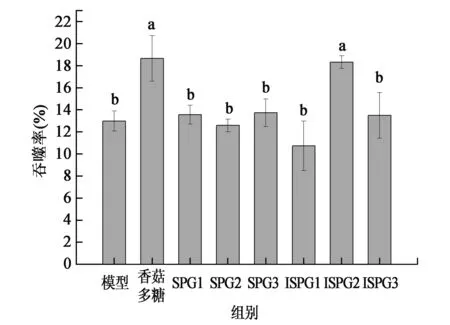
图4 裂褶多糖SPG和ISPG对S180荷瘤小鼠腹腔巨噬细胞吞噬鸡红血细胞影响Fig.4 Effect of SPG and ISPG on phagocytosis of macrophage test of the S180 tumor mice.注:SPG1/ISPG1:高剂量组200 mg/kg体重·d;SPG2/ISPG2:中剂量组100 mg/kg体重·d;SPG3/ISPG3:低剂量组50 mg/kg体重·d。不同小写字母代表差异显著(P<0.05)
2.2.5裂褶多糖对S180荷瘤小鼠肿瘤抑制效果影响研究 裂褶多糖对S180荷瘤小鼠肿瘤抑制效果如图5所示,SPG和ISPG均对S180荷瘤小鼠有良好的肿瘤抑制效果,抑瘤率达45%以上。不同剂量组之间抑瘤率差异显著,ISPG中剂量组抑瘤率最高(74.80%±6.83%),显著高于ISPG高剂量组和SPG高、中剂量组(P<0.05),但与ISPG低剂量组和SPG低剂量组差异不显著(P>0.05);ISPG高剂量组抑瘤率最低,为45.76%±5.09%。对照香菇多糖抑瘤率为52.17%±5.10%,显著低于SPG低剂量组和ISPG中、低剂量组(P<0.05),但与ISPG高剂量组和SPG高和中剂量组差异不显著(P>0.05)。
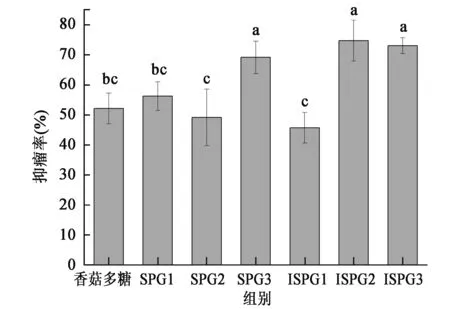
图5 裂褶多糖对S-180荷瘤小鼠的肿瘤抑制率Fig.5 Antitumor inhibition of SPG and ISPG in S180 tumor mice.注:SPG1/ISPG1:高剂量组200 mg/kg体重·d;SPG2/ISPG2:中剂量组100 mg/kg体重·d;SPG3/ISPG3:低剂量组50 mg/kg体重·d。不同小写字母代表差异显著(P<0.05)
3 讨论
天然SPG样品含有三个级分,分子量在106~107Da之间,其中以4.65×107Da的级分含量最高,质量百分比为55.5%;其他两个级分分子量分别为8.43×106Da和3.56×106Da,质量百分比分别为21.2%和13.5%。10 kGy辐照处理后的ISPG分子量显著降低,质量百分比最高级分(60.5%)的分子量下降至2.97×105Da;另两个级分分子量分别为4.770×104Da(21.9%)和1.261×104Da(17.6%)。说明辐照能有效降低固体发酵制备裂褶菌多糖分子量。
相对模型组,样品各剂量组均对小鼠体重没有显著性影响;SPG和ISPG中(100 mg/kg体重·d)和低剂量(50 mg/kg体重·d)组均能显著增强S180荷瘤小鼠DTH反应,提高荷瘤小鼠体液特异性免疫性能(QGS值);ISGP中剂量组(100 mg/kg体重·d)能显著增强小鼠巨噬细胞吞噬鸡红细胞效果,提升小鼠非特异性免疫功能。SPG和ISPG均对S180荷瘤小鼠均具有良好的肿瘤抑制效果,ISPG中剂量组(100 mg/kg体重·d)抑瘤率最高(74.80%±6.83%),ISPG低剂量组和SPG低剂量组抑瘤率均在70%左右,显著高于阳性对照香菇多糖组(52.17%±5.10%)。总体看来,辐照处理后的ISPG比天然SPG具有更好的免疫调节及抗肿瘤活性。
参 考 文 献
[1] Sutivisedsak N, Leathersa T D, Bischoff K M,etal.. Novel sources of β-glucanase for the enzymatic degradation of schizophyllan[J]. Enzyme Microbial Technol., 2013, 52: 203-210.
[2] Rau U, Vandamme E J, Baets S De,etal.. Polysaccharides II: polysaccharides from eukaryotes [M]. Weinheim, Germany: Wiley-VCH,2002, 61-91.
[3] Kubala L, Ruzickova J, Nickova K,etal.. The effect of (1,3)-β-D-glucans, carboxymethylglucan and schizophyllan on human leukocytes invitro[J]. Carbohydr. Res., 2003, 338:2835-2840.
[4] Schulz D, Rau U, Wagner F. Characteristics of films prepared from native and modified branched 1,3-β-glucans [J]. Carbohydr. Res., 1992, 18: 295-299.
[5] Bot A, Smorenburg H E, Vreeker R,etal.. Melting behavior of schizophyllan extracellular polysaccharide gels in the temperature range between 5 and 20℃ [J]. Carbohydr. Polym., 2001, 45: 363-372.
[6] Rau U. Production of schizophyllan. In: Bucke C (Eds.), Methods in biotechnology Vol. 10. Carbohydrate biotechnology protocols [M]. Totowa: Humana Press, 1999, 43-55.
[7] Ding Y L, Alkan S S, Baschang G,etal.. Synthesis of the HSA-conjugate of the S-linked thiomimetic of the branched tetrasaccharide repeating unit of the immunostimulant polysaccharide, schizophyllan. Evaluation as potential immunomodulator [J]. Carbohydr. Res., 2000, 328(1): 71-76.
[8] 钟 昕. 裂褶菌多糖的固体发酵制备及辐照改性[D]. 北京:中国农业科学院,硕士学位论文,2011.
[9] 陈 聪. 裂褶菌多糖固体发酵制备、提取及性质研究[D]. 北京:中国农业科学院,硕士学位论文,2010.
[10] Wu D D, Gao Y F, Chen L X,etal.. Anti-tumor effects of a novel chimeric peptide on S180 and H22 xenografts bearing nude mice [J]. Peptides, 2010, 5(5): 850-864.
[11] Yang H Y, Liu S L, Ibrahim S A,etal.. Oral administration of live Bifidobacterium substrains isolated from healthy centenarians enhanced immune function in BALB/c mice [J]. Nutr. Res., 2009, 29: 281-289.
[12] Modlin R L. Insights into contemporary immunology from an ancient disease [J]. Skin Pharmacol. Appl. Skin Physiol., 2002, 15: 1-6.
[13] 孙 静, 李玉林, 李一雷. 体内实验研究神经节苷脂对小鼠迟发型变态反应的影响[J]. 中国实验诊断学,2003,10(6):658-660.
[14] Chen X M, Lu J X, Zhang Y D,etal.. Studies of macrophage immuno-modulating activity of polysaccharides isolated fromPaecilomycestenuipes[J]. Int. J. Biol. Macromol., 2008, 43: 252-256.

