HPLC-MS/MS法测定树莓中树莓酮含量的研究
李 斌, 王小杰, 杨 磊, 孟宪军*
1.沈阳农业大学食品学院, 沈阳 110866;2.阜新桃李园集团公司, 辽宁 阜新 123000
树莓是一种蔷薇科植物,其果实中含有的主要芳香类化合物为树莓酮[4-(4-羟基苯基)-2-丁酮,raspberry ketone,RK][1,2],是一种已广泛应用的具有幽香果香的食用香精[3],具有影响脂肪代谢从而抗肥胖的作用[4]。树莓酮是树莓的特征气味成分,其阈值为1~10 μg/L[5,6]。树莓酮属于甲基酮类化合物,与辣椒素结构相似[7],目前,对其生物合成、功能特性及检测方法都有广泛研究[8~10]。树莓酮的测定方法主要有气相色谱法[11,12]和分光光度法[13]。由于树莓酮在树莓中的含量较少,经实际检测发现,这两种方法在测定中并不非常适用,因此需要开发更加灵敏的检测方法。本研究建立了液相色谱-质谱/质谱仪测定方法,灵敏度高,适用于树莓酮的检测。
1 材料与方法
1.1 材料与试剂
树莓果实,干燥后粉碎,过60目筛备用;天然树莓酮,纯度≥99%,购自武汉合中医药原料有限公司;甲醇、乙腈、乙酸乙酯为色谱纯,购自Fisher公司;乙醚、HCl、NaHCO3、NaOH、Na2SO4均为分析纯,购自国药集团化学试剂有限公司。实验室用水为高纯水。
1.2 主要仪器
数控超声波清洗器,KQ-100DB型,昆山市超声波仪器有限公司产品;电热恒温水槽,DKB-8A型,上海精宏实验设备有限公司产品;电热恒温鼓风干燥箱,DHG-9070A型,上海精宏实验设备有限公司产品;旋转蒸发器,RE-52AA型,上海亚荣生化仪器厂产品;三重四级质谱仪,API 4000型,美国应用生物系统公司产品;液相色谱仪,LC 20A型,日本岛津公司产品;旋转蒸发仪、氮吹仪、离心机等。
1.3 方法
1.3.1标准溶液的配制 准确称取树莓酮标准品0. 010 0 g,置于100 mL棕色容量瓶中,甲醇溶解定容,混匀,配制成100 mg/L的标准储备溶液,4℃保存。精密量取树莓酮储备液1 mL置于100 mL棕色容量瓶中,甲醇定容,配制成1 000 μg/L中间溶液,-18℃避光保存。
1.3.2样品前处理 除去树莓果实中的杂质,匀浆后烘干。准确称量树莓果实粗粉20.00 g,包入滤纸中放于提取器内,60℃下甲醇提取4 h后收集提取液。甲醇提取液在50℃以下真空蒸发回收溶剂后,甲醇提取物以1.00 g甲醇提取物加100 mL 10%甲醇的比例溶解,再以乙醚萃取3次(液比1∶3),合并乙醚萃取液,蒸发溶剂得到红棕色油状浸膏1.00 g。
1.3.3树莓酮的提取 树莓提取物浸膏用乙醚溶解后,用1%盐酸提取,所得酸水液经碱化后再用乙醚萃取,除去树莓提取物中碱性成分。将分出碱性成分的乙醚液,再分别用5% NaHCO3和2% NaOH氢氧化钠萃取,所得水溶液分别酸化后用乙醚萃取,除去提取物中的弱酸性成分和酚性成分。将分出碱性、酸性、酚性成分的树莓提取物乙醚液用水洗至中性,以无水Na2SO4干燥后,加NaHCO3饱和溶液,分出水层,加碱液处理,以乙醚萃取,得到提取物中的甲基酮成分[14]。然后用旋转蒸发仪蒸发掉大部分的溶剂,待蒸馏瓶中所剩溶液为2~3 mL时,将其转移出来,再用溶剂冲洗蒸馏瓶,合并溶液,无水Na2SO4脱水,过滤,自然挥发掉溶剂,甲醇定容到5 mL,过0.45 μm的微孔滤膜,密封4℃冷藏,备用。
1.3.4HPLC-MS/MS分析条件 液相色谱条件:色谱柱采用Symmetry C18柱(2.0 mm×50 mm,2 μm)。流动相A 为水,B为甲醇;0~5 min等度洗脱:50%A/50%B。流速为0.25 mL/min,柱温35℃,进样体积25 μL。
质谱条件:电喷雾离子源(ESI);正离子扫描;多反应监测(MRM);电喷雾电压(IS)5 500 V;雾化气压力(GS1)65 Psi;气帘气压力(CUR)10 Psi;辅助气压力(GS2)65 Psi; 离子源温度(TEM)550℃;定性离子对、定量离子对、碰撞气能量(CE)及去簇电压(DP)见表1。
1.3.5标准曲线的制作 取7份树莓空白样品提取液10 mL,加入树莓酮标准储备液配制成浓度为1.0、2.0、10.0、20.0、50.0、100.0和500.0 μg/kg系列样品,以树莓酮峰面积比值A为纵坐标,以树莓酮的质量浓度C为横坐标,加权计算线性回归方程。以信噪比(S/N)为10进行计算,回归方程为:
Y=5.68×105X-3.45×104r=0.998 9

表1 树莓酮的质谱优化参数Table 1 MS/MS parameters for the determination of RK.
2 结果与分析
2.1 色谱条件的优化
不同流动相对树莓酮分子质子化和色谱分离具有一定程度的影响。常用流动相有乙腈-水和甲醇-水。以乙腈-水为流动相时,质谱的信号较低,色谱峰出现拖尾现象;以甲醇-水作为流动相,质谱的信号明显提高,峰形对称。因此本研究选择甲醇-水作为流动相。
为了保证HPLC色谱分析时抑制样品的电离,改善峰形,在流动相甲醇-水中添加不同量的甲酸(0、0.1%、0.3%),并比较了其对质谱信号的影响,结果显示,添加0.1%甲酸时质谱信号最高,随着甲酸添加量加大信号反而降低。推断少量氢离子对树莓酮质子化具有促进作用,但氢离子的浓度过大则表现为抑制作用。所以本实验选择添加0.1%甲酸的甲醇-水作为流动相。
在优化的色谱条件下,树莓酮可以得到良好的分离,其保留时间大约为2 min,峰形对称,无杂峰干扰,见图1。
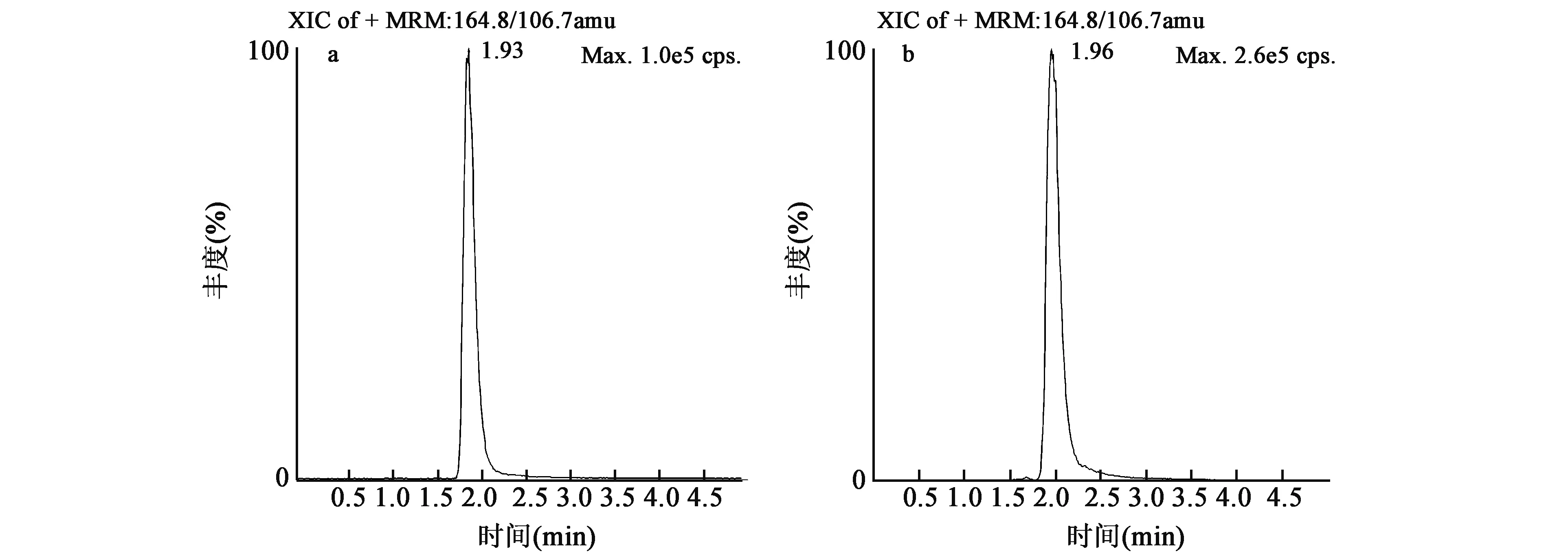
图1 树莓酮的提取离子色谱图Fig.1 XIC of raspberry ketone.a.树莓酮标准品;b.样品
2.2 质谱条件的优化
在流动注射状态下,将1 mg/L树莓酮甲醇溶液在正离子和负离子扫描模式下进行全扫描(+Q1扫描)以选择分子离子峰和电离方式。结果表明,正离子模式下[M+H]+为最强峰m/z 164.8,选择其作为母离子。在二级质谱扫描,通过调节碰撞能(CE)和去簇电压(DP),选择丰度最高,干扰较小的子离子为定量离子m/z 106.7,丰度次之为定性离子m/z 77.0。树莓酮的质谱裂解方式见图2。
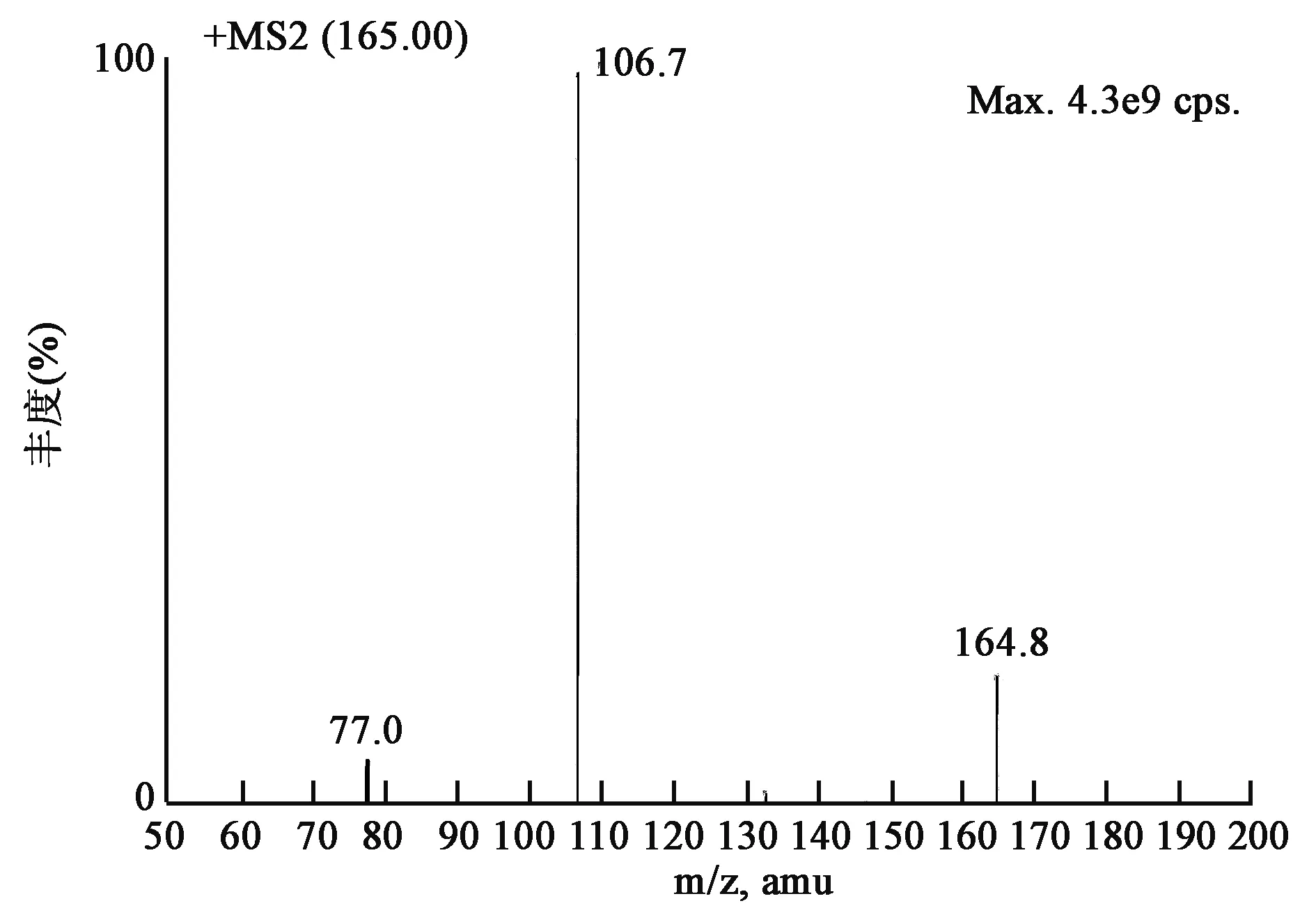
图2 树莓酮的二级质谱扫描图Fig.2 Second order scanning mass spectrogram of raspberry ketone.
2.3 检测定量限及线性范围
不同基质中树莓酮的定量检测限为1.0 μg/kg,在1~500.0 μg/kg范围具有良好线性关系。
2.4 回收率、精密度
分别称取的空白样品20.00 g,添加适量的树莓酮标准溶液,使其浓度为1.0、2.0和10.0 μg/kg,每个浓度进行6样本分析,结果见表2。本方法的回收率为75.4%~82.3%,相对标准偏差为5.97%~8.40%。
2.5 实际样品的测定
超市购买10份树莓样品,经回流提取,串联质谱定量。树莓酮检出率100%,树莓中树莓酮含量范围在71.4~240.0 μg/kg。实际样品的检测结果见表3,树莓中树莓酮的含量在71.4~240 μg/kg范围内不等。
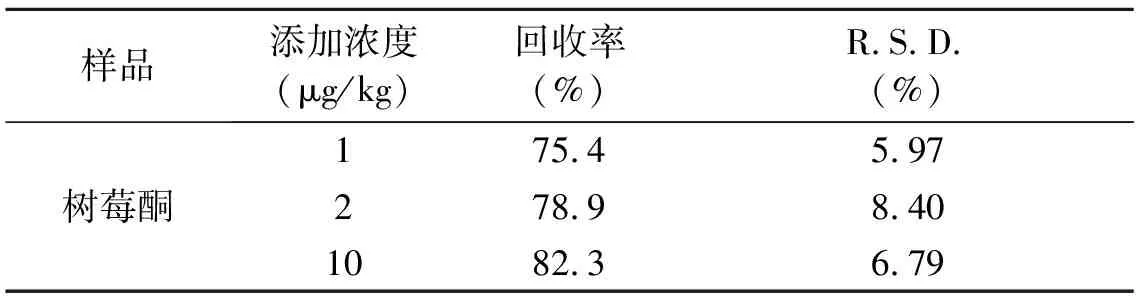
表2 回收率和精密度实验结果Table 2 The experimental results of recovery rate and degree of precision.
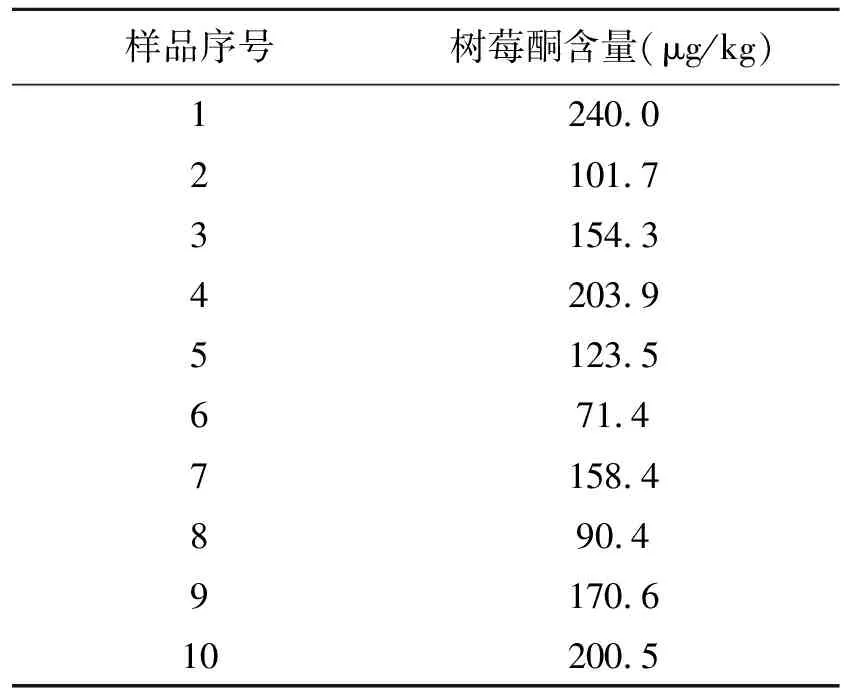
表3 实际样品检测结果Table 3 The detection result of actual samples.
3 讨论
由于树莓中树莓酮含量较低,其检测既要求灵敏度高,还要求样品提取率高。树莓酮不溶于水和石油英,溶于甲醇、乙醚和挥发性油等有机溶液,其中甲醇具有沸点低、对植物细胞穿透能力强和价格低的优点,为实验室常用试剂,它能够溶出树莓果实中除蛋白质果胶淀粉部分多糖外的大部分亲水性物质,而且一些难溶于水的亲脂性成分在甲醇中溶解度也比较大,可以被浸提出来,可以保证树莓果实中的甲基酮成分尽可能全部浸提出来[15]。因此在选择样品的提取溶剂时,考虑到实验的安全性、成本和提取效率,本实验选择甲醇作为提取溶剂。
提取时间和温度对于样品的提取效率影响很大。实验发现,60℃条件下提取,烧瓶内的甲醇溶剂沸腾,溶剂蒸汽进入冷凝管内,冷却后的液态溶剂回滴入提取器中,能够起到温浸的作用,而温度继续升高后,烧瓶内的甲醇溶液剧烈沸腾,提取溶液损失较大,所以选择60℃作为热回流提取温度。热回流提取2 h后,提取筒中提取液颜色较深,说明仍有物质不断地溶解在提取溶液中。提取4 h后提取筒中提取液颜色变得很浅。提取6 h后取筒中提取液颜色与4 h时没有差异,说明果实中的物质已经完全被浸出。经检验热回流提取4 h树莓酮检出量高于提取2 h,但与提取6 h后的树莓酮检出量相比较差异不大,所以本研究选择4 h作为提取时间。
本研究建立了树莓中树莓酮含量检测的高效液相色谱-串联质谱(HPLC-MS/MS)分析方法。不同基质中树莓酮的定量检测限达到1.0 μg/kg,回收率为75.4%~82.3%,相对标准偏差为5.97%~8.40%。本方法分析速度快,灵敏度高,重现性好,可用于树莓中树莓酮的检测。
参 考 文 献
[1] Gallois A. Quantitative evaluation of raspberry ketone using thin-layer chromatography[J]. Sciences des Aliments, 1982, 2:99-106.
[2] Vereshchagin P V, Bezzubov A A. The composition of raspberry essential oils[J]. Appl. Biochem. Microbiol., 1981,17:53-57.
[3] Guichard E. Identification of the flavoured volatile components of the raspberry cultivar Lloyd george [J]. Sciences des Aliments, 1982, 2:173-185.
[4] Beekwilder J, van der Meer I M, Sibbesen O,etal.. Microbial production of natural raspberry ketone[J]. Biotechnol. J., 2007, 2(10):1270-1279.
[5] Larsen M, Poll L. Odour thresholds of someimportant aroma compounds in raspberries[J]. Z. LebensmUnters. Forsch., 1990,191:129-131.
[6] Schinz H, Seidel C F. Untersuchungen über Aro-mastoffe. 1. ber das Himbeeraroma[J]. Helv. Chim. Acta, 1957, 40: 1839-1859.
[7] 舒 丹,郑人源,叶小金,等. 辣椒素提取及纯化的研究[J]. 成都医学院学报,2007,(2):112-114.
[8] Boker A, Fisher M, Berger R G. Rasberry ketone from submerged cultured cells of the basidiomyceteNidulaniveotometosa[J]. Biotechnol. Prog.,2001,17: 568-572.
[9] Fuganti C, Mendozza M, Joulain D.etal.. Biogeneration and biodegradation of raspberry ketone in the fungusBeauveriabassiana[J].J. Agric. Food Chem., 1996,44(11):3616-3619.
[10] Shamaila M, Skura B, Daubeny H,etal.. Sensory, chemical and gas chromatographic evaluation of five raspberry cultivars[J]. Food Res. Int.,1993,26:443-449.
[11] 刘 壮,焦玉海,张大勇.覆盆子酮的单扫描极谱分析研究[J].分析实验室,2003,22:41-43.
[12] Perez R L. Gas chromatographic determination of raspberry ketone and malathion in insect bait concentrates[J]. J. Chromatogr., 1983,259(1):176-180.
[13] 张志红,徐里民,要宝强. 覆盆子酮的分光光度法测定[J]. 北京石油化工学院学报,2005,13:15-16.
[14] 吴立军,吴继洲.天然药物化学[M](第四版).北京:人民卫生出版社,2006.
[15] 谭卫红. 银杏叶烷基酚的化学研究[D]. 北京:中国林业科学研究院林产化学工业研究所,硕士学位论文,2001.

