大孔树脂对红薯叶总黄酮的吸附及解吸特性研究
赵玉芬, 李佩艳, 郑小林, 尹 飞
1.山东省东营市河口区实验中学, 山东 东营 257200;2.河南科技大学食品与生物工程学院, 河南 洛阳471023;3.浙江工商大学食品与生物工程学院, 浙江省果蔬保鲜与加工技术研究重点实验室, 杭州 310035;4.河南科技大学农学院, 河南 洛阳 471023
红薯学名甘薯(sweet potato), 旋花科一年生草本植物,属根茎类作物,是我国广泛栽培的四大农作物之一[1]。我国红薯常年种植面积约1 000万hm2左右,年总产量约1 500亿kg,种植面积和总产量均居世界首位[2]。红薯通常以食用块根为主,而红薯叶是红薯作物生产中的主要副产品,研究发现红薯叶营养成分丰富,具有提高免疫力、抗肿瘤、抗诱变性、止血、降胆固醇、降血脂、清除自由基和保护视力等作用[3],具有很大的应用价值,但当前实际生产中,红薯叶通常被直接废弃,或作为畜禽饲料,利用率极低,造成了极大的资源浪费[4,5]。
红薯叶所富含的营养物质包括黄酮类化合物,具有多种生理保健功能,如抗癌、抗炎、提高免疫力和调节内分泌等,是新兴功能食品中的重要生物活性因子之一[6]。由于红薯种植地区广泛,红薯叶分布广其产量大,是黄酮类物质提取的良好来源[7]。因此,以废弃的红薯叶为原料进行黄酮类化合物的提取,不仅可以变废为宝,增加红薯叶的利用价值以及红薯产业的附加值,而且可以减少废弃物对环境的污染,具有一定的实际意义[4]。
大孔树脂是一种人工合成的具有多孔立体结构的聚合物,对一些芳香族化合物有很强的吸附能力,已广泛应用于很多活性成分如黄酮、内酯、生物碱等大分子化合物的提取分离[8]。对于红薯叶黄酮的研究大多集中在有机溶剂提取法[1]、超声波辅助提取法[7]、酶提取法等[5]方面,有关大孔吸附树脂对于红薯叶黄酮的吸附分离研究报道较少,尤其是缺乏其吸附、解吸特性的研究,因此,本试验研究了大孔树脂对红薯叶中总黄酮的吸附与解吸特性,优选出适合红薯叶总黄酮提取的树脂材料并确定了最佳吸附及解吸参数,以期为红薯叶的综合开发利用提供科学依据,为红薯叶黄酮的工业化生产提供理论参考。
1 材料与方法
1.1 材料与试剂
红薯叶,由河南科技大学农场提供。大孔树脂备选型号为:D101、AB-8和DM130型,购自安徽三星树脂科技有限公司。乙醇、亚硝酸钠、硝酸铝、氢氧化钠、盐酸等试剂均为分析纯。
1.2 试验仪器
101-2-BS型电热鼓风干燥箱,上海市跃进医疗器械厂产品;722N型分光光度计,上海市精科仪器厂产品;HH-S型恒温水浴锅,江苏省金坛市亿通电子有限公司产品;BS200S型电子分析天平,北京赛多利斯天平有限公司产品。
1.3 试验方法
1.3.1红薯叶总黄酮提取工艺流程 红薯叶经拣选、清水漂洗后,用吸水纸吸干表面水分,80℃烘至恒重,粉碎后过40目筛得红薯叶粉末备用。称取红薯叶粉末5 g,用70%乙醇于70℃水浴中提取5 h,得到红薯叶黄酮提取液。
1.3.2树脂的预处理 参照于智峰等[9]方法进行。
1.3.3总黄酮的测定方法 参照李佩艳等[5]方法进行。
1.3.4树脂的静态吸附及解吸试验 2.0 g树脂加入已知浓度的红薯叶总黄酮提取溶液中室温吸附24 h,计算树脂静态吸附率。将吸附后树脂,加入到一定体积的解吸液中,于室温下解吸24 h,按下式计算树脂静态解吸率:
吸附率(%)=(C0-Ce)× Vi× 100 %/C0× Vi
解吸率(%)=Cd× Vd× 100 % /(C0-Ce)× Vi
式中,C0:为脂吸附前溶液中初始总黄酮浓度(mg/L);Ce为树脂吸附平衡后溶液中总黄酮浓度(mg/L);Vi为树脂吸附前溶液体积(mL);Cd为树脂解吸平衡后解吸液中总黄酮浓度(mg/L);Vd为树脂解吸平衡后解吸液体积(mL)。
1.3.5选定树脂对红薯叶总黄酮的动态吸附试验 分别考察上样浓度(100、200、300、400 mg/L)、上样液流速(1、2、3、4、5 mL/min)、上样液pH(3.0、4.0、5.0、6.0、7.0)对选定树脂吸附红薯叶黄酮吸附率的影响,并通过L9(34)三因素三水平正交试验确立选定大孔吸附树脂对红薯叶中总黄酮的最佳吸附工艺参数。
1.3.6选定树脂对红薯叶总黄酮的动态解吸试验 分别考察洗脱液浓度(50%、60%、70%、80%、90 %)、洗脱液流速(1、2、3、4、5 mL/min)、洗脱液用量(2、3、4、5、6 BV)对选定树脂解吸率的影响,并通过L9(34)三因素三水平正交试验确立选定大孔吸附树脂对红薯叶中总黄酮的最佳解吸工艺参数。
2 结果与分析
2.1 大孔树脂的筛选
D101、AB-8、DM130大孔吸附树脂均可吸附黄酮,但3种大孔吸附树脂对总黄酮的吸附率及解吸率差异较大(表1)。其中,AB-8大孔吸附树脂的吸附和解吸效果相对于其他两种树脂较好。因此,选择AB-8为红薯叶总黄酮吸附分离的较优树脂。

表1 三种大孔树脂对红薯叶总黄酮的吸附和解吸能力Table 1 Adsorption and desorption capacity of three types resin for total flavonoids from sweet potato leaves.
2.2 AB-8大孔吸附树脂对红薯叶总黄酮的动态吸附条件优化
2.2.1上样液浓度的选择 随上样液浓度增加,大孔吸附树脂对总黄酮的吸附率也随之增加,上样液浓度为300 mg/L时,树脂对总黄酮的吸附率最大,可达60.2%。上样液浓度超过300 mg/L时,随上样液浓度增加,树脂对总黄酮的吸附率反而会降低,可能由于上样液浓度过大堵塞树脂,降低了树脂对总黄酮的吸附效果。最终确定300 mg/L浓度为大孔吸附树脂吸附红薯叶总黄酮的最佳上样液浓度(图1)。
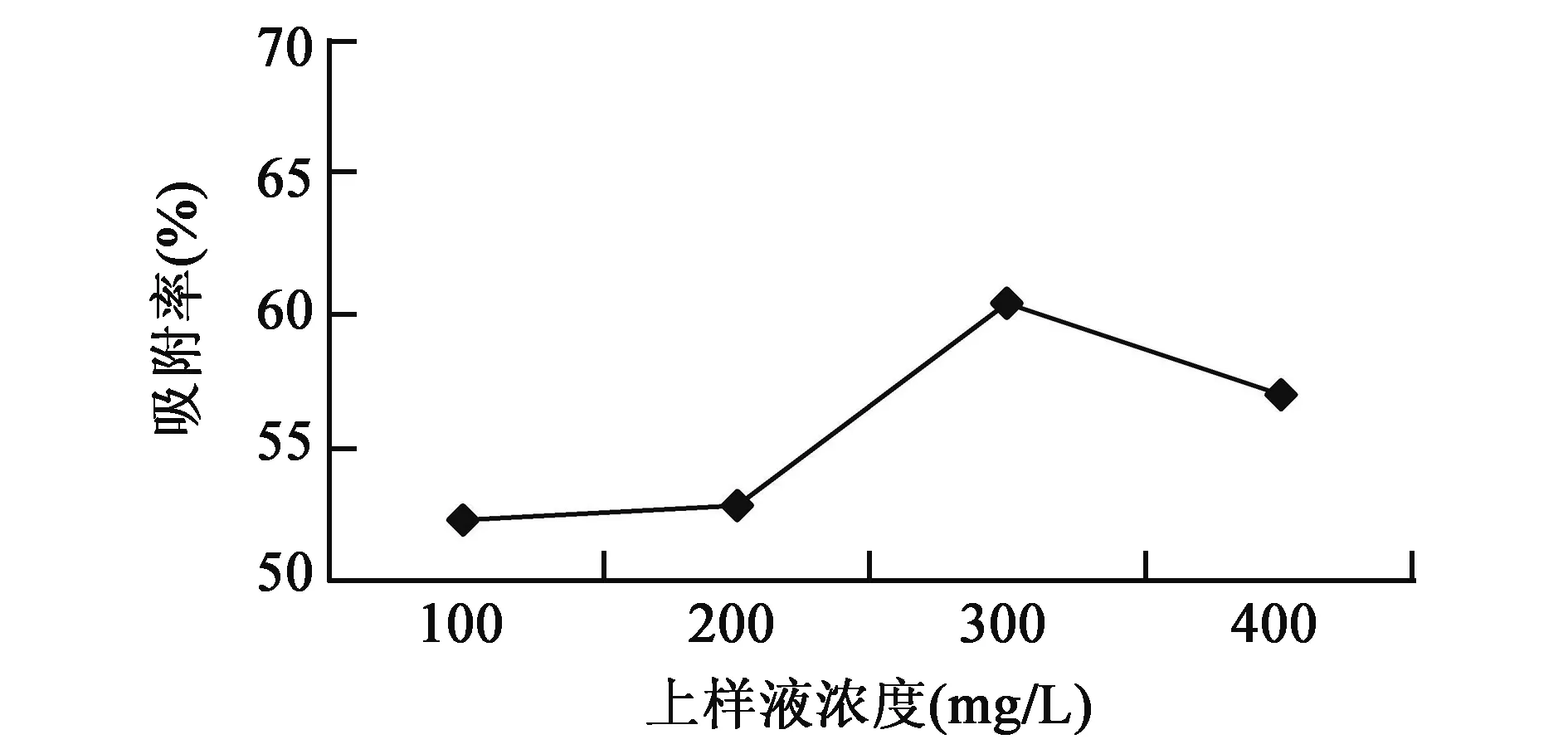
图1 不同上样液浓度对大孔树脂吸附率的影响Fig.1 Effects of different concentrations of sample solution on adsorption of macroporous resin.
2.2.2上样液流速的选择 上样液流速不同,大孔吸附树脂对总黄酮的吸附率也随之发生变化。过低或过高的流速下,大孔树脂的吸附效率都下降。过低时吸附时间长,但也会提高解析率;过高流速下吸附不充分。当流速为3 mL/min时,大孔吸附树脂对总黄酮的吸附率最大,为63.8%。所以确定3 mL/min为大孔吸附树脂吸附红薯叶总黄酮的最佳上样液流速(图2)。
2.2.3上样液pH的选择 上样液pH影响大孔吸附树脂对总黄酮的吸附率。黄酮具有酚羟基结构,呈现一定酸性,它们在弱酸条件下,以分子状态存在,可以凭借范德华力与树脂发生吸附作用,pH 3~5区间,随pH上升,大孔树脂对黄酮的吸附率增加,pH超过5.0时,树脂的吸附率迅速下降。上样液pH为5.0时,树脂的吸附率最大,为65.6%。最终确定上样液的最佳pH为5.0(图3)。
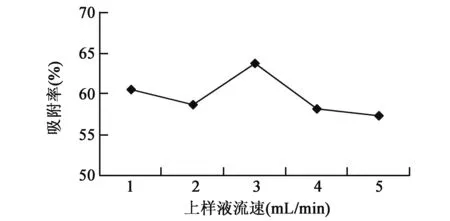
图2 不同上样液流速对大孔树脂吸附率的影响Fig.2 Effects of different flow velocities of sample solution on adsorption of macroporous resin.
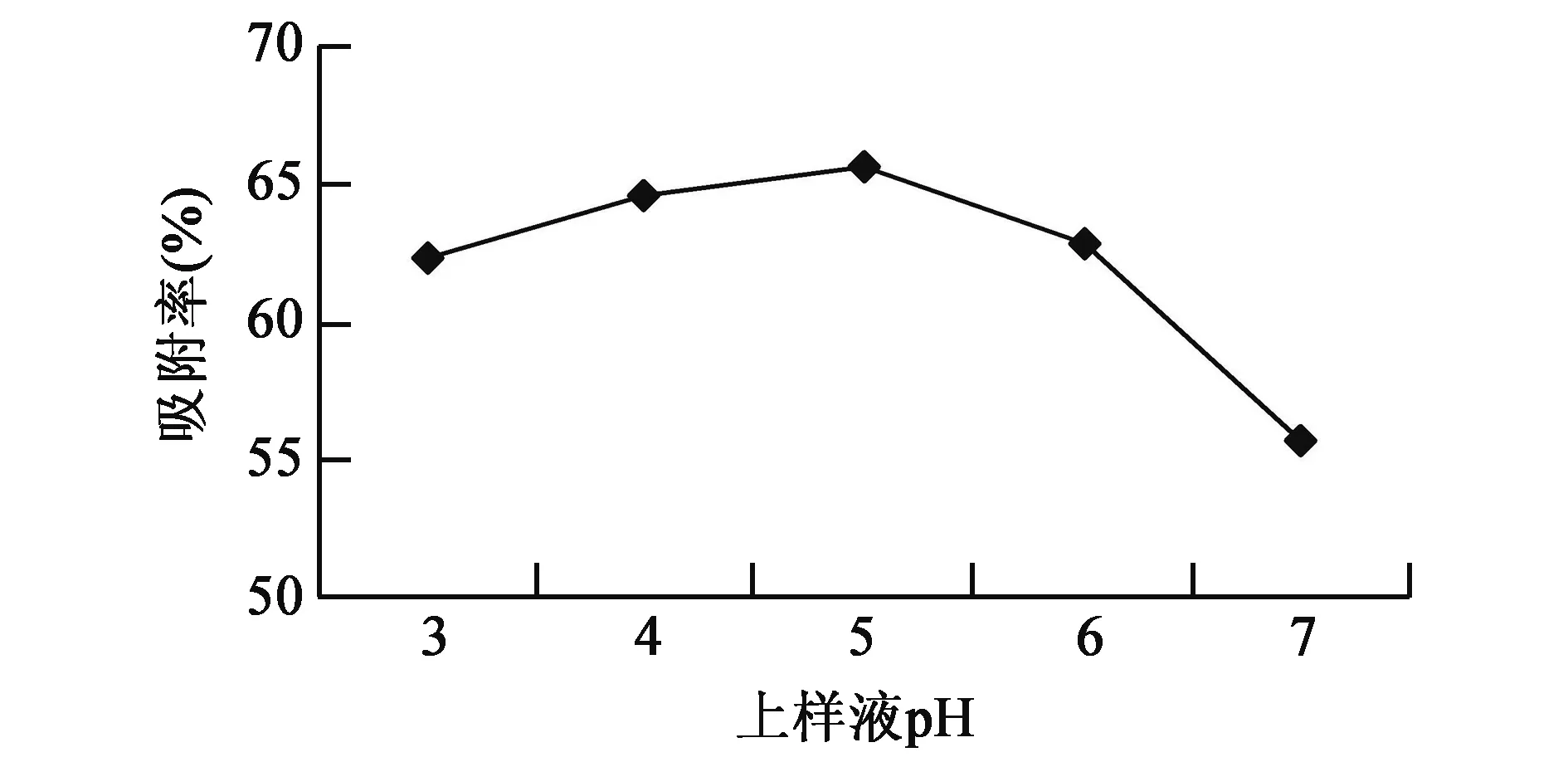
图3 不同上样液pH值对大孔树脂吸附率的影响Fig.3 Effects of different pH values of sample solution on adsorption of macroporous resin.
2.2.4正交试验结果 根据上述的三个单因素试验结果进行正交试验,结果见表2。极差分析表明:三因素对大孔吸附树脂吸附红薯叶中总黄酮的影响主次顺序为:A>B>C,即:上样液浓度>流速>pH。最佳提取条件为A2B1C2,即上样液浓度300 mg/L,流速2 mL/min,上样液pH 5.0,大孔吸附树脂对红薯叶中总黄酮的吸附率最高,可达到66.8%。
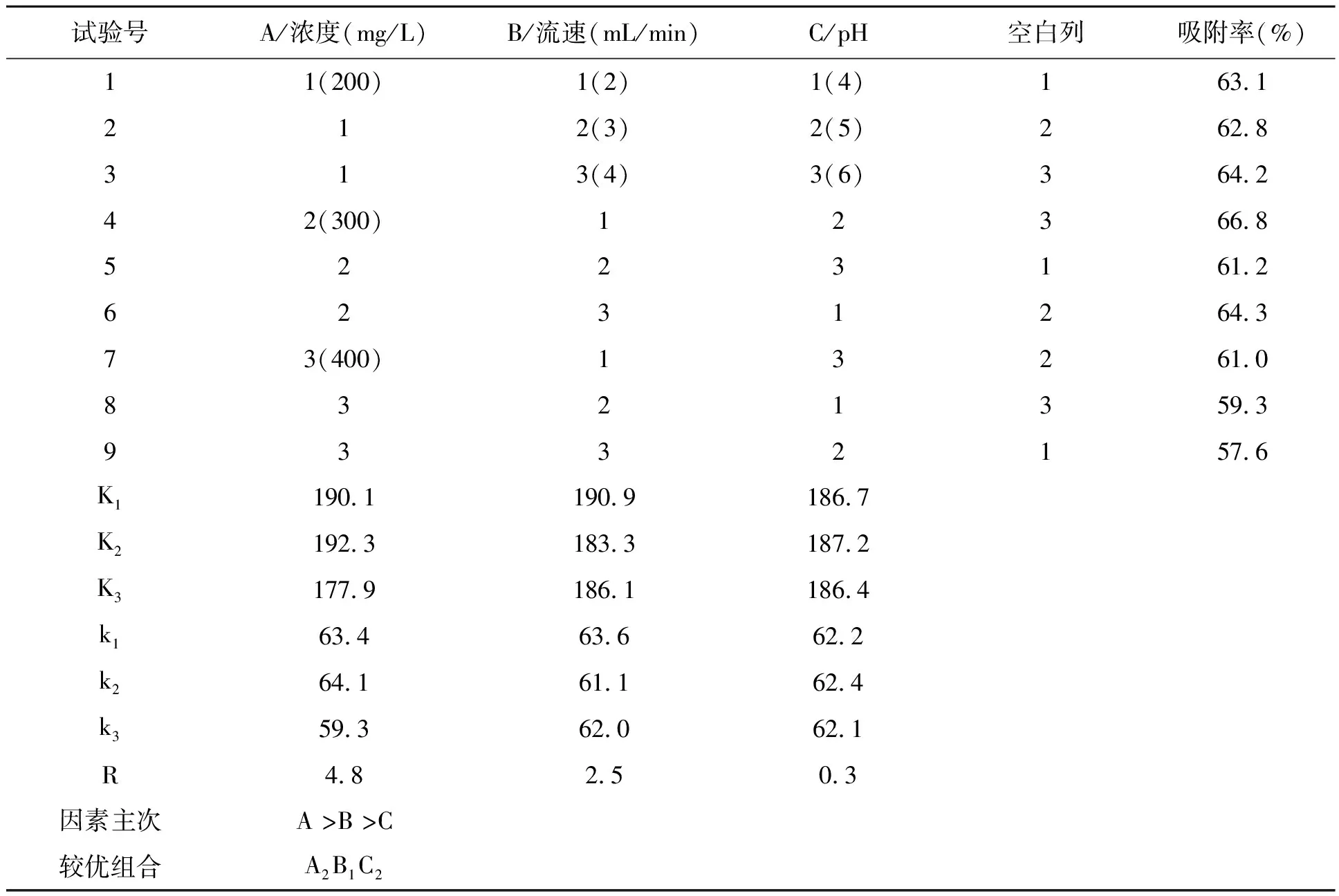
表2 大孔吸附树脂对红薯叶总黄酮吸附条件的正交试验结果Table 2 Results of orthogonal test on adsorption conditions of total flavonoids from sweet potato leaves.
2.3 AB-8大孔吸附树脂对红薯叶总黄酮的动态解吸条件
2.3.1洗脱液浓度的选择 随着洗脱液乙醇浓度的增加,解吸液中总黄酮的量也逐渐增加,相应的大孔吸附树脂的解吸率也随之增加(图4)。当乙醇溶液浓度达到80%时,大孔吸附树脂解吸率达64.6%,当乙醇浓度达到90%时,大孔吸附树脂的解吸率为64.7%,变化不大。从解吸率和经济效益两方面考虑,确定浓度80%的乙醇溶液为合适洗脱液。
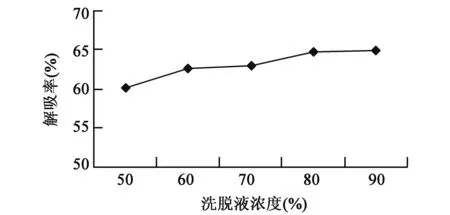
图4 不同洗脱液浓度对大孔树脂解吸率的影响Fig.4 Effects of different concentrations of elution on desorption of macroporous resin.
2.3.2洗脱液流速的选择 随着洗脱液流速增加,大孔吸附树脂对总黄酮解吸率也增加,直至洗脱液流速为4 mL/min时,大孔吸附树脂解吸率达到最大,为69.3%。当洗脱液流速超过4 mL/min时,树脂解吸率开始下降,这是因为较低流速下,吸附和解吸会达到一种平衡,流速过高则会导致解吸不彻底,降低解析率。最终确定4 mL/min为洗脱液合适流速(图5)。
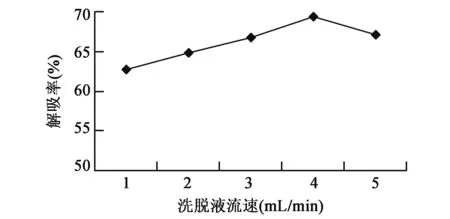
图5 不同洗脱液流速对大孔树脂解吸率的影响Fig.5 Effects of different flow velocities of elution on desorption of macroporous resin.
2.3.3洗脱液用量的选择 随着洗脱液用量增加,大孔吸附树脂对总黄酮解吸率不断增加。当洗脱液用量为5 BV时,大孔吸附树脂解吸率为69.8%;洗脱液用量继续增大到6 BV时,大孔吸附树脂的解吸率为70.1%,与洗脱液用量为5 BV时的解吸率相比,仅增加了0.3%,这说明洗脱液用量超过5 BV时,大孔吸附树脂随洗脱液用量的增加解吸率变化很小。所以确定5 BV为洗脱液最佳用量(图6)。
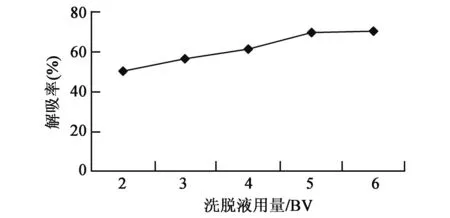
图6 不同洗脱液用量对大孔树脂解吸率的影响Fig.6 Effects of different elution volumes on desorption of macroporous resin.
2.3.4正交试验结果 根据上述的三个单因素试验结果进行正交试验,结果见表3。极差分析表明:三因素对大孔吸附树脂解吸影响的主次顺序为,A>B>C,即:洗脱液浓度>洗脱液流速>洗脱液用量。最佳解吸条件为A3B2C2,即洗脱液液浓度90%,洗脱液流速为4 mL/min,洗脱液用量为5 BV,在此条件下树脂的解吸率可达70.3%。
3 讨论
通过对3种吸附黄酮效果良好的树脂进行静态吸附及解吸试验,确定了吸附分离红薯叶黄酮的最优树脂为AB-8大孔吸附树脂,与任云霞等[10]、洪雪娥等[11]研究结果一致。通过正交试验得到其最佳吸附条件为:上样液浓度300 mg/L、流速2 mL/min、上样液pH 5.0,其对红薯叶总黄酮吸附率可达66.8%;最佳解吸条件为:洗脱液浓度90%、洗脱液流速4 mL/min、洗脱液用量5 BV,树脂的解吸率可达70.3%。
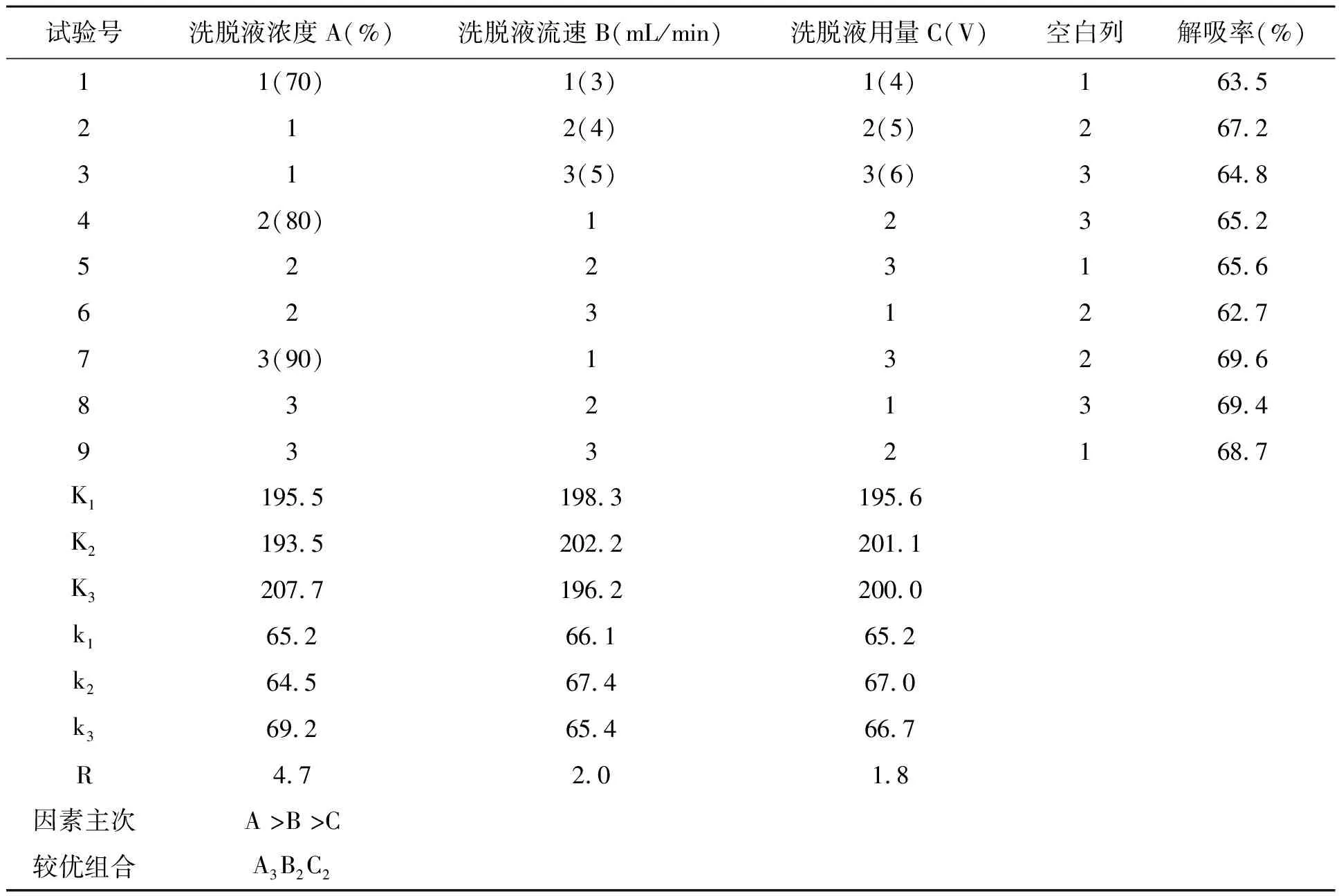
表3 大孔树脂对红薯叶总黄酮解吸附条件的正交试验结果Table 3 Results and layout of orthogonal test on desorption conditions of sweet potato leaves total flavonoids
有机溶剂提取法是提取黄酮最简单的方法,其缺点是得到的黄酮提取液中除黄酮类化合物外还含有大量的杂质[12]。红薯叶黄酮因具有极性、亲水性、较强的氢键生成能力等特点而能被大孔树脂吸附[10],因此红薯叶黄酮提取液经大孔树脂纯化后有利于得到高纯度的红薯叶黄酮制品。本试验中,300 mg/L红薯叶黄酮提取液经AB-8树脂吸附、解吸后浓度可达704 mg/L,浓度提高了1.35倍,说明AB-8树脂适合用于红薯叶黄酮的纯化。本试验研究结果可为大孔树脂在提取红薯叶中总黄酮的应用提供理论依据。
参 考 文 献
[1] 王小华, 邓 斌, 张晓军, 等. 红薯叶黄酮类化合物提取及其抗氧化作用研究[J]. 粮食与油脂, 2008, 12: 26-28.
[2] 周增学. 红薯的营养价值与保健功能[J]. 食品与药品, 2006, 8(8): 48-51.
[3] 陆 英, 吴朝比, 蒋华军, 等. 红薯叶黄酮分离纯化工艺及抗氧化性研究[J]. 食品科学, 2009, 30(14): 114-118.
[4] 李 光, 余 霜, 陈庆富. 正交设计在红薯叶黄酮提取中的应用[J]. 北方园艺, 2012, 1: 41-42.
[5] 李佩艳, 尹 飞, 刘建学, 等. 响应面法优化酶法提取红薯叶总黄酮的工艺[J]. 食品工业科技, 2012, 33(1):75-277, 281.
[6] 孙艳梅, 徐雅琴, 杨 林. 天然物质类黄酮的抗氧化活性的研究[J]. 中国油脂, 2003, 28(3): 54-56.
[7] 兰 丹, 文 略, 王小萍, 等. 红薯叶中总黄酮提取工艺的研究[J]. 微量元素与健康研究, 2007, 1(1): 47-48.
[8] Zhang Y, Li S F, Wu X W,etal.. Macroporous resin adsorption for purification of flavonoids inHouttuyniacordatuThunb[J]. J. Chinese Inst. Chem. Engin., 2007, 15(6): 872-876.
[9] 于智峰, 王 敏, 金 颖. 大孔吸附树脂对苦荞黄酮吸附分离特性研究[J]. 食品研究与开发, 2006, 27(11): 1-5.
[10] 任云霞, 李 莎, 张坤生. 不同大孔树脂对甘薯叶中黄酮类化合物的吸附分离特性[J]. 食品研究与开发, 2009, 30(10): 11-15.
[11] 洪雪娥, 高荫榆, 罗丽萍, 等. 大孔树脂对薯蔓黄酮吸附分离特性研究[J]. 食品科学, 2006, 27(10): 423-427.
[12] 裴凌鹏, 惠伯棣, 金宗濂, 等. 黄酮类化合物的生理活性及其制备技术研究进展[J]. 食品科学, 2004, 25(2): 203-207.

