硅基介孔材料负载手性金属催化剂的研究进展
刘 锐, 陈倩芸, 聂倩玉, 詹新同, 徐圆圆, 程探宇, 刘国华
(上海师范大学 生命与环境科学学院,上海 200234)
0 引 言
近年来,随着医学和生物领域的不断发展,人类对手性化合物的需求呈现了持续增长的趋势.目前获得手性化合物的主要方法是不对称合成法,采用手性有机金属催化剂的策略.可是,均相手性金属催化剂面临着手性配体及过渡金属昂贵、催化剂不能重复利用、对环境污染等瓶颈问题,因此,一种可重复利用的环境友好型手性金属催化剂成为了科学研究的一个重要方向,其中,硅基介孔材料负载型手性金属催化剂得到了大多数科学家的广泛关注.
自从1992年Kresge[1]首次报道有序的介孔纳米硅材料以来,负载型金属催化剂便取得了飞跃性的发展.这种有序结构的硅材料不仅具有较大的比表面积,而且性质稳定,其自身结构在大多数的化学试剂中保持不变.特别是SBA、MCM等系列有序介孔硅材料被合成,为硅基介孔材料负载型金属催化剂制备提供了件[2].本文作者简要综述了硅基介孔材料的负载策略及常见的硅基介孔材料负载手性金属催化剂.
1 硅基介孔材料负载手性有机金属催化剂的负载策略
硅基介孔材料负载型手性金属催化剂主要是将介孔硅材料和均相手性金属催化剂进行组合,通过不同的负载方式与介孔硅材料结合,制备具有规整孔道结构负载型手性金属催化剂,目前获得这些负载型手性金属催化剂主要是通过下面4种方法实现:共价键法、离子对法、氢键吸附法和包裹法.
1.1 共价键法
共价键法是目前最常用的负载方法.它是指在催化剂的合成过程中,通过形成共价键的方法将手性配体引入介孔硅材料.最近Liu等[3]报道了一种双功能的手性金属催化剂,该催化剂首先是将咪唑双功能硅源在酸性条件下进行自聚,形成了一种表面具有大量羟基的硅基载体,然后硅基载体材料表面的羟基和功能硅源在甲苯条件下进行了Si-O-Si键的链接,羟基氢与功能硅源的乙氧基之间的共价键分别断裂,失去一分子乙醇,然后形成一个新的Si-O-Si键将配体与材料连接在一起,这种利用旧共价键断裂与新共价键形成的方法称为共价键法(图1).

图1 共价键法示意图
1.2 离子对法
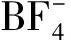
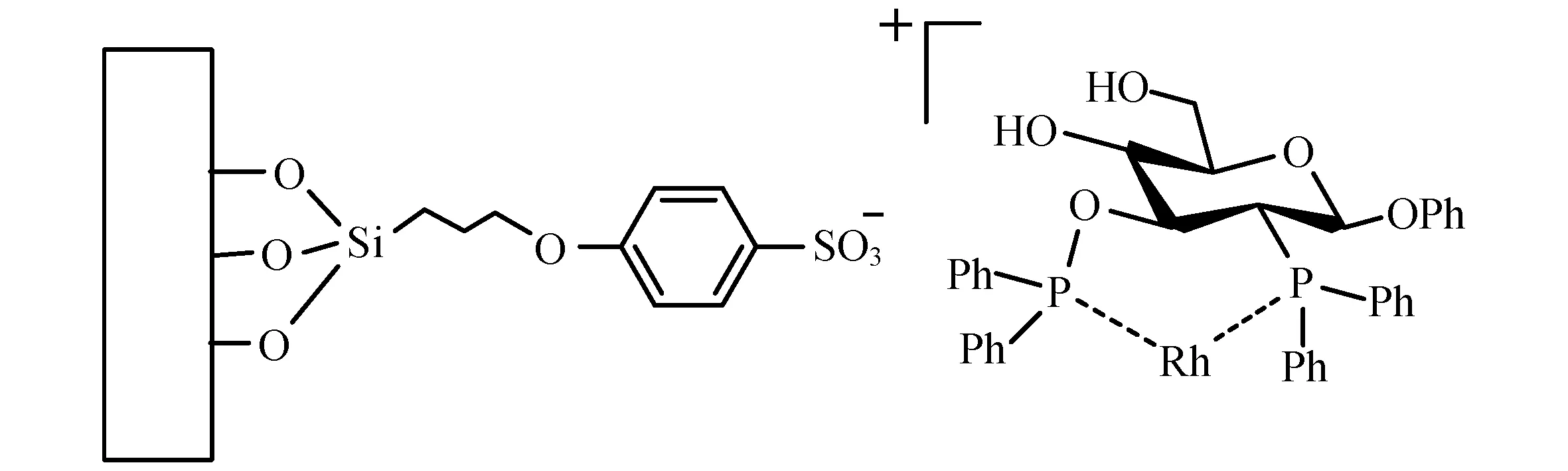
图2 离子对法示意图
1.3 氢键吸附法

图3 物理吸附法示意图
物理吸附的最大特点在于均相催化剂和配体之间没有形成化学键,利用的是分子之间的作用力,与化学键法相比,物理吸附法最大的优点在于可以将一些较难引入负载位点的配体进行负载,也能够解决一些配体在形成化学键的过程中发生变化的问题.Liu等[5]利用氢键作用力将Cp-Rh-Ts-DPEN催化剂负载与介孔SBA-15和SBA-16,制备出了一种能够多次循环利用的高效高选择性的异相催化剂,作者采用三氟甲磺酸阴离子作为中间体,利用三氟甲磺酸的氟原子和催化剂的氢原子之间形成氢键以及与载体表面羟基形成氢键来获得一种新型负载型手性金属催化剂,如图3.
同时,Li等[6]也利用原子间作用力制备了一种纳米结构的负载型催化剂,此催化剂通过金属连接在硅基材料之上,金属与硅基材料之间则利用氧原子和铑原子之间的吸附力,这种稳定的吸附力能够使催化剂在循环多次之后依然具有良好的活性和立体选择性.
1.4 包裹法
包裹负载型金属催化剂是指将通过包裹的方法将均相催化剂包裹在具有空腔结构的硅基材料的内部,其优点在于不用通过化学键将配体和载体进行连接,而是让其自由运动在空腔内部,因此具有与均相催化剂等同的催化性能.Yang等[7]合成了一种具有核壳结构的手性金属催化剂FDU-12-Co催化剂,在惰性气体的保护下将FDU-12分散在含有钴的二氯甲烷溶液中进行分散,通过烷基硅烷控制孔道端口,将FDU-12-Co催化剂包裹在介孔孔道内,获得具有均相性能的负载型手性金属催化剂(图4).

图4 包裹法示意图
2 硅基介孔材料负载型手性金属催化剂
通常的载体根据其骨架结构硅基材料分为无机介孔硅材料和有机介孔硅材料,无机介孔材料的特点是其骨架结构由无机硅源水解形成,而有机介孔载体的骨架结构是由有机硅源水解得到,通过不同的负载方式可获得不同性能的负载型催化剂.
2.1 无机硅材料负载手性金属催化剂
从21世纪开始大量的课题组就对无机硅材料负载型催化剂进行了研究和报道,这些研究为负载有机金属催化剂提供了可能.特别是随着无机介孔材料的成熟,负载型催化剂也向介孔方向发展,常见的无机介孔硅基材料主要有SBA、MCM和FSM等系列硅材料.特别是赵东元等[8]在1998年具有SBA-15结构的无机硅材料在手性有机金属催化剂方法取得了成功.2006年,一种基于SBA-15的手性金属催化剂被报道[9],该课题组利用后嫁接的方法将合成的手性金属催化剂嫁接于SBA-15之上.结果显示这种负载型催化剂在烯烃的环氧化反应中能够显示出更高的手性诱导作用,这种大孔径的催化剂对大分子也具有良好的反应性能,循环套用之后依然具有较高的活性.2007年,Hierro课题组将BINOL和Ti的一种金属催化剂负载于介孔SBA-15制备出一种新的负载型催化剂[10].Li等[11]将手性磷配体和1,2-二苯基乙二胺配体及金属铑催化剂负载于介孔SBA-15的孔道中合成了一种对芳香酮具有高活性的手性金属催化剂,这种催化剂能够是芳香酮的转化率达到99%以上.最近,SBA-15负载型手性金属催化剂取得了重要的成果,其催化的反应也趋于多元化[12].
Yang等[13]利用正硅酸乙酯和功能化硅源合成了一系列无机硅基材料负载型催化剂,结果表明,不同形貌的催化剂对芳香醛与二乙基锌的不对称加成反应具有不同的活性和立体选择性,发现催化剂孔道对反应物活性与立体选择性具有较大的影响,为合成其他类型的负载型催化剂起到一定的指导作用.
Liu[14]等利用功能化硅源和正硅酸乙酯(TEOS)合成了一种核壳结构的负载型催化剂,其合成过程主要是利用两种不同的硅源进行共聚,利用Si-O键的水解和缩聚成功的将手性配体引入这种具有核壳结构的硅基材料.从图6的催化剂示意图可以看出,此负载型催化剂的合成过程中TEOS发生水解,同时在新化学键的形成过程中发生了Si-O-Si键的链.该催化剂不仅显示出与均相催化剂相当的催化性能,而且能够经过多次循环使用,其活性和立体选择性并没有明显的下降.
Anwander等[15]通过钛的手性配体合成了一系列功能化的MCM-41、SBA-1.Park等[16]将MCM-41用氨基化的硅源进行改性,然后在甲苯的条件下与手性配体进行取代反应,制备出一种具有手性催化作用的介孔MCM-41型催化剂,这种催化剂的优点在于合成配体与合成载体是各自进行的,最后再利用取代反应进行连接,这样可以避免在合成材料过程中配体发生副反应的问题,结果表明该配体在还原芳香酮的反应时活性和立体选择性有明显提高(图7).

图5 催化剂NS(a)合成图
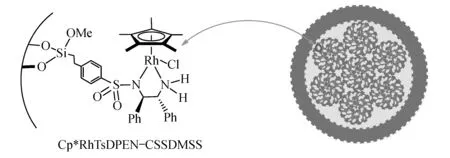
图6 核壳结构的负载型有机金属铑催化剂示意图

图7 MCM-41负载型催化剂及催化反应
手性锰在不对称金属催化中一直具有广泛的应用,2011年Li报道了一种MCM-41负载型金属锰催化剂[17],如图8.该课题组对材料和催化剂的连接臂长度进行了优化,结果表明不同长度的碳链对反应有较大的影响,特别是对其立体选择性能够产生显著的作用,原因在于不同的负载型催化剂能够对反应产生不同的立体效应,经过优化,其催化剂在碳碳双键的环氧化反应中也能表现出良好的活性和立体选择性.

图8 负载型有机锰催化剂及催化反应
总之,不同课题组采用无机介孔硅材料负载的手性金属催化剂的研究已经取得很大进展,从不同的负载策略到各类不对称催化反应的研究均相取得了较好的催化性能[18-21].
2.2 有机硅材料负载手性有机金属催化剂及催化反应
与无机介孔材料相比,有机介孔硅材料最大的特点在于其骨架结构是由有机硅源水解形成,这类材料的特点在于其亲疏水性发生了较大变化.2008年,一种手性配体修饰的有机介孔材料被报道[22-23],首先利用手性配体与N-甲基-γ-氨基三甲氧基硅烷合成手性硅源,再利用硅源共聚法合成手性有机介孔硅材料.这种手性介孔材料具有与无机介孔材料相似的孔道结构,孔径大小也能够通过其模板剂进行控制,从1.3~2.8 nm分布不等,如图9所示,有序规整的孔道结构不仅能为催化提供良好的环境,而且在其他领域也有广泛的应用.
Liu等[24-25]利用1,4-双(三乙氧基硅基)苯与手性环己二胺的功能化硅源合成了一种具有介孔结构硅基材料,然后再进行金属嫁接制备成一种手性金属镍催化剂,如图10所示.该负载型催化剂对不对称迈克尔加成具有很高的活性和立体选择性,在1,3-二羰基化合物与硝基烯的加成反应中转化率大于92%,对映体过量值ee高达99%,循环9次之后转化率和ee值也没有明显的降低.
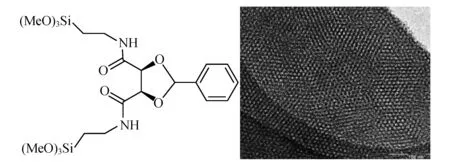
图9 手性有机硅源及其负载型催化剂透射电镜图
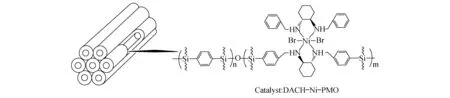
图10 DACH-Ni-PMO催化剂示意图
Corma等[26]通过共聚的策略合成了一种负载型有机钒金属催化剂并成功的用于不对称催化,如图11.此催化剂在苯甲醛与TMSCN的不对称催化反应表现了良好的活性.
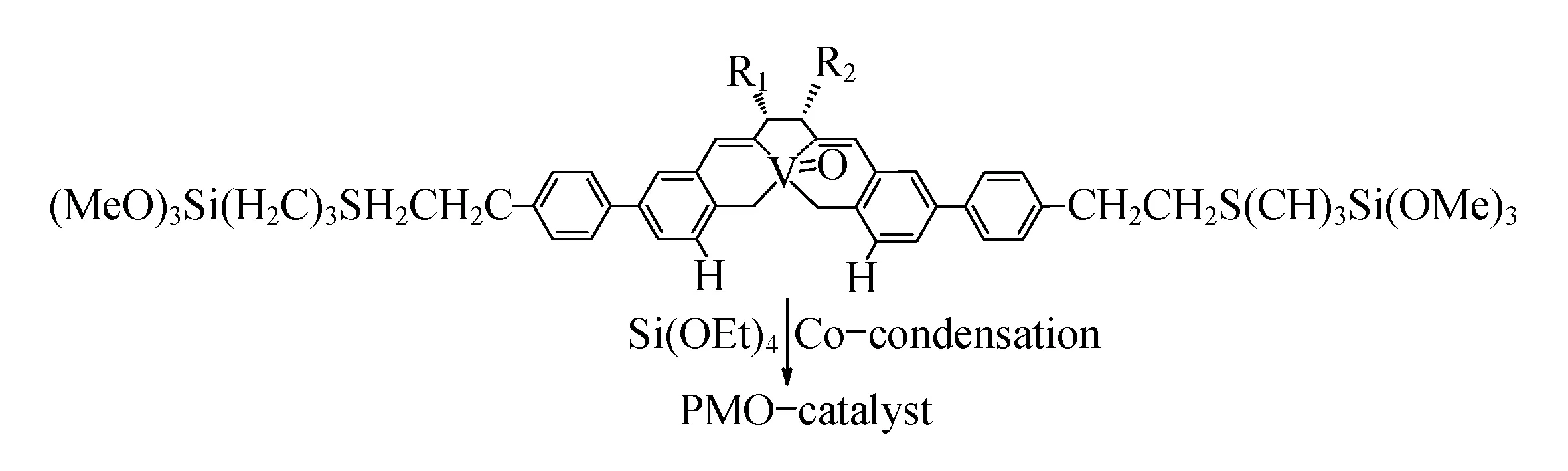
图11 Corma负载型钒催化剂制备图
另外,手性BINAP从发现以来一直在金属催化中发挥重要的作用,特别是氢化反应的良好催化剂,具有转化率高和立体选择性高等一系列优点.由于BINAP是一类昂贵的手性配体,因此发展一种可以重复利用的BINAP催化剂是当前较为迫切的问题,Li等[27]利用P123、BINAP功能化硅源及正硅酸乙酯合成了一种有机无机混合介孔硅材料,如图12所示,首先利用硅源共聚法合成一种共聚体,然后在酸性条件下去除模板剂得到一种功能化的手性的有机金属钌催化剂.其对乙酰乙酸甲酯α-羰基的还原催化数据表明Ru/PMO-BINAP在S/C持续增大的条件下依然能够表现出良好的转化率和立体选择性.
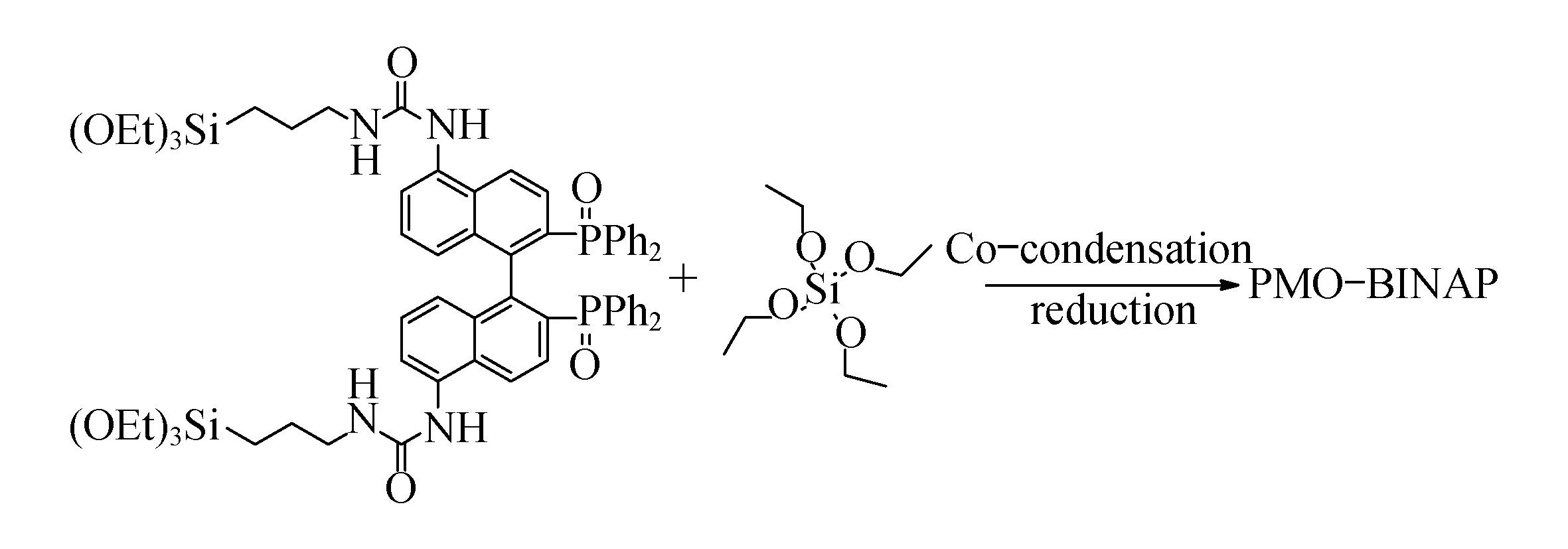
图12 负载型PMO-BINAP有机膦配体合成示意图
特别是,近年来,手性有机介孔材料取得了重大的发展[28-30].Crudden等[31]也报道了一种具有功能化手性有机硅材料并对其催化反应进行研究.首先合成了一种具有手性结构的膦配体硅源,在模板剂的存在下进行硅源共聚而获得负载型有机金属催化剂.研究发现此催化剂具有极高的立体选择性,取代基R1与R2的变化并为对反应活性产生明显的影响,该催化剂可方便地循环再利用,如图13.
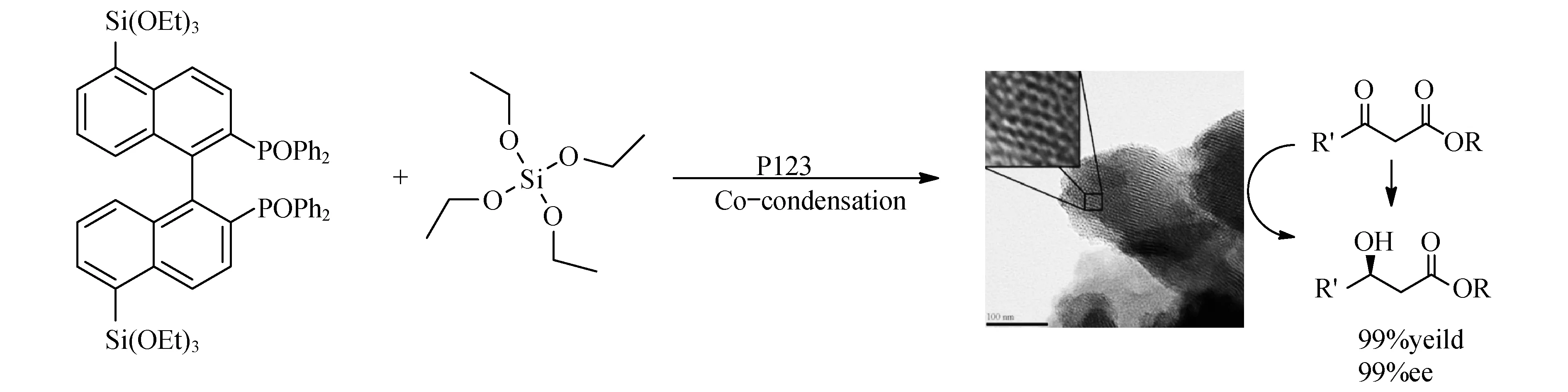
图13 Crudden手性功能材料合成及催化反应
3 展 望
本研究简要综述了硅基介孔材料的负载策略及常见的硅基介孔材料负载手性金属催化剂.可以预测在未来的发展中,随着新功能性的硅基材料的发现以及各类负载策略的丰富,大量新型的高效负载型有机金属催化剂将出现在文献中,更多的研究成果将会应用到工业中.
参考文献:
[1] KRESGE C T,LEONOWICZ M E,ROTH W J,et al.Ordered mesoporous molecular sieves synthesized by a liquid-crystal template mechanism[J].Nature,1992,359:710-712.
[2] CHOONG E S,LEE S.Supported chiral catalysts on inorganic materials[J].Chem Rev,2002,102(10):3495-3524.
[3] XIAO W,JIN R H,CHENG T Y,et al.A bifunctionalized organic-inorganic hybrid silica:synergistic effect enhances enantioselectivity[J].Chem Commun,2012,48(97):11898-11900.
[4] SELKE R,CAPKA M.Carbohydrate phosphinites as chiral ligands for asymmetric syntheses catalyzed by complexes:Part VIII1:Immobilization of cationic rhodium(I)chelates of phenyl 4,6-O-(R)-benzylidene-2,3-bis(O-diphenylphosphino)-β- D-glucopyranoside on silica[J].J Mol Catal,1990,63(3):319-334.
[5] XU Y L,CHENG T Y,LONG J,et al.An ion-pair immobilization strategy in rhodium-catalyzed asymmetric transfer hydrogenation of aromatic ketones[J].Adv Synth Catal,2012,354(17):3250-3258.
[6] HAN D F,LI X H,ZHANG H D,et al.Asymmetrichydroformylation of olefins catalyzed by rhodium nanoparticles chirally stabilized with(R)-BINAP ligand[J].J Mol CatalA:Chemical.2008,283(1-2):15-22.
[7] LI B,BAI S Y,WANG X F,et al.Hydration of epoxides on [CoIII(salen)] encapsulated in silica-based nanoreactors[J].Angew Chem Int Ed,2012,51(46):11517-11521.
[8] ZHAO D Y,FENG J G,et al.Triblock copolymer syntheses of mesoporou silica with periodic 50 to 300 angstrom pores[J].Science,1998,279(5350):548-552.
[9] RUKHSANA I K,AHMAD I,KHAN N H,et al.Chiral Mn(III)salen complexes covalently bonded on modified MCM-41 and SBA-15 as efficient catalysts for enantioselectiveepoxidation of nonfunctionalized alkenes[J].Catal,2006,238(1):134-141.
[10] YOLANDA P E,QUINTANILLA D P,FAJARDO M,et al.Immobilization of titanium chiral alkoxides on SBA-15 and modelling the active sites of heterogeneous catalyst using titanium silsesquioxanecomplexes[J].J Mo Catal A:Chemical.2007,271(1-2):227-237.
[11] LIU G H,LIU M M,SUN Y Q,et al.Mesoporous SBA-15-supported chiral catalysts:preparation,characterization and asymmetric catalysis[J].Tetrahedron:Asymmetry,2009,20(2):240-246.
[12] SHEN Y B,CHEN Q,LOU L L,et al.Asymmetric Transfer Hydrogenation of Aromatic Ketones Catalyzed by SBA-15 Supported Ir(I)Complex Under Mild Conditions[J].Catal Lett,2010,137(1-2):104-109.
[13] LIU X,WANG P Y,ZHANG L,et al.Chiral mesoporous organosilica nanospheres:effect of pore structure on the performance in asymmetric catalysis[J].Chemistry,2010,16(42):12727-12735.
[14] ZHANG H S,JIN R H,YAO H,et al.Core-shell structured mesoporous silica:a new immobilized strategy for rhodium catalyzed asymmetric transfer hydrogenation[J].Chem Commun,2012,48(63):7874-7876.
[15] DESCHNER T,LφNSTAD B-T,WIDENMEYER M,et al.Functionalization of MCM-41 and SBA-1 with titanium(iv)(silyl)amides[J].J Mat Chem,2011,21(15):5620-5628.
[16] MAYANI V J,ABDI S H,MAYANI S V,et al.Enantiomer self-disproportionation and chiral stationary phase based selective chiral separation of organic compounds[J].Chirality,2011,23(4):300-306.
[17] LOU L L,JIANG S,YU K,et al.Mesoporous silicas functionalized with aminopropyl via co-condensation:Effective supports for chiral Mn(III)salen complex[J].Micropor Mesopor Mat,2011,142(1):214-220.
[18] LACASTA S,SEBASTIN V C,CASADO C,et al.Chiral Imprinting with Amino Acids of Ordered Mesoporous Silica Exhibiting Enantioselectivity after Calcination[J].Chem Mater,2011,23(5):1280-1287.
[19] MAEDA R,WADA T,KUSAKA A,et al.Role of entropy in supramolecular photochirogenesis:enantiodifferentiating photoisomerization of cyclooctenes in chiral sensitizer-immobilized MCM-41 cavities[J].Photoch Photobio sciences,2011,10(9):1390-1392.
[20] VILLAVERDE G,ARNANZ A,IGLESIAS M,et al.Development of homogeneous and heterogenized rhodium(I)and palladium(II)complexes with ligands based on a chiral proton sponge building block and their application as catalysts[J].Dalton T,2011,40(37):9589-9600.
[21] HUANG J,FU X,WANG G,et al.Axially coordinated chiral salen Mn(III)anchored onto azole onium modified ZnPS-PVPA as effective catalysts for asymmetric epoxidation of unfunctionalized olefins[J].Dalton T,2012,41(35):10661-10669.
[22] RAFAEL A G,GRIEKEN R V,IGLESIAS J,et al.Synthesis of Chiral Periodic MesoporousSilicas Incorporating Tartrate Derivatives in the Framework and Their Use in Asymmetric Sulfoxidation[J].Chem Mater,2008,20(9):2964-2971
[23] MORELL J,CHATTERJEE S,KLAR P J,et al.Synthesis and characterization of chiral benzylic ether-bridged periodic mesoporous organosilicas[J].Chemistry,2008,14(19):5935-5940.
[24] JIN R H,LIU K T,XIA D Q,et al.Enantioselective Addition of Malonates and β-Keto Esters to Nitroalkenes over an Organonickel-Functionalized Periodic Mesoporous Organosilica[J].Adv Synth Catal,2012,354(17):3265-3274.
[25] LIU K T,JIN R H,CHENG T Y,et al.Functionalized periodic mesoporous organosilica:a highly enantioselective catalyst for the Michael addition of 1,3-dicarbonyl compounds to nitroalkenes[J].Chemistry,2012,18(48):15546-15553.
[26] BALEIZáO C,GIGANTE B,DAS D,et al.Periodic mesoporous organosilica incorporating a catalytically active vanadyl Schiff base complex in the framework[J].J Catal,2004,223(1):106-113.
[27] WANG P,LIU X,YANG J,et al.Chirally functionalized mesoporous organosilicas with built-in BINAP ligand for asymmetric catalysis[J].J Mater Chem,2009,19(42):8009-8014.
[28] WU X,BLACKBURN T,WEBB J D,et al.The synthesis of chiral periodic organosilica materials with ultrasmall mesopores[J].Angew Chem,2011,50(35):8095-8099.
[29] HAO T T,SHI J Y,ZHUANG T Y,et al.Mesostructure-controlled synthesis of chiral norbornane-bridged periodic mesoporous organosilicas[J].RSC Adv,2012,2(5):2010-2014.
[30] JAYALAKSHMI V,WOOD T,BASU R,et al.Probing the pore structure of a chiral periodic mesoporous organosilica using liquid crystals[J].J Mater Chem,2012,22(30):15255-15261.
[31] SEKI T,MCELENEY K,CRUDDEN C M.Enantioselective catalysis with a chiral,phosphane-containing PMO material[J].Chem Commun,2012,48(51):6369-6371.

