糖痹颗粒对糖尿病模型大鼠坐骨神经NGF及SP表达的影响
谢 勤,渠利华 ,陈晓雯
(1.安徽中医药大学,安徽 合肥 230011;2.安徽中医药大学第一附属医院,安徽 合肥 230031)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病临床上常见的慢性并发症之一,该病的病理基础是以高血糖为中心的各种代谢异常和微循环障碍等多种因素而导致的周围神经损伤。糖尿病病程超过10 a,半数以上的患者会合并不同程度的周围神经病变,其发病率随着年龄增长而逐年升高[1]。DPN发病机理尚未完全阐明,神经营养障碍在DPN中的影响机制日益受到人们的关注,目前研究也比较多。现代医学对于DPN的治疗以药物治疗为主,但缺乏特异性治疗方法。目前,中药复方干预DPN神经营养障碍机制的研究越来越受到重视,特别是对神经营养因子及相关神经肽的研究较多,并且取得了一定的成果。本实验主要研究中药复方制剂糖痹颗粒对糖尿病大鼠坐骨神经神经生长因子(nerve growth factor,NGF)及其表达产物 P 物质(substance P,SP)的影响,探讨糖痹颗粒干预DPN神经营养障碍的可能机制。
1 实验材料
1.1 实验动物 清洁级6周龄雄性SD大鼠36只,体重180~220 g,由安徽省实验动物中心提供[动物许可证号:SCXK(皖)2011-002]。
1.2 实验试剂及药物 糖痹颗粒:由黄芪10 g,生地黄 10 g,川芎 6 g,赤芍 10 g,红花 5 g,桃仁 10 g,全蝎3 g,延胡索10 g,僵蚕10 g等组成(广州一方制药厂生产);兔抗鼠NGF多克隆抗体(巴傲得生物科技有限公司,批号:K0151);兔抗鼠SP多克隆抗体(北京博奥森生物技术有限公司,批号:990885W);SP kit(即用型)及DAB显色液(北京中杉生物技术有限公司,批号:K136719H);链脲佐菌素(STZ)(美国Sigma公司生产,北京索来宝科技有限公司分装,批号:20120124)。
1.3 实验主要器材 切片机(Leica RM2135,德国LEICA 公司);显微镜(Nikon 80i,日本 Nikon 公司);自动脱水机(亚光ZT-12M,湖北孝感亚光医用电子有限公司);石蜡包埋机(亚光YB-7B,湖北孝感亚光医用电子有限公司);干燥箱(精宏DHG-9140A,上海精宏实验设备有限公司);冰箱(荣事达BCD-245F,安徽合肥荣事达股份有限公司);JEM-1230型透射电子显微镜(日本电子株式会社)。
2 实验方法
2.1 造模及分组 参照徐雁方法造模[2]。选择清洁级成年雄性SD大鼠36只,体重180~220 g,每笼5只,温度(20±2)℃,湿度 55%~65%,自由饮水,12 h昼夜周期喂养,普通标准饲料适应性喂养1周后,随机分为正常组、模型组、糖痹颗粒组各12只。模型组和糖痹颗粒组禁食12 h后,将链尿佐菌素临用前用0.l mmol/L 柠檬酸钠缓冲液(pH 4.3,4℃)避光条件下配成1%浓度溶液,按50 mg/kg剂量左下腹腔内单次注射,72 h后尾静脉取血,用贝朗血糖测试仪测量血糖,血糖>16.7 mmol/L者确定成模纳入试验。正常组予以注射等量的柠檬酸钠缓冲液。
2.2 给药方法 成模第2天,各组大鼠均予以普通标准饲料喂养8周,同时各组给药如下:糖痹颗粒组大鼠每日生药量根据《中药实验方法学》按成人剂量换算为 1.2 g/(kg·d-1)灌服糖痹颗粒,以生理盐水溶解,每日1次,连续给药8周,每2周记录1次体重、血糖;正常组、模型组灌服相同比例体积的生理盐水,每日1次,连续8周,每2周记录1次体重、血糖。
2.3 取材 末次给药后,大鼠禁食不禁水13~14 h,以10%水合氯醛作腹腔麻醉,根据大鼠体重,注射剂量按350 mg/kg。麻醉成功后,用锋利剪刀近端从坐骨神经切迹处剪断,远端从腓胫神经分叉处剪断,置于中性甲醛中固定,而后石蜡包埋,横断面切片,用于免疫组化检测。同法另取一段坐骨神经,戊二醛、锇酸固定后脱水、包埋,超薄切片,用醋酸铀-枸橼酸铅双染色,透射电镜下观察其超微结构并拍照。
2.4 检测方法
2.4.1 一般情况观察 每2周记录1次各组实验大鼠体重、饮水量、尿量、血糖等一般情况。
2.4.2 透射电镜观察 电镜下观察各组大鼠坐骨神经纤维结构,在高倍镜下拍片,主要观察神经纤维的结构、排列,髓鞘的厚度、形态及板层结构,雪旺细胞的形态、轴突及其内部微丝、微管、线粒体等结构有无变化。
2.4.3 免疫组化检测 ①石蜡切片(Leica RM2135,厚度2 μm)常规脱蜡至水,PBS洗3次各2 min,将切片浸入0.01 M枸橼酸盐缓冲液(pH 6.0),微波炉加热至沸腾后断电7 min左右,间隔2~3 min后,再加热2~3 min,水浴冷却至室温。② 滴加3%H2O2,室温静置10~15 min,PBS洗3次各3 min,滴加正常山羊血清封闭液,室温静置30 min,以减少背景的非特异性颜色,倾去勿洗。③ 依次滴加兔抗鼠1∶250稀释的NGF抗体(另取同一标本切片,P物质抗体的稀释度为 1∶200)50 μL/片,4℃过夜, 过夜后需在37℃复温10~20 min,PBS洗3次,每次5 min。④滴加Ⅱ抗工作液 50 μL/片,37 ℃孵育 30 min,PBS洗3次各5 min;加辣根酶标记链霉卵白素工作液50 μL/片,PBS 洗 3 次各 5 min。⑤ DAB 显色 5~10 min,在显微镜下掌握染色程度,自来水冲洗,苏木精复染1 min,盐酸酒精分化数秒;自来水冲洗15~20 min,梯度酒精脱水,二甲苯透明,中性树胶封片、烤片。⑥ 在高倍视野(40×10)下观察并拍照,神经纤维轴突横断面出现特异性的棕黄色颗粒者为阳性,空白对照依旧为浅蓝色。每张切片观察5个高倍视野,采用JD801图像分析软件计算其光密度值(optical density,OD)。
2.5 统计学处理 全部数据用SPSS 17.0软件包进行统计学处理。连续型变量采用±s表示,同组治疗前后均数比较采用配对t检验,组间比较用方差分析。P<0.05为差异有统计学意义。
3 结 果
3.1 大鼠一般情况的变化 造模成功后,模型组大鼠均有不同程度的尿量增多,饮水量及进食量增加,活动减少,体重下降,精神不振,体毛缺乏光泽,并出现多种糖尿病相关并发症;糖痹颗粒组大鼠的上述情况较模型组有不同程度的改善;正常组大鼠饮水量、进食量、尿量、体重等一般情况均正常。与正常组大鼠比较,模型组、糖痹颗粒组大鼠在2周、4周、8周的空腹血糖值均明显升高,有非常显著性差异(P<0.01);与模型组比较,糖痹颗粒组第8周的大鼠血糖显著下降(P<0.01),第 2、4周比较,均无显著性差异(P>0.05)。说明糖痹颗粒有降低DPN大鼠血糖的作用,见表1。
表1 各组大鼠空腹血糖比较(±s)mmol/L

表1 各组大鼠空腹血糖比较(±s)mmol/L
注:与正常组比较,1) P<0.01;与模型组比较,2) P<0.01。
组 别正常组模型组糖痹颗粒组n 大鼠血糖2周4周8周1210115.48±0.7125.01±3.991)24.44±3.801)5.47±0.6825.86±3.991)22.53±3.391)5.43±0.8326.02±3.791)20.61±2.721)2)
3.2 大鼠坐骨神经超微结构 透射电镜下观察正常组大鼠(图1A)有髓纤维形态规则,髓鞘呈板层样结构,轴突可见神经微丝、微管等细胞器。模型组大鼠(图1B)有髓神经纤维髓鞘结构严重松散、紊乱,板层分离明显,可见指纹样病变以及蜂窝状结构,多个神经纤维髓鞘有水肿和崩解碎片,部分髓鞘出现斑块状脱失和节段性脱髓鞘;有髓神经纤维轴索萎缩、变性,细胞器显示不清,无髓神经纤维线粒体嵴减少,可见毛细血管扩张,充血。糖痹颗粒组大鼠(图1C)神经纤维髓鞘病变较模型组明显减轻,轴突稍萎缩,内可见微丝、微管等结构,髓鞘有轻微分离现象及斑片状变化。
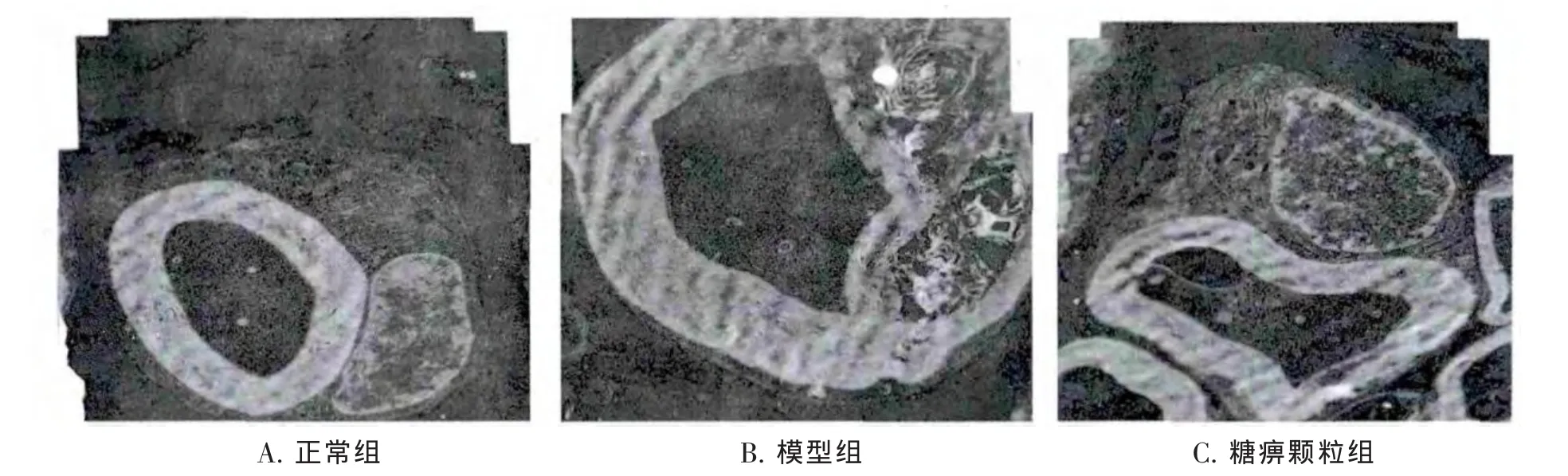
图1 各组大鼠坐骨神经超微结构(×8000)
3.3 大鼠坐骨神经免疫组化结果 NGF阳性表达主要为神经元轴突、髓鞘染成棕黄色颗粒,轴突表达较多,髓鞘表达较少。其中正常组大鼠坐骨神经纤维轴突及髓鞘NGF表达较多;模型组大鼠神经纤维NGF表达很弱,模型组平均光度值明显低于正常组(P<0.01);糖痹颗粒组大鼠神经纤维NGF的表达较模型组有所上调(P<0.05),但与正常组比较有所下降(P<0.05)。SP的表达与NGF大致相同,主要在神经元的轴突及髓鞘,表达量的变化趋势与NGF相似。实验结果表明:糖痹颗粒有上调糖尿病大鼠坐骨神经NGF及SP表达的作用,见表2、图2-7。
表2 NGF及SP的光度值(±s)

表2 NGF及SP的光度值(±s)
注:与正常组比较,1) P<0.05,2) P<0.01;与模型组比较,3) P<0.05。
组 别正常组模型组糖痹颗粒组NGF(OD)0.492±0.0560.391±0.0612)0.441±0.0281)3)n 121011 SP(OD)0.351±0.0480.241±0.0582)0.298±0.0471)3)

图2 正常组大鼠神经纤维NGF表达呈强阳性(×400)

图3 糖痹颗粒组大鼠神经纤维NGF表达较弱(×400)
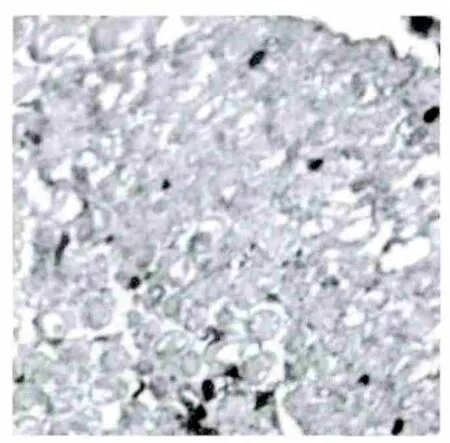
图4 模型组大鼠神经纤维NGF表达很弱(×400)
4 讨 论
DPN发病机理尚未完全阐明,现代医学研究表明DPN的主要机制与代谢紊乱、氧化应激、血液流变性异常、神经营养因子缺乏、免疫因素等有关[3]。目前研究神经营养障碍对DPN的影响机制比较多。NGF是发现最早、研究最深入的一类生长因子,是胚胎感觉、交感神经生长发育必不可少的物质,对成年神经系统功能的维持及结构的完整也具有重要的作用[4]。NGF是交感神经元、感觉神经元和中枢部分胆碱能神经元生长、发育、存活、功能维持所依赖的营养因子。实验研究[5]发现:糖尿病小鼠体内NGF水平降低,随糖尿病病程进展,不同组织的NGF-mRNA进行性下降,尤其是小腿肌肉和坐骨神经,且坐骨神经中NGF mRNA的表达水平与其甩尾潜伏期呈负相关,与机械痛阈值呈正相关。动物实验发现:给予外源性的NGF可以有效诱导损伤的神经再生,并维持外周神经屏障的通透性。糖尿病模型小鼠经NGF治疗,坐骨神经神经纤维细胞中细胞骨架蛋白的密度显著增加,从而促进了内皮细胞的紧密连接,维持了神经纤维的正常功能[6]。
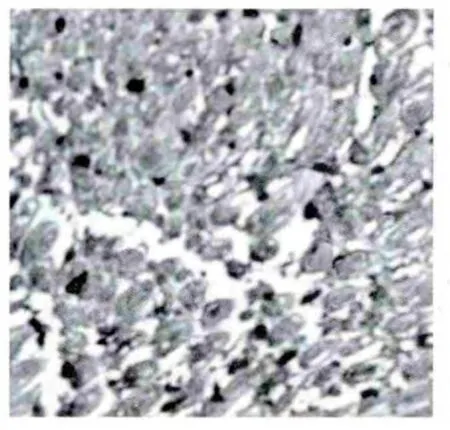
图5 正常组大鼠神经纤维SP表达呈强阳性(×400)

图6 糖痹颗粒组大鼠神经纤维SP表达较弱(×400)

图7 模型组大鼠神经纤维SP表达很弱(×400)
SP是一种合成受NGF调控的神经肽,有扩张血管、传导痛觉等多种作用。SP分布于中枢和外周神经系统及其他组织中,SP作为一种对靶组织起兴奋作用的介质,涉及痛觉传递,也是感觉神经元生长、发育、成熟的标志。SP广泛分布于神经纤维内,能直接或间接通过促进谷氨酸等物质释放参与痛觉传递。在周围神经组织中,NGF可调节神经肽SP的表达,促进SP的发育。糖尿病模型大鼠坐骨神经中SP水平明显降低,痛觉减退是糖尿病神经病变的典型症状,而传导痛觉的介质神经肽SP的减少与痛觉减退相平行[7]。 贾军宏等[8]观察糖尿病模型大鼠坐骨神经SP的变化及NGF对其的影响,结果表明NGF可调节神经肽SP的表达,促进SP的发育,从而维持周围神经的正常感觉功能。
DPN属中医消渴病日久而致的“脉痹”、“血痹”、“痿证”范畴。糖尿病以阴虚燥热为本,日久耗气伤阴,致气阴两虚,气虚无力行血成瘀,阴虚燥热炼液成痰,痰浊阻络,血络不通,“不通则痛”而为痹。DPN的病机总属气虚血瘀,气血不能濡养四肢肌肉筋脉,而致肢体麻木疼痛、下肢拘挛。糖痹颗粒正是针对DPN“气阴两虚、痰瘀内阻”这一关键病机而组方的,全方具有益气养阴、通络止痛之功效。研究[9]表明:活血化瘀等中药具有显著的抗凝、溶栓、扩血管、降低血小板黏聚性及降低纤维蛋白原,改善血液流变性及微循环,并具有一定的软化血管、增加血管通透性等作用,可减轻或消除血管内皮及神经细胞的充血水肿与玻璃样变。实验[10]显示:糖痹颗粒能明显改善DPN患者血液循环及血管功能,改善周围末梢神经的缺血低氧状态,提高神经传导速度,使周围神经获得更多的营养,从而减轻周围神经的损伤,使损伤的神经元得以恢复。
本实验研究表明:糖尿病模型大鼠坐骨神经NGF和相关神经肽SP表达明显减少。糖痹颗粒可降低糖尿病模型大鼠的空腹血糖,有效改善糖尿病模型大鼠坐骨神经病理损伤程度,上调糖尿病模型大鼠坐骨神经NGF及SP的表达量,且主要在神经元的轴突及髓鞘的表达。因此,糖痹颗粒干预DPN神经营养障碍的作用机制可能是通过控制血糖,改善糖尿病大鼠坐骨神经血循环,缓解神经元的缺血、缺氧状态,上调糖尿病模型大鼠坐骨神经NGF及SP的表达量,从而减轻神经元的损伤,促进损伤神经元的修复。
[1]VARKONYI T,KEMPLER P.Diabetic neuropathy.new strategies for treatment[J].Diabetes Obes Meaty,2008,10(2):99-108.
[2]徐雁,杨进.益肾通络法对实验性糖尿病大鼠周围神经病变的保护机制[J].上海中医药杂志,2009,43(9):67-69.
[3]钟美蓉,付秀美,付文亮,等.糖尿病周围神经病变发病机制及中医药治疗研究进展[J].承德医学院学报,2009,26(4):438-440.
[4]张涛静,高彦彬,周晖,等.糖络宁对STZ诱导糖尿病大鼠血清 NGF含量及坐骨神经 NGF mRNA表达的影响[J].江苏中医药,2011,43(2):81-83.
[5]ML,ANDREA M V,EVAL F.The role of growth factors iniabetic peripheral neuropathy[J].Peri Nerv Sys,2004,9(1):26-53.
[6]RENNO W M,SALEH F,KLEPACEK I.Talin immunogold density increases in sciatic nerve of diabetic rats after nerve growth factor treatment[J].Medicina (Kaunas),2006,42(2):147-163.
[7]GARRETT N E,KIDD B L,CRUWYS S C,et al.Streptozotocininduced diabetes decreases substance P levels in experimental arthritis in the rat knee[J].Neurosci Lett,1995,187(3):201-204.
[8]贾军宏,马学毅,田东华,等.神经生长因子对糖尿病大鼠背根神经节坐骨神经P物质变化的影响[J].解放军医学杂志,1998,23(6):420-422.
[9]熊丽丽,杜万红,陈泽奇,等.加味补肝汤对糖尿病周围神经病变大鼠坐骨神经BDNF mRNA表达的影响[J].现代生物医学进展,2009,18(9):3435-3438.
[10]陈晓雯,薛菲,李廷振.糖痹颗粒联合甲钴胺治疗糖尿病周围神经病变 27 例[J].安徽中医学院学报,2011,31(5):10-12.

