Pep-1-vMIP-Ⅱ对小鼠抗HIV-Ⅰ基因表达的作用
高 媛,南玉龙,杨 磊*,谭晓华,尹洪萍,汪 浩
病毒巨噬细胞炎性蛋白Ⅱ(viral macrophage inflammatory protein-Ⅱ,vMIP-Ⅱ)是由人疱疹病毒8(human herpes virus 8,HHV-8)K4基因编码的病毒蛋白,是一种广谱的趋化因子拮抗剂,对CC和CXC类趋化因子受体有高度的亲和性[1]。并抑制I型人类免疫缺陷病毒(human immunodeficiency virus typeⅠ,HIV-Ⅰ)通过共受体CCR3和CCR5以及CXCR4介导进入CD4+靶细胞和巨噬细胞,干扰HIV-Ⅰ的gp120与辅助受体的结合从而抑制 HIV-Ⅰ的感染[2]。Pep-1是一种人工合成的细胞穿膜肽(cell penetrating peptides,CPPs),共 21个氨基酸残基:KETWWETWWTEWSQPKKKRKV[3]。可以高效转移各种天然构象、完全生物活性的多肽和蛋白质进入细胞内而发挥生物效应[4-5]。本研究通过原核表达Pep-1-vMIP-Ⅱ融合蛋白,皮肤涂抹ICR小鼠检测其在不同组织的分布情况以确定其穿透皮肤和生理屏障的功能;检测MX1、MX2、APOBEC3转录本1和2、CCL5等艾滋病抗性基因(AIDS resistance genes,ARGs)[6]mRNA 表达水平,以探讨融合蛋白 Pep-1-vMIP-Ⅱ在影响宿主ARGs表达抵抗HIV-Ⅰ感染中的作用。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级ICR小鼠,体质量(20±2)g,30只,雌雄各半,杭州师范大学实验动物中心提供(合格证号:scxk-0048)。昼夜(12/12 h)节律光照条件下,自由进食饮水,室温18~22℃,单独饲养1 d适应环境后进行实验。实验遵守国家《实验动物管理条例》法律规定保证动物质量。
1.1.2 Pep-1-vMIP-Ⅱ蛋白:菌株 Escherichia coli BL21(DE3)plysS、DH5α、表达质粒 pET11a-Pep-1-vMIP-Ⅱ和pET11a-vMIP-Ⅱ为本实验室保存。
1.1.3 主要试剂:蛋白纯化试剂盒和BCA蛋白定量试剂盒(Pierce公司);超滤管(Millipore公司);预染蛋白质marker(Fermentas公司);RNA提取试剂盒、cDNA反转录试剂盒和SYBR Green荧光实时定量试剂盒(TakaRa大连宝生物公司);生物素化的山羊抗小鼠IgG二抗(武汉博士德生物工程有限公司);定量引物由上海桑尼生物科技有限公司合成;其余常规试剂为进口或国产分析纯。
1.2 方法
1.2.1 细菌转化、培养:用pET11a-Pep-1-vMIP-Ⅱ、pET11a-vMIP-Ⅱ重组质粒转化Escherichia coli BL21(DE3)plysS,形成稳定的高表达细菌株。在含50μg/mL氨苄青霉素和34μg/mL氯霉素的LB平板上划线培养,37℃过夜。挑取单克隆菌落测序正确后,接种至5 mL含50μg/mL氨苄青霉素和34μg/mL氯霉素的 LB培养液,37℃,250 r/min培养至对数生长期,无菌条件下取样检测A600。
1.2.2 蛋白诱导表达纯化:取3 mL上述培养液加入200 mL LB培养基中,37℃ 250 r/min培养至A600约为0.5~1.0。诱导前取1 mL菌液作为未诱导对照。剩余LB加入IPTG至终浓度为0.2 mmol/L、28℃下诱导7 h获得表达量相对较高的可溶性蛋白,经Ni-NTA亲和层析,超滤除盐纯化获得高纯度的融合蛋白Pep-1-vMIP-Ⅱ和vMIP-Ⅱ,15% 分离胶进行SDSPAGE 分析[7]。
1.3 实验方案和分组
纯化获得的融合蛋白分别用PBS(磷酸盐缓冲液,pH值7.35)溶解配制成0.1 g/L终浓度。剔除每只小鼠背部毛发,碘伏、75%乙醇消毒,无菌0.9%氯化钠注射液冲洗,自然晾干后按20μg/只ICR小鼠,涂抹范围2 cm×2 cm,单笼饲养。实验分组(表 1)。
涂抹后2 h心脏穿刺取血后处死小鼠,每组5只。取肾脏等主要组织,4%中性甲醛固定24 h,包埋成0.4 cm×0.3 cm×0.3 cm蜡块,并制备成4μm连续切片,免疫组织化学分析检测vMIP-Ⅱ的穿膜与组织分布情况。涂抹24 h后心脏穿刺取血后处死小鼠,每组5只。血液EDTA抗凝。迅速取材,液氮速冻后转移-80℃保存,提取组织RNA。
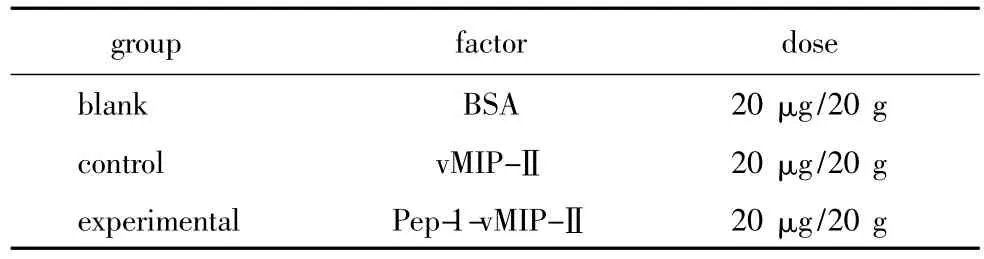
表1 实验分组Table 1 The groups of experiment
1.4 实时定量PCR
测定涂抹Pep-1-vMIP-Ⅱ24 h后ARGs mRNA相对表达水平。
1.4.1 总RNA提取:新鲜血液RNA的提取(100μL全血加2 mL LRNAiso Plus);其余组织-80℃取出后,液氮速冻并研磨成粉末状,按照TakaRa公司技术指南完成组织RAN提取。
1.4.2 反转录 PCR:总 RNA反转录为 cDNA,按TaKaRa反转录试剂盒说明配制。
1.4.3 实时定量PCR:SYBR GreenⅠ荧光染料嵌合法在ABI7300定量PCR仪上检测。根据NCBI数据设计合成小鼠ARGs基因的qRT-PCR扩增引物(表2)。PCR反应体系为:SYBR® Premix Ex TaqTMⅡ(2×)10μL,PCR 正向引物(10μmol/L)0.8μL,PCR反向引物(10μmol/L)0.8μL,ROX Reference Dye(50×)0.4μL,RT产物(cDNA 溶液)2μL,加ddH2O至20μL。反应程序:95℃ 30 s 1个循环;95℃ 5 s,60℃ 31 s 40个循环;95℃ 15 s,60℃60 s,95℃ 15 s1个循环。每个样本做3个复孔,求平均 Ct值,采用 2-ΔΔct法计算相对表达量[8]。
1.5 免疫组织化学分析
vMIP-Ⅱ用0.05%胰蛋白酶修复,37℃ 20 min;vMIP-Ⅱ(1∶25)4℃过夜;余步骤按试剂盒操作。显微镜(Olympus IX51)观察、图像采集系统将3组切片按照同一采集参数拍摄,每张切片随机采集×400图像5张。Image-Pro Plus 6.0分析数据。HIS(H-60;I-255;S-255)选择阳性显色的方法,积分吸光度值(integrated absorbance values,IA)为统计指标。
1.6 统计学分析
GraphPad prism 5.0软件分析并绘制图表,数据以均数±标准差)表示,组化结果采用单因素方差分析和Kruskal-Wallis检验。qRT-PCR结果采用双因素方差分析。
2 结果
2.1 纯化并鉴定Pep-1-vMIP-Ⅱ融合蛋白
相对分子质量12 000 u附近出现特异性条带,与重组表达的融合蛋白Pep-1-vMIP-Ⅱ大小一致(图1)。
2.2 Pep-1-vMIP-Ⅱ在ICR小鼠体内的穿膜情况

图1 融合蛋白Pep-1-vMIP-Ⅱ的诱导表达Fig 1 The induced expression of fusion protein Pep-1-vMIP-Ⅱ

表2 定量引物序列Table 2 Primer sequences used for qRT-PCR
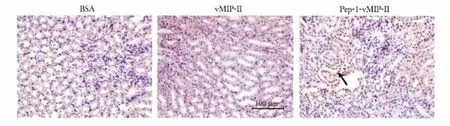
图2 肾脏组织中vMIP-Ⅱ分布情况Fig 2 The distribution of vMIP-Ⅱ in kidney(×400)
Pep-1-vMIP-Ⅱ可以在2 h后穿透细胞膜进入细胞核内,图2黑色箭头所指为阳性表达部位。3组中Pep-1-vMIP-Ⅱ的IA在肾脏内的分布明显增加(p<0.05),Pep-1-vMIP-Ⅱ 组显著高于 BSA和vMIP-Ⅱ组(P <0.05)(表3)。
表3 不同实验组间IA的比较Table 3 Comparisons of IA between BSA,vMIP-Ⅱand Pep-1-vMIP-Ⅱ,n=5)

表3 不同实验组间IA的比较Table 3 Comparisons of IA between BSA,vMIP-Ⅱand Pep-1-vMIP-Ⅱ,n=5)
*P <0.05 compared with BSA and vMIP-Ⅱ.
group IA(x±s)BSA 8 810±479 vMIP-Ⅱ 9 611 ±421 Pep-1-vMIP-Ⅱ 14 103 ±526*
2.3 Pep-1-vMIP-Ⅱ对 ICR小鼠ARGs基因 mRNA表达水平的影响
24 h后,实验组pep1-vMIP-Ⅱ与对照组vMIP-Ⅱ间相比,MX1、MX2在多种组织中表达都显著增加(p<0.05),但MX2在心、肝、脑中的表达变化不显著;CCL5在白细胞、肺、肾、心及肝中表达都显著增加(p<0.05),脑组织中CCL5的表达未见明显差异;APOBEC3转录本1在白细胞中表达显著增加(p<0.05),APOBEC3转录本1和2在其余组织表达未见明显差异(图3)。
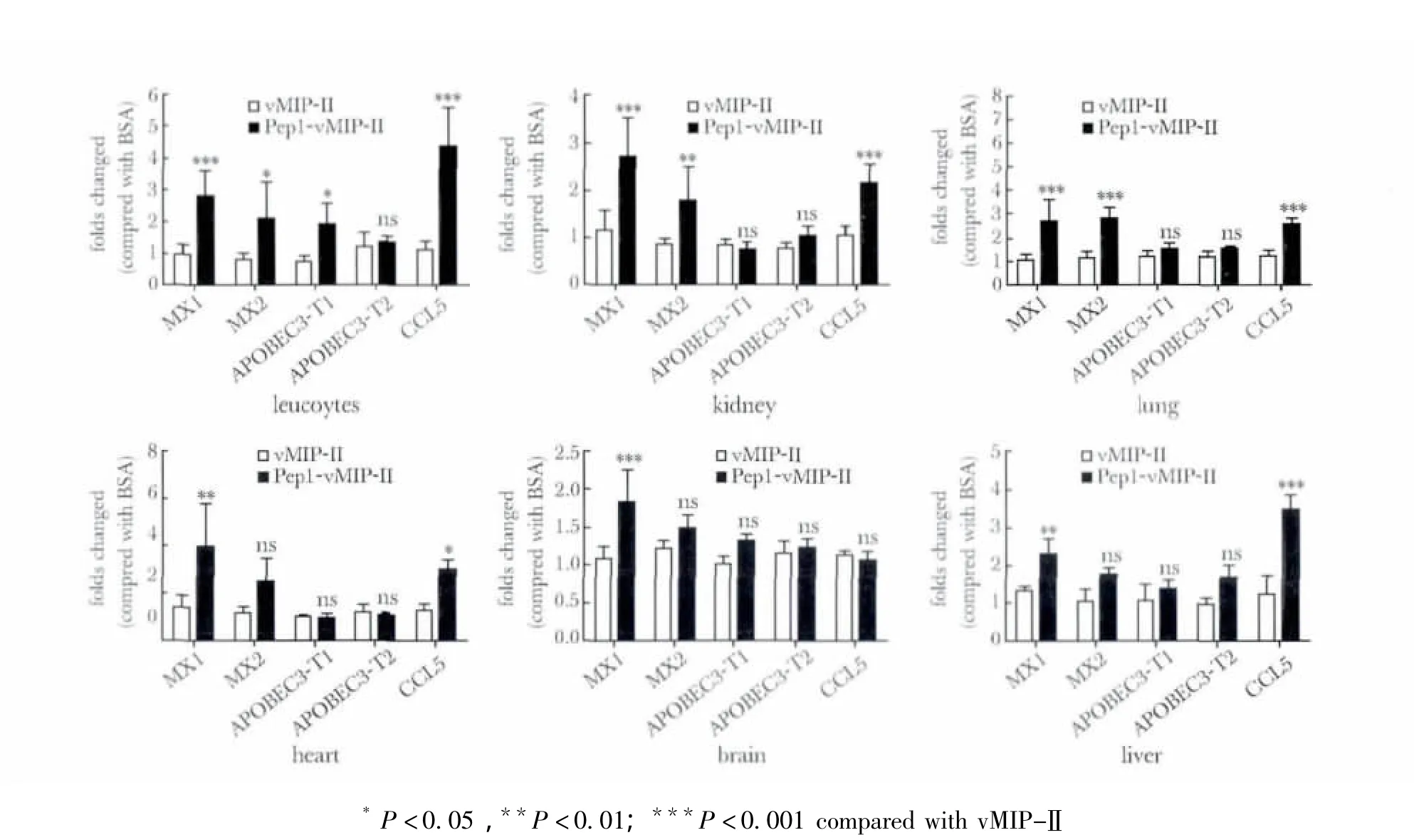
图3 不同组织中ARGs mRNA表达水平Fig 3 Expression of ARGs mRNA levels in different organs,n=5)
3 讨论
本研究结果显示融合蛋白Pep-1-vMIP-Ⅱ可以穿透皮肤、黏膜并进入细胞系内,主要分布于肾脏组织。vMIP-Ⅱ选择性吸引Ⅱ型T细胞改变白细胞的趋化性,是宿主适应性黏膜免疫系统防御病毒入侵的重要机制,也是病毒逃避宿主免疫反应的主要策略[9]。我们前期研究发现,vMIP-Ⅱ可以上调宿主一些ARGs的表达[7],这可能是vMIP-Ⅱ发挥抗 HIV 功能的另一重要分子机制。同时本研究结果表明Pep-1-vMIP-Ⅱ可以上调宿主ARGs基因mRNA表达水平,主要是通过上调CCL5在白细胞、肺、肾、心、肝中表达发挥其生物学功能。vMIP-Ⅱ结合共受体CCR5、CXCR4是 vMIP-Ⅱ抗 HIV-Ⅰ感染关键步骤[10],因此阐明激活体内ARGs基因的表达机制对vMIP-Ⅱ应用于临床防治艾滋病具有重要意义。
有研究发现,vMIP-Ⅱ基因转染HUVEC细胞可以促进 APOBEC3G,RANTES以及 OAS-1,-2,-3等多条ARGs的表达增加[11]。提示KSHV感染可能通过上调机体一系列抗HIV-Ⅰ基因表达发挥抗AIDS的作用,为此本项目研究了Pep-1-vMIP-Ⅱ对ICR小鼠ARGs基因表达的影响。发现广谱抗病毒基因MX1、MX2在多种组织都上调。另有报道猕猴感染猴免疫缺陷病毒后APOBEC3 mRNA水平与血浆病毒载量呈负相关,在长期不进展(LTNPs)阶段 APOBEC3 mRNA水平升高[12]。同时发现在外周血单个核细胞(peripheral blood mononuclear cells,PBMC)主要是CD4+T细胞和艾滋病毒暴露血清阴性反应的个体宫颈癌组织中APOBEC3G表达显著增加[13]。而本研究中APOBEC3转录本1和2未见到明显变化。CCL5 mRNA在白细胞、肾、心、肝、肺多种组织中表达上调。CCL5与 CCR1、CCR3、CCR5结合后,可激活7次跨膜G蛋白耦联受体(GPCRs)途径和磷酸化酪氨酸激酶(PTKs)途径,刺激胞内信号传导,转录因子、核因子活化,特定基因表达或不表达,诱导细胞增殖、凋亡、细胞因子分泌[10,14]。CCL5 通过空间位阻效应阻断 HIV-Ⅰgp120 与 CCR5 结合[15],而Pep-1-vMIP-Ⅱ融合蛋白能够与CCL5竞争性结合,并上调宿主CCL5基因表达水平,主要通过下调CCR5表达阻断受体内吞后的再循环而发挥抗HIV-Ⅰ的作用。
综上所述,Pep-1可以携带vMIP-Ⅱ蛋白进入生物体内,同时vMIP-Ⅱ 作为广谱的人趋化因子受体封闭剂,这两个特性为将Pep-1-vMIP-Ⅱ开发成为一种方便、无痛的药物提供可能,并为HIV-Ⅰ/AIDS的防治提供可能。
[1]Kledal TN,Rosenkilde MM,Coulin F,et al.A broad-spectrum chemokine antagonist encoded by Kaposi's sarcoma-associated herpesvirus[J].Science,1997,277:1656-1659.
[2]Cashin K,Roche M,Sterjovski J,et al.Alternative coreceptor requirements for efficient CCR5-and CXCR4-mediated HIV-1 entry into macrophages[J].JVirol,2011,85:10699-10709.
[3]Morris MC,Deshayes S,Heitz F,et al.Cell-penetrating peptides:from molecular mechanisms to therapeutics[J].Biol Cell,2008,100:201-217.
[4]Deshayes S,Konate K,Aldrian G,et al.Structural polymorphism of non-covalent peptide-based delivery systems:highway to cellular uptake[J].Biochim Biophys Acta,2010,1798:2304-2314.
[5]Kurzawa L,Pellerano M,Morris MC.PEP and CADY-mediated delivery of fluorescent peptides and proteins into living cells[J].Biochim Biophys Acta, 2010,1798:2274-2285.
[6]Sheehy AM,Erthal J.APOBEC3 versus retroviruses,immunity versus invasion:clash of the titans[J].Mol Biol Int,2012,2012:1155-1165.
[7]Yan L,Xiaohua T,Chunhong D,et al.The fusion expression and purification on cell permeable peptide pep-1 and viral macrophage inflammatory protein-Ⅱ[J].Genom Appl Biol,2010,29:1026-1032.
[8]Pfaffl MW.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Res,2001,29:45-50.
[9]Singh UP,Singh S,Ravichandran P,et al.Viral macrophage-inflammatory protein-Ⅱ:a viral chemokine that differentially affects adaptive mucosal immunity compared with its mammalian counterparts[J].J Immunol,2004,173:5509-5516.
[10]Joly M,Pinto JM.CXCR4 and CCR5 regulation and expression patterns on T-and monocyte-macrophage cell lineages:implications for susceptibility to infection by HIV-1[J].Math Biosci,2005,195:92-126.
[11]Cherqui S,Kingdon KM,Thorpe C,et al.Lentiviral gene delivery of vMIP-Ⅱto transplanted endothelial cells and endothelial progenitors is proangiogenic in vivo[J].Mol T-her,2007,15:1264-1272.
[12] Mussil B,Sauermann U,Motzkus D,et al.Increased APOBEC3G and APOBEC3F expression is associated with low viral load and prolonged survival in simian immunodeficiency virus infected rhesus monkeys[J].Retrovirology,2011,8:77-84.
[13]Biasin M,Piacentini L,Lo Caputo S,et al.Apolipoprotein B mRNA-editing enzyme,catalytic polypeptide-like 3G:a possible role in the resistance to HIV of HIV-exposed seronegative individuals[J].J Infect Dis,2007,195:960-964.
[14]Roscic-Mrkic B,Fischer M,Leemann C,et al.RANTES(CCL5)uses the proteoglycan CD44 as an auxiliary receptor to mediate cellular activation signals and HIV-1 enhancement[J].Blood,2003,102:1169-1177.
[15]Dong HF,Wigmore K,Carrington MN,et al.Variants of CCR5,which are permissive for HIV-1 infection,show distinct functional responses to CCL3,CCL4 and CCL5[J].Genes Immun,2005,6:609-619.

