磁性纳米颗粒与脂质体介导REST-siRNA转染hADSCs的比较
王 瑞,庞希宁*,施 萍
人脂肪间充质干细胞(human adipose mesenchymal stem cells,hADSCs)在体外易于分离、扩增,在适当的条件下具有多向分化潜能,并且可以进行自体移植,广泛迁移,易与周围组织整合而发挥功能[1],提示其在细胞治疗中可能成为非常有价值的运载细胞。随着hADSCs在基因治疗中的应用被人们广为认识和研究,如何针对其建立安全、有效又具有优良特性的RNA运载系统已成为现今研究的重点。
目前,基因导入载体主要分为病毒型和非病毒型。病毒型基因载体虽转染效率较高,但具有诱导宿主免疫反应、潜在成瘤性、装载容量有限和代价高等缺点[2]。因此,非病毒基因载体包括磁纳米颗粒和脂质体的应用日益受到重视。脂质体是目前应用较多的非病毒载体;磁性纳米颗粒因具有非侵袭性、低毒性和对细胞膜强大的穿透性等特点,被认为是很有前景的非病毒基因导入载体[3]。
本研究对磁纳米颗粒和脂质体作为基因载体分别转染hADSCs进行了比较。
1 材料与方法
1.1 主要材料与试剂
人皮下脂肪组织样本由中国医科大学附属第一医院外科提供,并与患者签署知情同意书。聚乙烯亚胺包被的磁性纳米颗粒(东纳生物科技有限公司)、DMEM/F12和胎牛血清(Hyclone公司)、100 IU/mL青霉素、100 mg/L链霉素、0.25%胰蛋白酶和MTT试剂盒(Sigma公司)、REST-siRNA(上海吉玛公司)、lipofectamineTM2000(Invitrogen公司)、反转录试剂盒、real-time试剂盒和 real-time引物(Takara公司)、REST一抗(Millipore公司)及二抗(北京鼎国公司)、ECL发光试剂盒 (GE Healthcare公司)。
1.2 方法
1.2.1 hADSCs分离、培养及鉴定:将脂肪组织剪碎,去除血管和筋膜,加入2倍体积胶原蛋白酶Ⅰ在37℃消化1 h,每隔15 min轻柔振荡1次。DMEM/F12培养液加10%胎牛血清进行中止并且离心洗涤2~3次,后转移至培养瓶用DMEM/F12培养液加10%胎牛血清 在5%CO2、37℃饱和湿度孵箱内培养,待细胞80% ~90%汇合后予以传代。取第3代培养细胞进行流式细胞术检测 CD105、CD44和CD45抗原。
1.2.2 磁性纳米颗粒介导REST-siRNA转染hADSCs:取原代分离培养第3代以后的hADSCs接种6孔培养板,当细胞80% ~90%汇合后换液,将PEI-SPIO与REST-siRNA以8∶1混合,室温静置30 min后,将混合物加入到6孔板中,摇动混匀,设置未转染细胞为对照组。
1.2.3 lipofectamineTM2000介导REST-siRNA转染hADSCs:REST-siRNA与lipofectamineTM2000混合比例为0.8μg∶2μL。取 0.8μg REST-siRNA加入无血清培养基稀释至50μL,另取lipofectamineTM2000 2μL加入无血清培养基稀释至50μL,室温静置5 min,二组液体轻轻混匀后,室温静置20 min,然后加至待转染hADSCs无血清培养基中,6 h后更换完全培养基继续培养,设置未转染细胞为对照组。
1.2.4 磁性纳米颗粒和 lipofectamineTM2000分别介导GFP进入细胞情况检测:分别于标记24 h后,用荧光显微镜观察转染进GFP的hADSCs的情况。随机计数显微镜10个视野下发出绿色荧光的细胞数,转染效率 =发出绿色荧光的细胞数/总细胞数×100%。
1.2.5 MTT比色法检测细胞活性:分别将转染48 h后的hADSCs种入96孔板中,检测各孔的细胞成活率及增殖活性。实验重复3次。
1.2.6 实时定量PCR法检测磁性纳米颗粒和脂质体的瞬时干扰效率:分别收集未转染及转染REST-siRNA的hADSCs细胞,用总RNA提取试剂盒提取各组细胞的总RNA。检测浓度,用反转录试剂盒反转录成 cDNA。以 GAPDH为内参,ΔΔCt法计算REST mRNA的相对水平。SYBR Premix Ex TaqTMTaKaRa试剂盒用来实时定量PCR检测目的基因在各组细胞中的表达。所用引物如下:REST上游引物:5'-ATTGAAGTTGGCTTAGTG-3';下游引物:5'-TATGGGTAGATTCGTTGA-3';以GAPDH为内参,上游引物:5'-GCACCGTCAAGGCTGAGAAC-3',下游引物:5'-TGGTGAAGACGCCAGTGGA-3';反应体系:2×SYBR Premix Ex TaqTM10 μL,上下游引物(10μmol/L)各 0.8μL,ROX DyeⅡ 0.4 μL,cDNA 2μL,双蒸水6μL。反应条件为 95℃ 30 s,95℃5 s,60℃延伸34 s,循环40次,做熔解曲线。每个反应有3次重复。
1.2.7 Western blot法检测磁纳米颗粒法和脂质体法瞬时干扰效率:按常规方法收集转染及未转染细胞,加入适量RIPA缓冲液,4℃ 12 000 r/min离心10 min,收集上清。样品经SDS-PAGE后,电转移至PVDF膜上,用5%脱脂奶粉封闭过夜,在10 mL含5%脱脂奶粉的TBST中加入4μL REST抗体,4℃摇床(100 r/min)孵育过夜,然后与辣根过氧化物酶标记的山羊抗兔二抗室温孵育1 h,ECL试剂盒显色。实验重复3次。
1.3 统计学分析
2 结果
2.1 hADSCs的分离、培养及鉴定
人脂肪间充质干细胞在分离后3 d贴壁生长,成长梭形,可见细胞系,分散排列,悬浮的球形细胞经换液后逐渐减少。培养11 d后,倒置显微镜下可观察到细胞克隆,出现致密的贴壁层(图1)。取第3代培养细胞进行流式细胞术鉴定,结果细胞CD105、CD44和CD45表面抗原表达阳性率分别为99.4%、99.7%和2.7%(图2)。
2.2 荧光显微镜观察磁性纳米颗粒和脂质体作为基因载体时的转染效率
转染进GFP的hADSCs发出绿色荧光,磁纳米颗粒和脂质体的转染效率无差异,分别为75%和71%(图3)。
2.3 磁纳米颗粒和脂质体作为基因载体转染hADSCs后对其活性的影响
转染48 h后,未转染组hADSCs的A570为0.80±0.03,磁性纳米颗粒组转染hADSCs的A570为0.75±0.06,脂质体组转染 A570为0.64±0.04(p<0.05)(图4)。

图1 倒置显微镜下观察不同时期培养人脂肪间充质干细胞细胞形态Fig 1 Inverted microscope was used to observe the culture of human adipose mesenchymal stem cells cell morphology in different periods(×40)
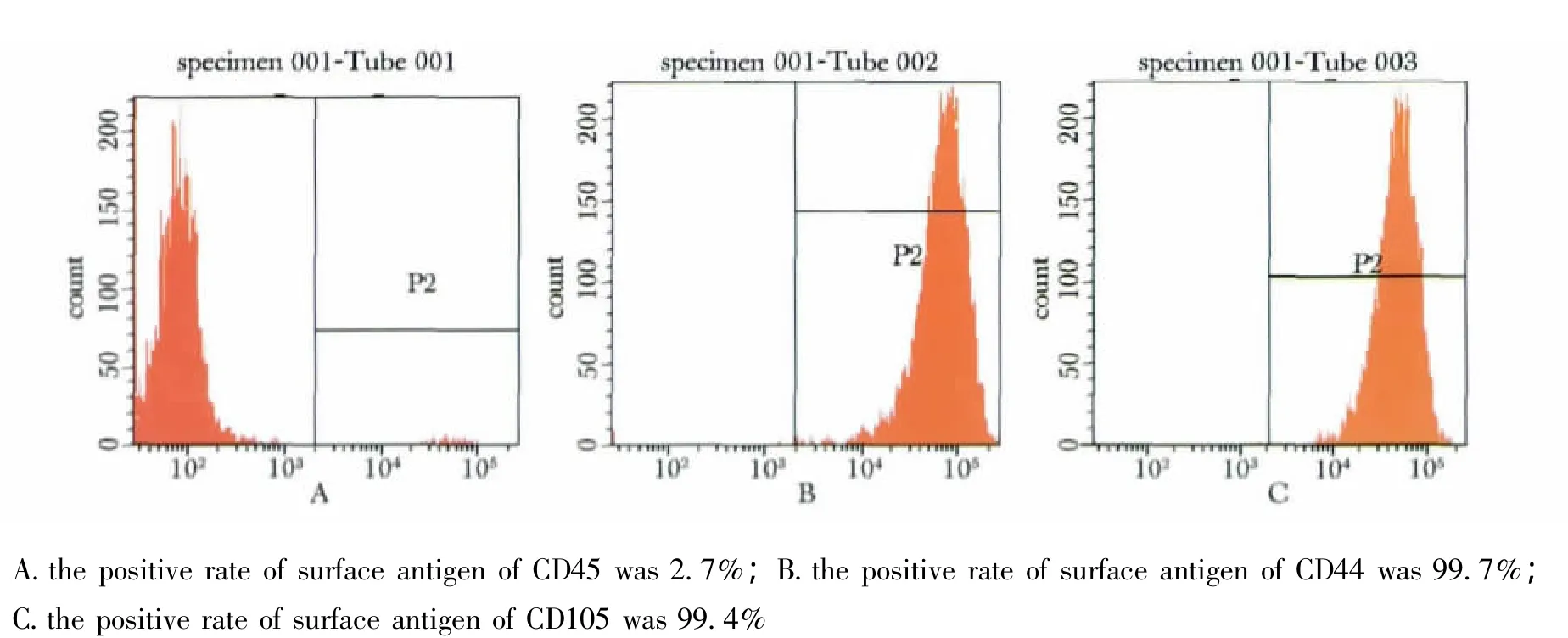
图2 流式细胞术鉴定hADSCsFig 2 Flow cytometry analysis were performed on the hADSCs

图3 荧光显微镜观察磁纳米颗粒与脂质体转染效率Fig 3 Fluorescence microscope was used to observe the transfection efficiency of magnetic nanoparticles and lipofectamineTM 2000(×40)
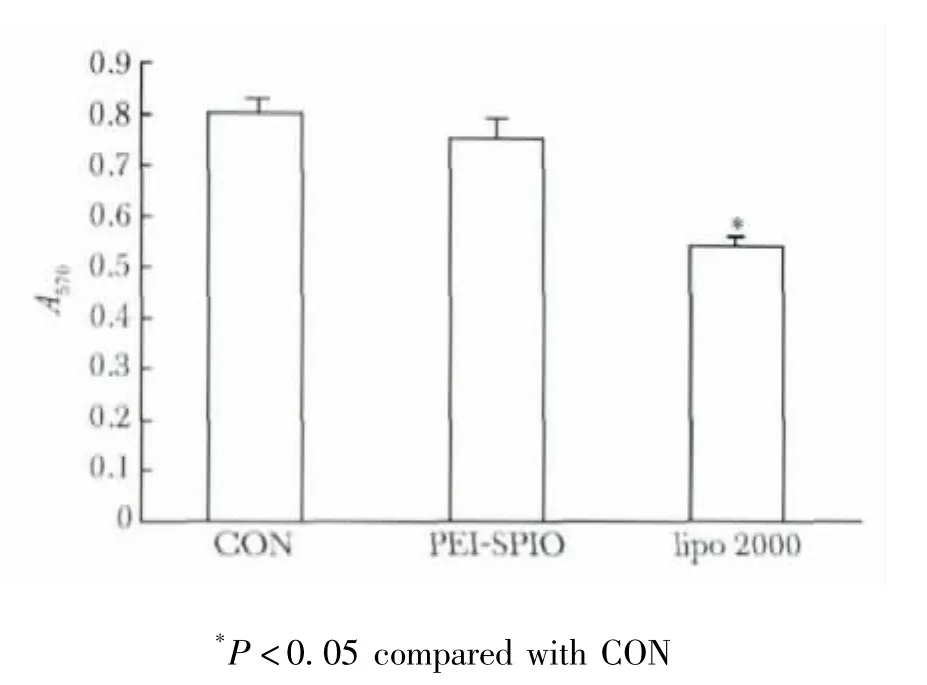
4 MTT法检测磁性纳米颗粒和脂质体转染hADSCs对其增殖的影响Fig 4 Cell proliferation activity was detected with MTT method after magnetic nanoparticles andlipofectamineTM 2000 transfect hADSCs
2.4 Western blot检测磁性纳米颗粒作为基因载体时REST的表达
磁纳米颗粒作为基因载体介导REST-siRNA转染hADSCs后REST的蛋白表达量为0.501±0.006,显著低于对照组的0.924±0.003(p<0.05)(n=3)(图5)。
2.5 Real-time PCR检测磁纳米颗粒作为基因载体时REST的表达
磁纳米颗粒作为基因载体介导REST-siRNA转染hADSCs后REST的RNA表达量为0.46±0.04,显著低于对照组的1.00±0.08(p<0.05)。
2.6 Western blot检测脂质体作为基因载体时REST的表达
脂质体作为基因载体介导REST-siRNA转染hADSC后 REST的蛋白表达量为0.523±0.004,显著低于对照组的1.000±0.007(p<0.05)(n=3)(图6)。

图5 Western blot检测磁纳米颗粒作为基因载体时REST的表达Fig 5 Western blot result of REST expression after magnetic nanoparticles transfect hADSCs
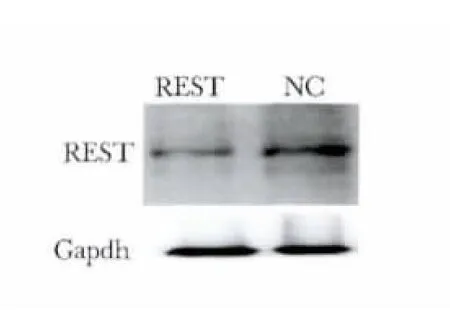
图6 Western blot检测脂质体作为基因载体时REST的表达Fig 6 Western blot result of REST expression after lipofectamineTM 2000 transfect hADSCs
2.7 Real-time PCR检测脂质体作为基因载体时REST的表达
脂质体作为基因载体介导REST-siRNA转染hADSCs后REST的RNA表达量为0.53±0.05,显著低于对照组的1.00±0.04(p<0.05)。
3 讨论
间充质干细胞(mesenchymal stem cells,MSC)不但可以作为种子细胞移植进目标组织内,分化替代为相对应的组织功能细胞,还可以作为基因治疗的载体细胞[4-6]。hADSCs与骨髓来源的 MSC具有相似的多向分化能力,且具有容易获取、体内分布广、取材创伤小、可多次抽取、采集效率高以及细胞获得量大等优点。因此,hADSCs作为种子细胞在组织工程中具有很好的应用前景。
基因转染细胞的方法有病毒载体介导和非病毒载体介导两种。病毒载体虽然转染率高,如慢病毒载体转染 MSCs可有高达95%的转染率[7-8];反转录病毒介导的MSCs转染效率达到80%~90%[9-10],但面临安全性、免疫排斥等问题[10-11]。磁纳米颗粒是目前新兴的非病毒基因转染系统,它是一种MRI对比剂,其特点是粒径小,穿透力强,且具有生物可降解性[12-15]。用磁纳米颗粒标记干细胞,采用核磁共振成像(MRI)进行活体示踪的研究技术在不断完善。脂质体转染方法是目前应用最多的非病毒介导的基因转染系统,但有显著缺点,例如对细胞有明显毒性。故本实验对磁纳米颗粒和脂质体体外转染基因至hADSCs进行了比较,研究新型脂质体LipofectamineTM2000和磁纳米颗粒介导的转染方法应用于转基因细胞移植领域的前景及探讨作为基因转染载体的可行性。结果表明:磁纳米颗粒细胞毒性低于脂质体,转染效率和瞬时干扰效率与脂质体相当,故可代替脂质体作为转染干细胞的基因载体。
[1]Cignarelli A,Perrini S,Ficarella R,et al.Human adipose tissue stem cells:relevance in the pathophysiology of obesity and metabolic diseases and therapeutic applications[J].Expert Rev Mol Med,2012,10:e19.
[2]Kaneda Y.New vector innovation for drug delivery,development of fusigenic non-viral particles[J].Curr Drug Targets,2003,4:599 -602.
[3]Shao Y,Huang W,Shi C,et al.Reversibly crosslinked nanocarriers for on-demand drug delivery in cancer treatment[J].Ther Deliv,2012,3:1409 -1427.
[4] Makhoul G,Chiu RC,Cecere R.Placental mesenchymal stem cells:a unique source for cellular cardiomyoplasty[J].Ann Thorac Surg,2013,95:1827 -1833.
[5]邓玮,陈庆伟,王丽,等.骨髓间充质干细胞移植对缺血心肌的血管新生及增殖凋亡影响[J].基础医学与临床,2012,32:390-395.
[6]栾云.骨髓间充质干细胞移植治疗小型猪急性心肌梗死模型的作用研究[J].基础医学与临床,2012,31:1156-1158.
[7]McMahon JM,Conroy S,Lyons M,et al.Gene transfer into rat mesenchymal stem cells:a comparative study of viral and nonviral vectors[J].Stem Cells Dev,2006,15:87 -96.
[8]Ricks DM,Kutner R,Zhang XY,et al.Optimized lentiviral transduction of mouse bone marrow-derived mesenchymal stem cells[J].Stem Cells Dev,2008,17:441 -450.
[9]Lee K,Majumdar MK,Buyaner D,et al.Human mesenchymal stem cells maintain transgene expression during expansion and differentiation[J]. Mol Ther,2001,3:857-866.
[10]Walsh SR,Wilck MB,Dominguez DJ,et al.Safety and immunogenicity of modified vaccinia Ankara in hematopoietic stem cell transplant recipients:a randomized,controlled trial[J].JInfect Dis,2013,207:1888 - 1897.
[11]Vannucci L,Lai M,Chiuppesi F,et al.Viral vectors:a look back and ahead on gene transfer technology[J].New Microbiol,2013,36:1 -22.
[12]Yeh TC,Zhang W,Ildstad ST,et al.In vivo dynamic MRI tracking of rat T-cells labeled with superparamagnetic iron oxide particles[J].Magn Reson Med,1995,33:200 -208.
[13]Thurman JM,Rohrer B.Noninvasive detection of complement activation through radiologic imaging[J].Adv Exp Med Biol,2013,735:271 -282.
[14]Chi AH,Clayton K,Burrow TJ,et al.Intelligent drug-delivery devices based on micro-and nano-technologies[J].Ther Deliv,2013,4:77 -94.
[15]Zhang LW,Monteiro-Riviere NA.Use of confocal microscopy for nanoparticle drug delivery through skin[J].J Biomed Opt,2013,18:061214.doi:10.1117/1.

