靶向NAC-1基因的siRNA对卵巢癌HO8910细胞生长及其Wnt/β-catenin信号途径的影响
桂 玲,王 静,祝爱珍,刘成成,刘革修*
NAC-1(nucleus accumbens-1,Nac1 or NAC-1)是一干细胞多能性因子,属于BTB/POZ转录因子家族成员,与一些核蛋白相互作用,调节细胞生物学活性,参与胚胎干细胞的自我更新和多能性分化。研究显示卵巢癌细胞表达NAC-1与其紫杉醇耐药相关[1-2]。靶向NAC-1基因的 siRNA 能抑制卵巢癌HO8910细胞生长[3]。但是,NAC-1调节卵巢癌细胞生长的机制还不清楚。大量研究显示,Wnt/β-catenin信号途径在胚胎发育过程中具有重要作用,而异常表达或激活则与肿瘤发生发展密切相关[4-5]。所以,本研究分析了NAC-1基因沉默对卵巢癌HO8910细胞Wnt/β-catenin信号途径及其下游靶基因cyclin D1和survivin基因表达的影响,以了解NAC-1在卵巢癌中的意义。
1 材料与方法
1.1 材料和试剂
人卵巢癌细胞系HO8910(中国科学院上海细胞生物研究所),由暨南大学生命科学技术学院生殖研究室保存;RPMI-1640培养液(Gibco公司);新生牛血清(杭州四季青生物工程科技有限公司);脂质体转染试剂盒LipofectamineTM2000(Invitrogen公司);Trizol、反转录试剂盒和SYBR GreenⅠMix试剂盒(Tiangen公司)、MTT试剂盒、蛋白裂解液和电化学发光(electrochemilum-inescence,ECL)试剂盒(碧云天生物技术有限公司);以NAC-1基因为靶标的特异性siRNA和阴性对照siRNA。
1.2 靶向NAC-1基因寡核苷酸的设计
采用桂玲等[3]前期研究的NAC-1基因特异性siRNA 序 列:5'-UGACAGGCACCAACGUGUACA-3',阴性对照序列为 5'-GACTTCATAAGGCGCATGC-3',均由广州市锐博生物科技有限公司合成及纯化。
1.3 细胞培养和转染
将人卵巢癌细胞系HO8910细胞以1×106个/孔接种于6孔板,用含10%新生牛血清的RPMI 1640培养液培养于CO2体积分数为5%的37℃培养箱中。当细胞生长至70%汇合时,参考试剂盒说明书,用脂质体分别转染各种siRNA(50 nmol/L)。实验分组:空白对照(control)组、阴性 siRNA(negative siRNA)组和NAC-1 siRNAs组。
1.4 MTT法检测细胞增殖活性
[3]。
1.5 克隆形成实验检测干细胞特性
见参考文献[3]。
1.6 FCM法检测细胞周期
见参考文献[3]。
1.7 实时荧光定量PCR法检测mRNA表达
siRNA转染48 h后收集细胞,提取总RNA、并用紫外分光光度计定量,反转录合成cDNA。以cDNA为模板、NAC-1基因特异性引物进行实时荧光定量PCR分析,根据2-△△Ct方法分析目的基因的mRNA相对表达水平。引物序列见表1。
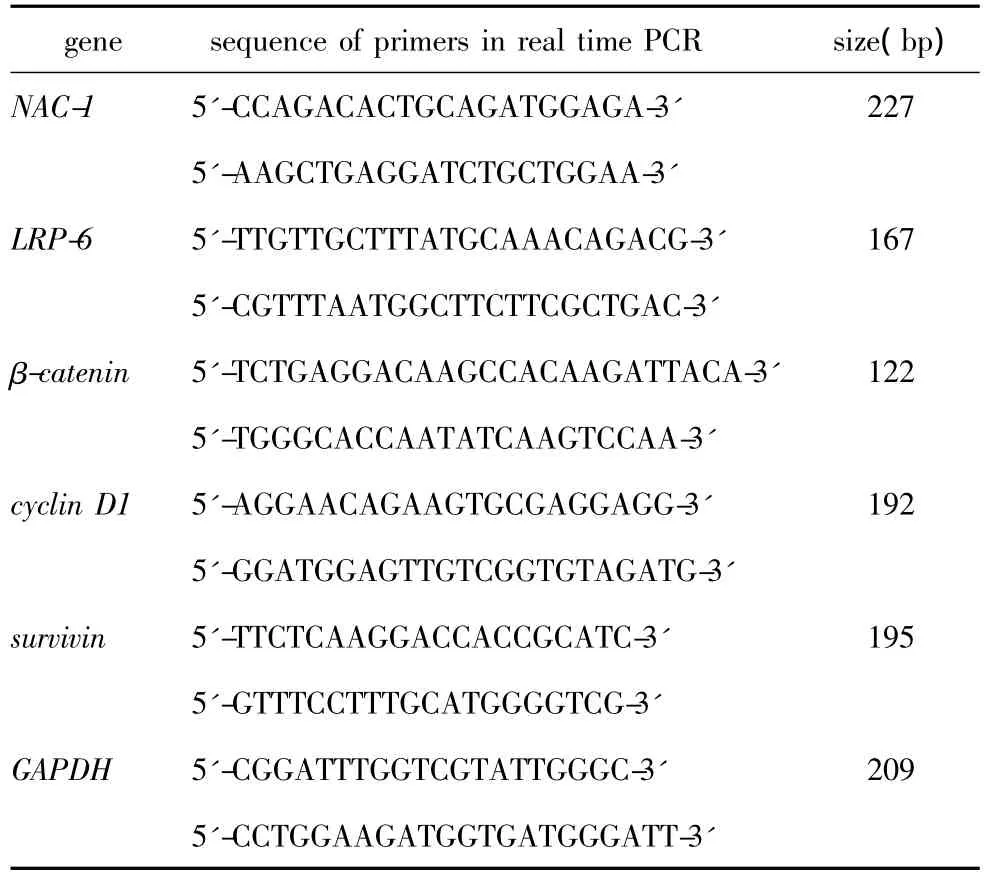
表1 实时荧光定量PCR引物序列Table 1 Primers in real time PCR
1.8 Western印迹法检测
收集细胞提取总蛋白,采用BCA法进行蛋白定量。取等量蛋白50μg上样,进行12%聚丙烯酰胺凝胶,120 V恒压电泳1 h,200 mA恒流转膜1 h。然后,用含5%脱脂奶粉的TBST对膜封闭30 min,加入鼠抗人 NAC-1(1∶200)、β-catenin 抗体(santa Cruz)、cyclin D1抗体、survivin抗体、p-LRP6(Ser1490)抗体(cell signaling)或兔抗人GAPDH抗体于4℃孵育过夜(sigma,1∶4 000),次日加入辣根过氧化物酶(horseradish peroxidase,HRP)标志的相应二抗IgG(稀释比例为1∶3 000)于室温孵育1 h,TBST洗膜10 min×3次,ECL发光显色,采集图像,采用Gelpro4.0软件对目的蛋白进行定量分析。以GAPDH作为内参对照(n=3)。
1.9 统计学分析
2 结果
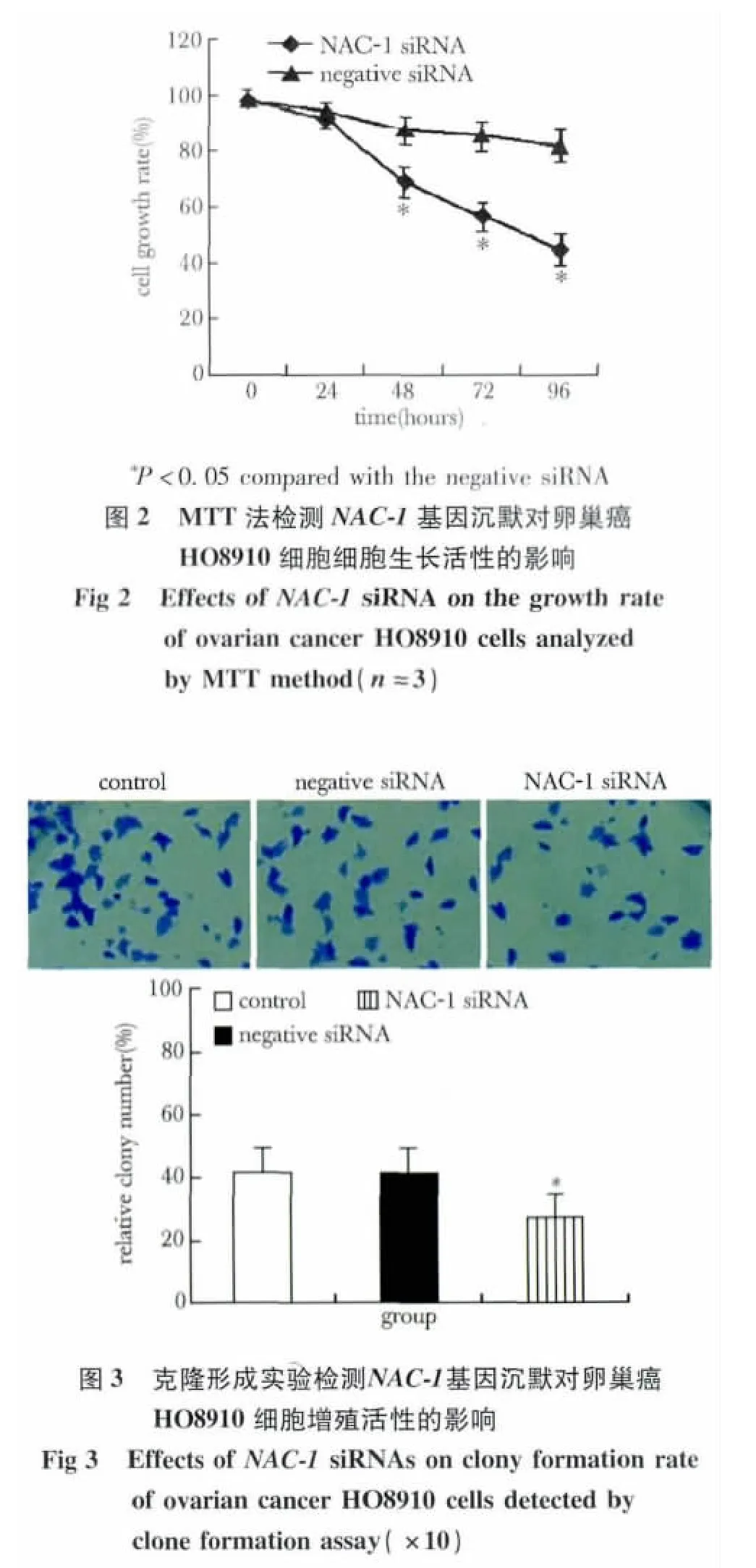
2.1 NAC-1基因沉默对卵巢癌HO8910细胞生长的影响
NAC-1基因特异的siRNA不仅显著抑制卵巢癌HO8910细胞NAC-1基因表达,转染48 h后,NAC-1 mRNA和蛋白表达水平较空白对照组分别下降83%和87%(图1),而且明显抑制HO8910细胞增殖和集落(图2,3)。
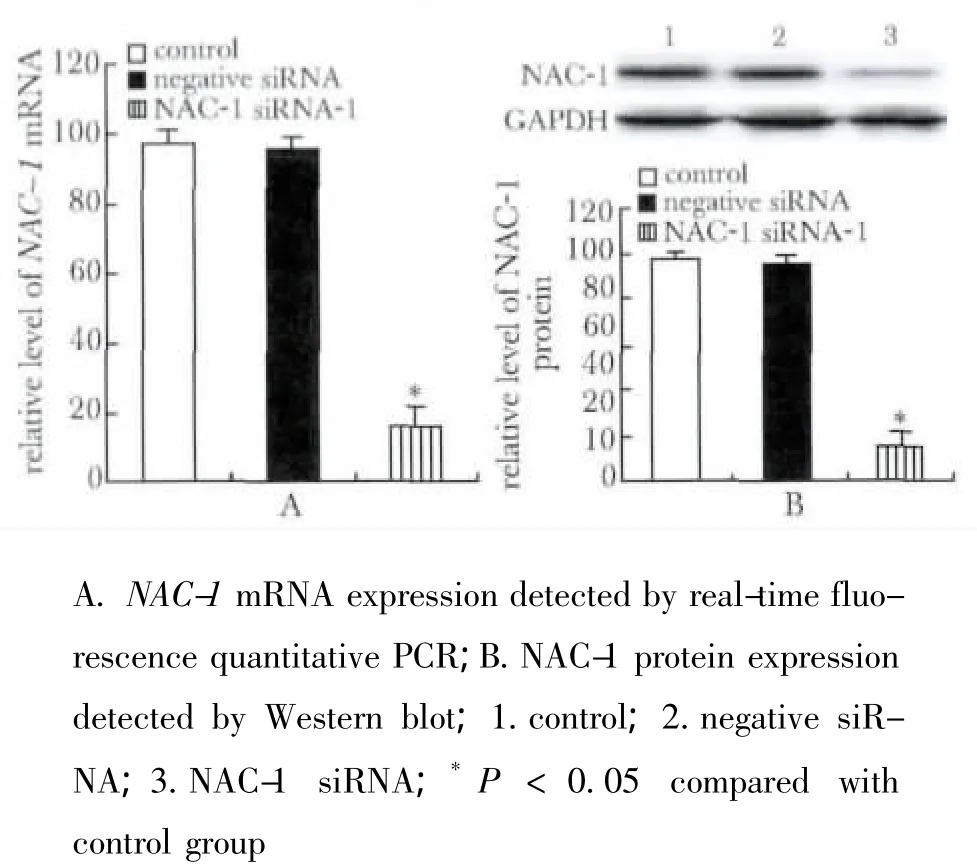
图1 NAC-1基因特异性siRNA对卵巢癌HO8910细胞中NAC-1基因表达的影响Fig 1 Effects of NAC-1 siRNA on the expressions of of NAC-1 mRNA and protein in ovarian cancer HO8910 cells,n=3)
2.2 NAC-1基因沉默对卵巢癌HO8910细胞周期分布的影响
NAC-1基因沉默后G1期细胞比例显著增高,与空白对照组及阴性siRNA组两者细胞周期分布相比较有显著差异(p<0.05)(图4,表2)。
2.3 NAC-1基因沉默对卵巢癌HO8910细胞Wnt/β-catenin信号途径信号分子基因的影响

图4 NAC-1基因沉默对卵巢癌HO8910细胞Wnt/β-catenin信号途径LRP6、β-catenin、cyclin D1和survivin基因表达的影响Fig 4 Effects of NAC-1 siRNA on expression of LRP6,β-catenin,cyclin D1,and survivin genes in ovarian cancer HO8910 cells(n=3)
表2 NAC-1基因沉默对卵巢癌HO8910细胞周期分布的影响Table 2 Effect of NAC-1 siRNA on cell cycle distribution of ovarian cancer HO8910 cells,%,n=3)
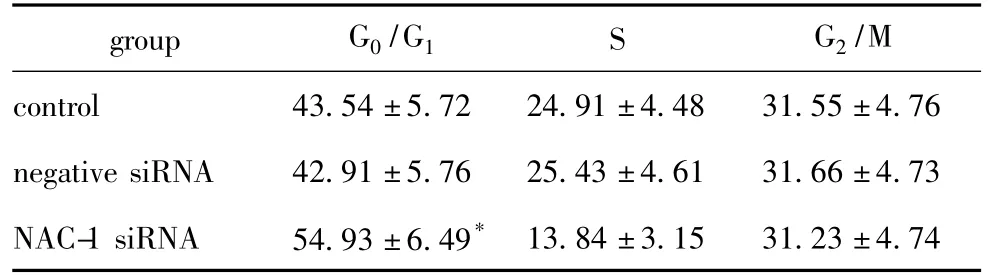
表2 NAC-1基因沉默对卵巢癌HO8910细胞周期分布的影响Table 2 Effect of NAC-1 siRNA on cell cycle distribution of ovarian cancer HO8910 cells,%,n=3)
*P <0.05 compared with the control group.
group G0/G1 S G2/M control 43.54±5.72 24.91±4.48 31.55±4.76 negative siRNA 42.91±5.76 25.43±4.61 31.66±4.73 NAC-1 siRNA 54.93±6.49*13.84±3.15 31.23±4.74
NAC-1基因沉默显著抑制卵巢癌HO8910细胞Wnt/β-catenin信号途径活性:NAC-1 siRNA转染48 h后,β-catenin、cyclin D1和survivin蛋白水平显著低于空白对照组(p<0.01)(图4B);cyclin D1、survivin基因mRNA表达水平则分别较空白对照组下降63%和67%(p<0.01)(图4A)。
3 讨论
经典的Wnt信号传导途径主要成分包括细胞外因子(Wingless,Wnt)、跨膜受体(frizzled,Frz)、辅助受体(LRP-5和LRP-6)、β-catenin等一系列蛋白质,靶基因包括C-MYC、cyclin D1和survivin基因。Wnt/β-catenin信号途径活性主要表现在 p-LRP6和βcatenin蛋白水平的变化,大量游离的β-catenin在胞质中聚集并进入胞核内和T细胞因子(T cell factor/lymphoid enhancer factor,TCF/LEF)结合,并调节靶基因转录。Wnt/β-catenin信号途径在细胞增殖中起重要作用,过度激活时会影响到细胞的增殖、分化,促进肿瘤的发生。靶基因survivin基因在卵巢癌组织中高表达,对卵巢癌发生发展具有重要作用[6-9]。细胞周期蛋白 D1(Cyclin D1)与特定的CDK(周期素依赖性激酶)结合构成复合体,可在G1/S交界处将信号传导途径与细胞周期调控联系起来,完成各个时期的转换。其过度表达可缩短G1期,并减少对生长因子的依赖性,促使细胞越过G0/S和(或)G1/S过渡点而持续分裂增殖,促进肿瘤的生长。本研究则显示,NAC-1基因沉默不仅抑制卵巢癌HO8910细胞生长、阻滞卵巢癌HO8910细胞周期从G1期向S期转化,而且Wnt/β-catenin途径活性下降,即β-catenin蛋白以及下游靶基因cyclin D1和survivin基因表达水平降低。这表明,NAC-1通过增强Wnt/β-catenin途径活性,参与调节卵巢癌细胞的生长和存活。
NAC-1(nucleus accumbens-1)是一个新的干细胞多能性因子,属于 BTB/POZ转录因子家族成员[10],能调节其他多能分化因子的表达,如Nanog、Oct4、Sox2、Klf4、Sall1 和 Sall4 等,参与胚胎干细胞的自我更新和多能性分化,对胚胎干细胞的多能分化是至关重要的。研究发现,卵巢癌化疗后复发的患者体内NAC-1表达水平明显高于初发未治者,并证明其与卵巢癌复发有关[11-12]。研究显示[3],特异性NAC-1 siRNA可沉默卵巢癌细胞中的目的基因NAC-1、并明显抑制其生长,且细胞周期被阻滞于G1期。本研究结果则在这些基础上分析了信号机制。但NAC-1增强Wnt/β-catenin途径活性的机制有待进一步研究。
参考文献:
[1]Nakayama K,Nakayama N,Wang TL,et al.NAC-1 controls cell growth and survival by repressing transcription of Gadd45GIP1,a candidate tumor suppressor[J].Cancer Res,2007,67:8058 -8064.
[2]Jinawath N,Vasoontara C,Yap KL,et al.NAC-1,a potential stem cell pluripotency factor,contributes to paclitaxel resistance in ovarian cancer through inactivating Gadd45 pathway[J].Oncogene,2009,28:1941 -1948.
[3]桂玲,王静,祝爱珍,等.特异siRNA下调卵巢癌H08910细胞NAC-1基因表达并抑制生长[J]。基础医学与临床2012,32:1221 -1223.
[4]Clevers H,Nusse R.Wnt/β-catenin signaling and disease[J].Cell,2012,149:1192 -1205.
[5] Yao H,Ashihara E,Maekawa T.Targeting the Wnt/βcatenin signaling pathway in human cancers[J].Expert Opin Ther Targets,2011,15:873 -887.
[6]Ferrandina G,Legge F,Martinelli E,et al.Survivin expression in ovarian cancer and its correlation with clinicopathological,surgical and apoptosis-related parameters[J].Br JCancer,2005,92:271 -277.
[7]No JH,Jeon YT,Kim YB,et al.Quantitative detection of serum survivin and its relationship with prognostic factors in ovarian cancer[J].Gynecol Obstet Invest,2011,71:136 -140.
[8]Vivas-Mejia PE,Rodriguez-Aguayo C,Han HD,et al.Silencing survivin splice variant 2B leads to antitumor activity in taxane—resistant ovarian cancer[J].Clin Cancer Res.2011,17:3716-3726.
[9]Xing J,Jia CR,Wang Y,et al.Effect of shRNA targeting survivin on ovarian cancer[J].J Cancer Res Clin Oncol,2012,138:1221-1229.
[10]Nakayama K,Nakayama N,Davidson B,et al.A BTB/POZ protein,NAC-1,is related to tumor recurrence and is essential for tumor growth and survival[J].Proc Natl Acad Sci U SA,2006,103:18739-18744.
[11]Ishibashi M,Nakayama K,Yeasmin S,et al.A BTB/POZ gene,NAC-1,a tumor recurrence-associated gene,as a potential target for Taxol resistance in ovarian cancer[J].Clin Cancer Res,2008,14:3149 -3155.
[12]Ueda SM,Yap KL,Davidson B,et al.Expression of Fatty Acid Synthase Depends on NAC1 and Is Associated with Recurrent Ovarian Serous Carcinomas[J].JOncol,2010,2010:285191.

