EphA2在不同肝癌细胞系中过表达及其与乙肝病毒感染相关
王 鹏,朱争艳,李成龙,骆 莹,张海鹏,刘 辉
EphA2是一种受体酪氨酸蛋白激酶,可通过与其配体EphrinAl结合,导致自身及下游底物蛋白的酪氨酸磷酸化,引起一系列生物学效应,参与正常细胞的生长、增殖及转化[1]。研究发现,EphA2受体在多种肿瘤中高表达,这些癌细胞的生长、分化与EphA2的过表达密切相关[2-3]。肝细胞癌(hepatocellular carcinorma,HCC)是最常见的恶性肿瘤之一,其发病隐匿、进展快、恶性度高,易发生侵袭和转移,传统治疗的效果均不甚理想[4],探讨HCC的发病及恶化机制,对降低HCC患者的病死率将具有重要意义。因此,本实验通过检测正常肝细胞系及两种肝癌细胞系中EphA2蛋白的表达,探讨其与肝细胞增殖、凋亡的关系,并通过癌细胞中HBV DNA的定量检测,分析EphA2表达与HBV感染的相关性。
1 材料与方法
1.1 细胞与试剂
人正常肝细胞系HL7702及人肝癌细胞系HepG2、HepG2.2.15(中国协和医科大学基础医学研究所提供)。EphA2(clone C-20)兔抗人多克隆抗体(Santa Cruz公司),免疫组化二抗试剂盒(武汉博士德生物技术有限公司)。HBV DNA定量检测试剂盒(北京达安基因有限公司)。
1.2 细胞培养
将3种细胞系置于DMEM培养液(含10%胎牛血清、青霉素 100 U/L、链霉素 100 g/mL)中,在37℃、5%CO2培养箱中孵育。待细胞处于对数增殖期时,进行传代培养。
1.3 免疫化学染色
取各组细胞爬片,用4%多聚甲醛固定,PBS冲洗,加入3%H2O2室温孵育,PBS冲洗,羊血清室温封闭。滴加EphA2一抗工作液(1∶100稀释),4℃过夜,滴加二抗工作液(1∶200稀释),室温孵育30 min,PBS冲洗,滴加辣根过氧化物酶(HRP)标记的链霉卵白素,室温孵育30 min,PBS冲洗后,DAB显色,常规脱水、透明、封片。阴性对照以 PBS液代替一抗。每张切片随机选择200倍视野,经图像分析系统(BioMias,四川大学)测定各组阳性细胞面积。
1.4 Western blot检测
提取细胞总蛋白,经蛋白定量后,在十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)中电泳,将蛋白转移到聚偏二氟乙烯(PVDF)膜上,置于5%脱脂奶粉的Tris-HCl溶液(TBS)中封闭2 h,加入EphA2一抗工作液,4℃过夜。TBS洗膜后,加入二抗工作液,37℃孵育1.5 h,TBS洗膜,加入HRP标记链霉卵白素工作液,室温孵育1 h,TBS洗膜,采用DAB法显色,结果以目的条带与内参条带(β-actin)吸光度的比值表示。
1.5 流式细胞术(FCM)检测
制备单细胞悬液,调整细胞数为1×106个/mL,加入DNA染液,4℃下染色30 min,以500目筛网过滤,上机检测。激发波长488 nm,以凋亡率表示凋亡状态,利用DNA组方图各时相分布的百分比,用增殖指数(proliferation index,PI)表示细胞的增殖活性,PI=(S+G2/M)/(G0/G1+S+G2/M),每组实验重复3次。
1.6 HBV DNA含量测定
采用荧光定量PCR法检测两种肝癌细胞中HBV DNA的含量,按照试剂盒说明书操作。目标基因mRNA根据标准曲线得出mRNA的分子拷贝数。
1.7 统计学分析
2 结果
2.1 EphA2在各组细胞中的表达
EphA2蛋白阳性表达于胞质与胞膜中,呈棕黄色颗粒,与正常肝细胞中EphA2的染色面积比较,两种肝癌细胞中EphA2的平均吸光度值(累积吸光度值/染色面积,IA/area)显著增大(p<0.05),且HepG2.2.15细胞中EphA2的平均吸光度值显著高于HepG2中EphA2的平均吸光度值(p<0.01)(图1)。Western blot结果显示,与正常肝细胞中EphA2蛋白的表达量比较,两种肝癌细胞中E-phA2蛋白的表达量均显著升高(p<0.01),且HepG2.2.15细胞中EphA2蛋白的表达量显著高于HepG2细胞中EphA2蛋白的表达量(p<0.01)(图2)。
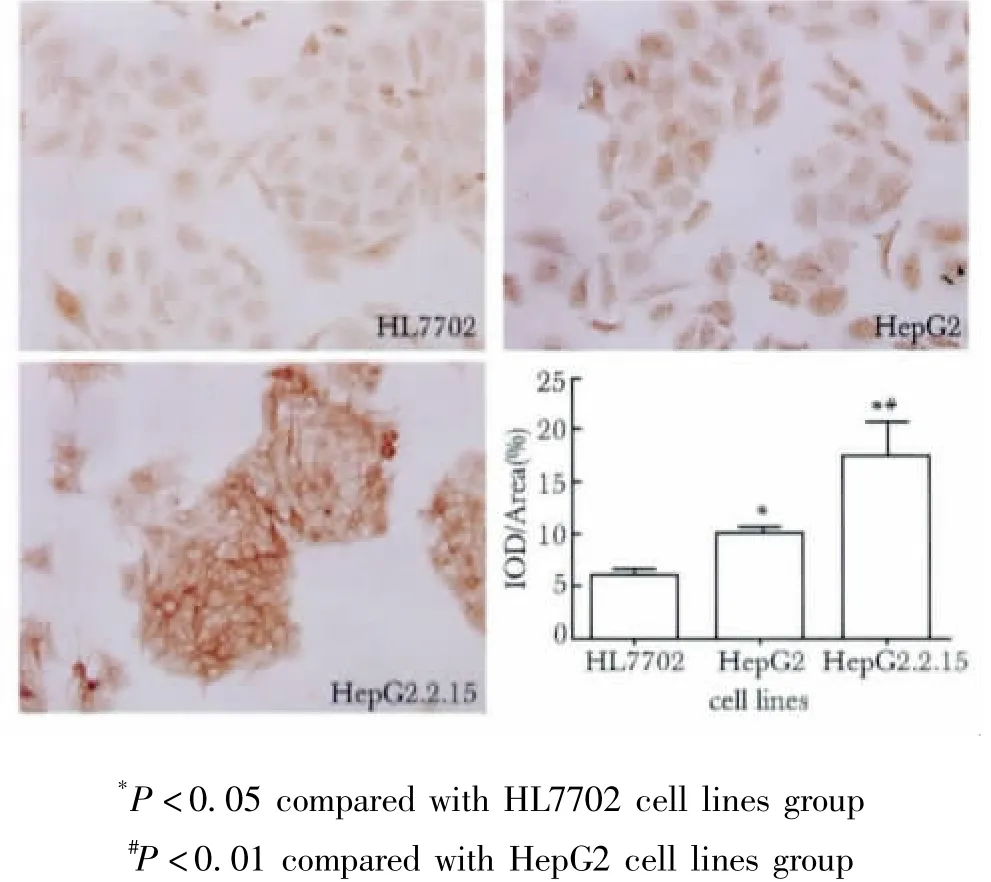
图1 各实验组细胞中EphA2的免疫细胞化学染色结果Fig 1 The EphA2 expression of 3 groups(immunocytochemical staining,×400)
2.2 各组细胞的增殖指数与凋亡率
与正常肝细胞的增殖指数比较,两种肝癌细胞的增殖指数均显著升高(p<0.01),且HepG2.2.15细胞的增殖指数显著高于HepG2细胞的增殖指数(p<0.01)(表1);与正常肝细胞的凋亡率比较,两种肝癌细胞的凋亡率均显著降低(p<0.01),且HepG2.2.15细胞的凋亡率显著低于HepG2细胞的凋亡率(p<0.01)(表1,图3);肝细胞的增殖指数与EphA2表达呈显著的正相关(p<0.01),肝细胞的凋亡率与EphA2表达呈显著的负相关(p<0.01)(图4)。
2.3 肝癌细胞中HBV DNA的含量

图2 各实验组细胞中EphA2的Western blot结果Fig 2 The EphA2 protein expression of three groups
HepG2细胞中 HBV为阴性表达(-),HBV DNA的含量均为0拷贝/mL;而HepG2.2.15细胞中HBV为阳性表达(+),HBV DNA的含量均大于1×106拷贝/mL;肝癌细胞中 HBV DNA水平与EphA2的表达量呈显著正相关(r=0.878,p<0.05)(表2)。
表1 各实验组细胞的增殖指数与凋亡率Table 1 Proliferation index and apoptotic ration of three groups,%)

表1 各实验组细胞的增殖指数与凋亡率Table 1 Proliferation index and apoptotic ration of three groups,%)
*p<0.01 compared with HL7702;#p<0.01 compared with HepG2.
group proliferation index apoptotic ratio HL7702 cell line 30.11±0.18 0.311±0.042 HepG2 cell line 32.01±0.16* 0.169±0.013*HepG2.2.15 cell line 34.83±0.28*# 0.103±0.005*#
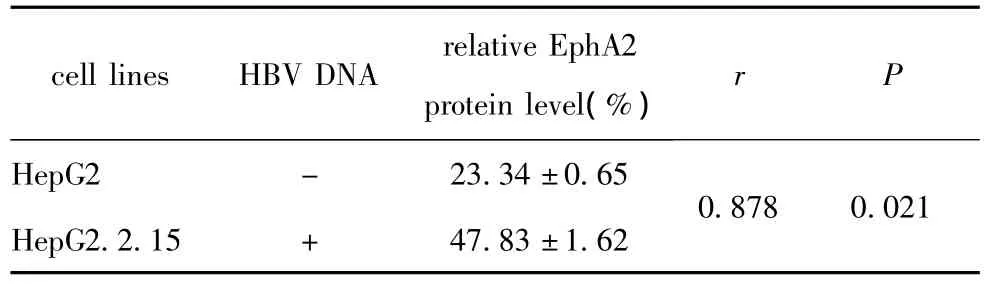
表2 肝癌细胞中HBV DNA水平与EphA2的表达相关性分析Table 2 The correlation between the expression of EphA2 protein and HBV DNA level
3 讨论

EphA2是一种受体酪氨酸蛋白激酶,在生理条件下以低水平广泛表达于各种上皮细胞中,参与细胞的生长、增殖及转化等。研究发现,EphA2受体在多种肿瘤中高表达,这些癌细胞的生长、分化与EphA2的过表达密切相关[2-3]。EphA2 有望成为一个理想的肿瘤标志物,对多种肿瘤的诊断、治疗及预后判断具有重要的临床意义,但关于EphA2在肿瘤发生及恶性进展中的分子调控机制还需进一步深入研究。
肝细胞癌(HCC)是最常见的恶性肿瘤之一,其患病人数正在逐年递增。中国是HCC的高发区,发病率占全球肝癌患者的55%[5]。HCC发病隐匿、进展快、恶性程度高,易发生侵袭和转移,传统治疗的效果均不甚理想,探讨HCC的发病及恶化机制将具有重要意义。研究发现,EphA2在肝癌组织中过表达,可能与肝癌的发生、发展密切相关[6-7]。因此,本实验检测了正常肝细胞系及两种肝癌细胞系中E-phA2蛋白的表达情况,并探讨其与肝细胞增殖、凋亡的关系。结果发现,与正常肝细胞比较,两种肝癌细胞中 EphA2蛋白的表达水平均显著升高,且EphA2蛋白的异常高表达,可促进肝细胞的恶性生长,抑制肝细胞的生理凋亡,提示EphA2蛋白的过表达在肝癌的发生、发展中具有重要作用。
研究发现,乙肝病毒(HBV)感染是引起HBV相关性HCC发病的重要诱因[8]。因此,EphA2蛋白在HCC中的过表达可能与HBV感染具有一定的相关性。本实验通过两种肝癌细胞系中HBV DNA的定量检测,分析EphA2表达与HBV感染的相关性,结果发现HepG2.2.15细胞中HBV DNA水平显著高于HepG2细胞中HBV DNA水平,且HepG2.2.15细胞中EphA2蛋白的表达水平显著高于HepG2细胞中EphA2蛋白的表达水平,HBV DNA水平与E-phA2表达量呈显著正相关,提示在肝癌细胞中E-phA2蛋白的异常高表达与HBV感染密切相关。
[1]Giannoni E,Taddei ML,Parri M,et al.EphA2-m ediated mesenchyma l-amoeboid transition induced by endoth elial progenitor cells enhanc es metastatic spread due to cancerassociated fibroblasts [J]. J Mol Med,2013,91:103-115.
[2]Hou FT,Yuan WJ,Huang J,et al.Overexpression of E-phA2 correlates with epithelial-mesenchymal transition-related proteins in gastric cancer and their prognostic importance for postoperative patients[J].Med Oncol,2012,29:2691-2700.
[3]Liu Y,Yu CY,Qiu YZ,et al.Downregulation of EphA2 expression suppresses the growth and metastasis in squamous-cell carcinoma of the head and neck in vitro and in vivo[J].JCancer Res Clin Oncol,2012,138:195 -202.
[4]Su S,Zhou H,Xue M,et al.Anti-tumor efficacy of a hepatocellular carcinoma vaccine based on dendritic cells combined with tumor-derived autophagosomes in murine models[J].Asian Pac JCancer Prev,2013,14:3109 -3116.
[5]EI-Serag HB,Rudolph KL.Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J].Gastroenterology,2007,132:2557-2576.
[6]Yang P,Yuan W,He J,et al.Overexpression of EphA2,MMP-9,and MVD-CD34 in hepatocellular carcinoma:Implications for tumor progression and prognosis[J].Hepatol Res,2009,39:1169 -1177.
[7]Cui XD,Lee MJ,Yu GR,et al.EFNA1 ligand and its receptor EphA2:potential biomarkers for hepatocellular carcinoma[J].Int J Cancer,2010,126:940 -949.
[8]Dimitroulis D,Valsami S,Spartalis E,et al.Hepatocellular carcinoma in patients co-infected with hepatitis C virus and human immunodeficiency virus [J].World J Hepatol,2013,5:323-327.

