在SW480细胞中沉默survivin基因抑制细胞增殖及hTERT表达
王 平,肖 琳,董俊红,李桂枝,赵春玲,王守训
(潍坊医学院生化教研室,山东潍坊261042)
Survivin是在恶性肿瘤高表达的一种凋亡抑制基因,具有调控细胞周期和细胞凋亡的双重功能[1]。人端粒酶反转录酶(human telomerase reverse transcriptase,hTERT)是维持端粒酶活性最重要的成分,细胞增殖失控与端粒酶的激活有关,端粒酶活化是细胞永生化或恶性转化的关键步骤[2]。目前,关于survivin基因干扰引起的肿瘤细胞的增殖、凋亡抑制的研究较多,但survivin对hTERT基因表达的影响报道较少。Survivin和hTERT的表达存在着相互联系,研究表明[3-4]survivin可能是使端粒酶活性增高的转录因子。本研究设计并构建了靶向survivin基因的shRNA干扰载体,观察survivin基因抑制对细胞增殖的影响,探讨survivin干扰对结肠癌SW480细胞hTERT基因表达的影响,其下调机制可能与Sp1表达下调有关。
1 材料
1.1 材料与方法
人结肠癌SW480细胞系(中科院上海细胞库);pGenesil-1.1质粒(武汉晶塞公司);质粒提取试剂盒(QIAGEN公司);FuGENE HD转染试剂和TRAPELISA试剂盒(Roche公司);兔抗人 survivin单抗(CST公司),小鼠抗人 hTERT和 Sp1单抗(Santa Cruz公司)。细胞周期检测试剂盒(碧云天公司),引物及干扰序列的合成(北京六合华大基因公司)。
1.2 siRNA表达载体的构建
根据 GenBank中 survivin(NM_001168)和 Sp1(NM_138473)的cDNA序列,分别设计3组干扰序列,预实验筛选出高效、特异性强的干扰序列,survivin的靶向干扰序列5'-GGACCACCGCATCTCT ACA-3',Sp1的靶向干扰序列为5'-ATCACTCCATGG ATGAAATGA-3',并设计1条非特异性序列5'-AAG ACTTCATAAGGCGCATGC-3'作为阴性对照。将survivin和Sp1退火片段分别与线性化的pGenesil-1.1载体连接,即为 pGenesil-1.1-survivin和 pGenesil-1.1-Sp1;阴性对照与载体连接产物即为pGenesil-1.1-HK。
1.3 重组质粒转染结肠癌SW480细胞
SW480细胞在含10%胎牛血清的L15培养液(北京迈晨公司),37℃、无CO2培养箱中培养。转染前24 h取对数生长期SW480细胞5×105个接种于6孔板中,观察细胞生长至80%汇合时按照转染试剂盒说明进行转染。实验分对照组(不加任何处理)、阴性对照组(转染 pGenesil-1.1-HK)、survivin-RNAi组(转染 pGenesil-1.1-survivin)和 Sp1-RNAi组(转染pGenesil-1.1-Sp1)。
1.4 MTT检测survivin基因干扰后细胞增殖能力的变化
将构建的pGenesil-1.1-survivin和阴性对照重组质粒转染至6孔板中SW480细胞,每组3个复孔,分别于转染12、24、48及72 h后,加入 MTT溶液(5 g/L)10μL培养箱中继续孵育4 h,每孔加入100μL二甲基亚砜(DMSO),振荡,使结晶物充分溶解,在酶标仪上于570 nm波长测定各孔A值,实验重复3次,计算细胞增殖抑制率(%)=(1-实验组A值/空白对照组A值)×100%。
1.5 MCF法检测survivin基因干扰后细胞增殖周期的改变
将SW480细胞加入6孔板24 h后,转染pGenesil-1.1-survivin重组质粒,同时设置空白对照及阴性对照组,连续培养48 h,收集细胞,1 200 r/min,离心5 min,0.01 mmol/L PBS洗2次,加入70%冰乙醇,4℃固定过夜,离心沉淀并用PBS洗细胞1次,加入质量浓度为10 mg/L碘化丙啶(PI)0.5 mL,37℃避光染色30 min,以流式细胞仪检测细胞周期时相变化。
1.6 Western blot检测RNA干扰对蛋白表达影响
siRNA转染48 h后收集细胞,利用RIPA裂解液裂解细胞提取总蛋白,采用BCA法进行蛋白定量。每孔取50μg蛋白上样进行 SDS-PAGE电泳,产物转移到PVDF膜上,用含5%脱脂奶粉的TBST对膜封闭 1 h,加入一抗(兔抗人 survivin单抗1∶1 000稀释;鼠抗人 Sp1和 hTERT单抗1∶500稀释;鼠抗人β-actin单抗1∶1 000稀释)4℃孵育过夜,次日分别加入HRP标记的二抗(1∶20 000稀释)于室温孵育1 h,洗涤后与ECL化学发光试剂反应处理曝光,对蛋白质条带进行分析。
1.7 实时荧光定量PCR(qRT-PCR)检测RNA干扰对mRNA的影响
将转染48 h后收集的细胞用 Trizol提取总RNA,参照说明书将其反转录为cDNA并进行荧光定量PCR。使用2-△△Ct方法分析相对的基因表达水平。采用Primer 5.0软件设计引物见表1。

表1 本研究中所用到的引物Table 1 The primers used in this study
1.8 TRAP-ELISE法检测端粒酶活性
转染48 h后收集裂解细胞,用BCA法测定蛋白质浓度,取待测样品 50μg,反应体积为20μL,25℃,30 min延伸引物,然后在PCR扩增仪上扩增。取5μL扩增产物,加入20μL变性试剂,25℃孵育10 min,再加入225μL杂交缓冲液,振荡混匀后取100μL混合物加入已包被微孔板的孔中,37℃,300 r/min振荡2 h,弃去杂交液,用缓冲液清洗3次;加入抗地高辛过氧化物酶100μL,25℃,30 min,再用缓冲液清洗5次;加入TMB底物溶液100μL,20 min后再加入100μL终止液终止反应。用酶标仪检测吸光度A值代表端粒酶活性强度,A=端粒酶A450-端粒酶A690。
1.9 统计学分析
2 结果
2.1 MTT法检测survivin基因干扰后细胞增殖能力的变化
随培养时间延长,survivin基因干扰组SW480细胞的增殖明显减慢,24 h以后增殖抑制率明显高于空白对照组和阴性对照组(p<0.05),48 h时抑制率达到34.44%;48 h以后细胞增殖抑制率增加不明显 (图1)。

图1 siRNA-survivin转染对SW480细胞增殖的影响Fig 1 Effects of transfected with siRNA-survivin on proliferation of SW480 cells
2.2 survivin基因干扰对细胞增殖周期的影响
空白对照组和阴性对照组比较,survivin基因干扰组G0/G1期细胞显著增多(p<0.01),S期和G2/M期细胞减少(图2,表2)。
表2 各组细胞周期比率Table 2 Cell cycle distribution rate of groups,%,n=4)

表2 各组细胞周期比率Table 2 Cell cycle distribution rate of groups,%,n=4)
*P < 0.01 compared with control.
group G0/G1 S G2/M control 43.47±1.31 39.27±1.14 17.25±0.57 negative-control 43.46±1.42 39.45±0.84 17.09±0.76 siRNA-survivin 66.50±2.94* 27.36±1.86* 6.14±0.68*
2.3 靶向survivin RNA干扰对hTERT和Sp1基因表达的影响
构建的pGenesi-l.1-survivin对SW480细胞survivin蛋白表达具有明显的干扰效果;同时发现在survivin基因干扰后,hTERT和Sp1的蛋白表达明显降低(图3A);hTERT和Sp1基因的mRNA明显低于空白对照组和阴性对照组 (p<0.01)(图3B)。

2.4 靶向Sp1的RNA干扰对hTERT基因表达的影响
SW480细胞转染pGenesil-1.1-Sp1后,Sp1蛋白表达明显降低,同时发现hTERT蛋白表达也随之降低(图3C);Sp1基因干扰后,hTERT的mRNA表达也降低(p<0.01)(图3B)。
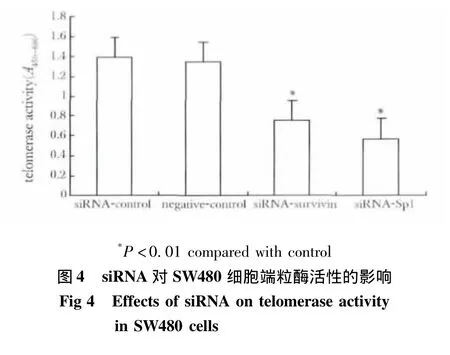
2.5 靶向survivin和Sp1的RNA干扰对端粒酶活性影响
与空白对照组和阴性对照组相比,survivin和Sp1基因干扰可以明显降低端粒酶活性(p<0.01)(图4)。
3 讨论
结肠癌的发生与细胞增殖失控和凋亡异常有关。Survivin特异性的在细胞周期G2/M期表达,通过与细胞有丝分裂纺垂体的微管结合,参与对细胞基因的转录调控;suvrviin又是染色体过客蛋白在细胞分裂晚期参与染色体的分离和胞质分裂的完成[5],因此,survivin在细胞分裂增殖中扮演主要角色。在本研究中,通过构建靶向survivin的RNA干扰表达载体,转染结肠癌SW480细胞,结果显示能有效的抑制SW480细胞的增殖,并呈现时间依赖性。通过细胞周期检测发现survivin基因干扰能够将细胞阻滞在G0/G1期。同时发现survivin的mRNA和蛋白表达都明显降低,与以往研究结果一致[6]。
hTERT是端粒酶活性调节的限速亚单位,与肿瘤细胞端粒酶活性密切相关。无端粒酶活性的正常细胞外源表达hTERT基因能重建端粒酶活性[7],表明肿瘤细胞端粒酶的激活是诱导了hTERT表达的结果,而且是通过转录调控的。Sp1是结合到hTERT核心启动子GC富含位点和激活hTERT转录的关键分子,hTERT启动子富含GC盒,其核心启动子区包含5个Sp1结合位点,每个位点的突变都导致转录活性不同程度地降低,而当5个Sp1位点同时突变,则核心启动子的活性下降至少90%[8],故认为Sp1是一个强大的hTERT转录激活因子。
在本研究中,检测到在survivin基因干扰后,hTERT基因的mRNA和蛋白表达都显著降低,端粒酶活性下降。提示survivin对hTERT基因表达具有一定的调控作用。为进一步了解survivin基因干扰引起的hTERT基因表达下调的机制,构建了靶向Sp1基因的干扰载体,通过对mRNA和蛋白水平的检测,也发现Sp1基因表达降低后,hTERT基因表达同步下调,端粒酶活性降低。研究表明[3-4],survivin通过作用于端粒酶的限速酶hTERT,使其Sp1和C-Myc磷酸化,导致hTERT的酶活性增加,进而表现为端粒酶活性的升高。本研究证实,Sp1沉默后能够有效抑制hTERT的表达,表明Sp1参与SW480细胞中hTERT基因表达调控从而调节端粒酶活性。此外,实验中检测到survivin基因干扰后,Sp1的mRNA和蛋白表达水平同步降低。这些研究结果提示,survivin基因干扰可能是通过Sp1的表达下调,引起的hTERT基因表达降低,其确切机制有待于更深一步研究和探讨。
[1]Mita AC,Mita MM,Nawrocki ST,et al.Survivin:key regulator of mitosis and apoptosis and novel target for cancer therapeutics[J].Clin Cancer Res,2008,14:5000 -5005.
[2]Shammas MA,Koley H,Batchu RB,et al.Telomerase inhibition by siRNA causes senescence and apoptosis in Barrett's adenocarcinoma cells:mechanism and therapeutic potential[J].Mol Cancer,2005,4:24.
[3]Kumari A,Srinivasan R,Wig JD.Effect of c-MYC and E2F1 gene silencing and of 5-azacytidine treatment on telomerase activity in pancreatic cancer-derived cell lines[J].Pancreatology,2009,9:360 -368.
[4]Yuan J,Yang BM,Zhong ZH,et al.Upregulation of Survivin during immortalization of nontransformed human fibroblasts transduced with telomerase reverse transcriptase[J].Oncogene,2009,28:2678 -2689.
[5]Skoufias DA,Mollinari C,Lacroix FB,et al.Human Survivin is a kinetochore-associated passenger protein[J].J Cell Biol,2000,151:1575 -1582.
[6]薛芳,段明英,陈燕.RNAi抑制survivin基因表达增加细胞凋亡[J].基础医学与临床,2009,29:965-969.
[7]Takakura M,Kyo S,Kanaya T,et al.Cloning of human telomerase catalytic subunit(hTERT)gene promoter and identification of proximal core promoter sequences essential for transcriptional activation in immortalized and cancer cells[J].Cancer Res,1999,59:551 -557.
[8] Turner EC,Kinsella BT.Transcriptional regulation of the human prostacyclin receptor gene is dependenton Sp1,PU.1 and Oct-1 inmegakaryocytes and endothelial cells[J].J Mol Biol,2009,386:579 -597.

