骨桥蛋白与基质金属蛋白酶9在子宫内膜病变中的表达
张岩,王雪飞,徐枫,那飞,赵巍
(中国医科大学1.附属第四医院妇科,沈阳110032;2.第95期临床医疗系,沈阳110001)
骨桥蛋白(osteopontin,OPN)是一种分泌型磷酸化糖蛋白,在细胞的恶性转化及肿瘤细胞的侵袭和转移中起重要作用[1],国外有研究报道OPN在子宫内膜癌中高表达[2]。基质金属蛋白酶9(matrixmetalloproteinase9,MMP9)能水解基膜和细胞外基质中的Ⅳ型胶原,与肿瘤的演进相关。目前研究认为OPN可能作为上游基因,使肿瘤细胞表达MMP9增高。本研究检测OPN和MMP9在正常子宫内膜、不典型增生子宫内膜及子宫内膜腺癌组织中的表达情况,探讨OPN和MMP9与子宫内膜癌发生及发展的关系及其在子宫内膜腺癌诊疗及预后判断等方面的潜在价值。
1 材料与方法
1.1 材料
1.1.1 研究对象:2003年12月至2011年2月于中国医科大学附属第四医院妇科就诊的患者因诊治原因获取子宫内膜标本112例,均经病理学诊断证实。其中正常增殖期子宫内膜组织(normal endometrium,NE)15例,不典型增生子宫内膜组织(atypical hyperplasia,AH)22例,子宫内膜腺癌(endometrial adenocarcinoma,EC)75例。所有患者获取标本前均未接受过放、化疗或激素治疗。子宫内膜腺癌患者根据2000年国际妇产科联盟(FIGO)手术病理分期,Ⅰ~Ⅱ期45例,Ⅲ~Ⅳ期30例;组织学分级,G128例,G221例,G326例。
1.1.2 实验试剂:鼠抗人OPN单克隆抗体及鼠抗人MMP9单克隆抗体、DAB显色液试剂盒均购自北京中山生物技术有限公司。
1.2 方法
1.2.1 实验方法:所有标本均在同一条件下采用免疫组化SP法进行染色。用PBS替代一抗为阴性对照,用已知阳性片为阳性对照。
1.2.2 结果判定:OPN和MMP9染色阳性定位主要在细胞质,染色为棕黄色。采用双盲法:随机计数10个高倍镜视野共计1000个腺上皮及肿瘤细胞的阳性细胞数。评分方法:⑴按细胞显色有无及深浅对染色强度评分:0分为无色,1分为浅黄色,2分为棕黄色,3分为棕褐色;⑵按阳性细胞所占的百分比评分:0分为阴性,1分为阳性细胞≤10%,2分为阳性细胞11%~50%,3分为阳性细胞51%~75%,4分为阳性细胞≥75%。每例染色积分为两种评分相乘,进行半定量分析,积分≥3为免疫反应阳性。
1.3 统计学分析
采用SPSS11.5统计分析软件,统计学处理采用χ2检验,检验水准取α=0.05。
2 结果
2.1 OPN、MMP9在不同子宫内膜组织中的表达
OPN、MMP9在正常增殖期子宫内膜组织中为阴性或弱阳表达,在不典型增生组织及子宫内膜腺癌组织中表达增加明显(图1、图2)。本研究在正常增殖期子宫内膜、不典型增生子宫内膜、子宫内膜腺癌中,OPN的阳性表达率分别为26.67%、72.73%和80.00%,MMP9的阳性表达率为20.00%、63.64%和70.67%。2者在不典型增生子宫内膜组织及子宫内膜腺癌中的表达均明显高于正常增殖期子宫内膜组织,差异有统计学意义(P<0.05)。

2.2 OPN、MMP9与子宫内膜腺癌临床病理特征的关系
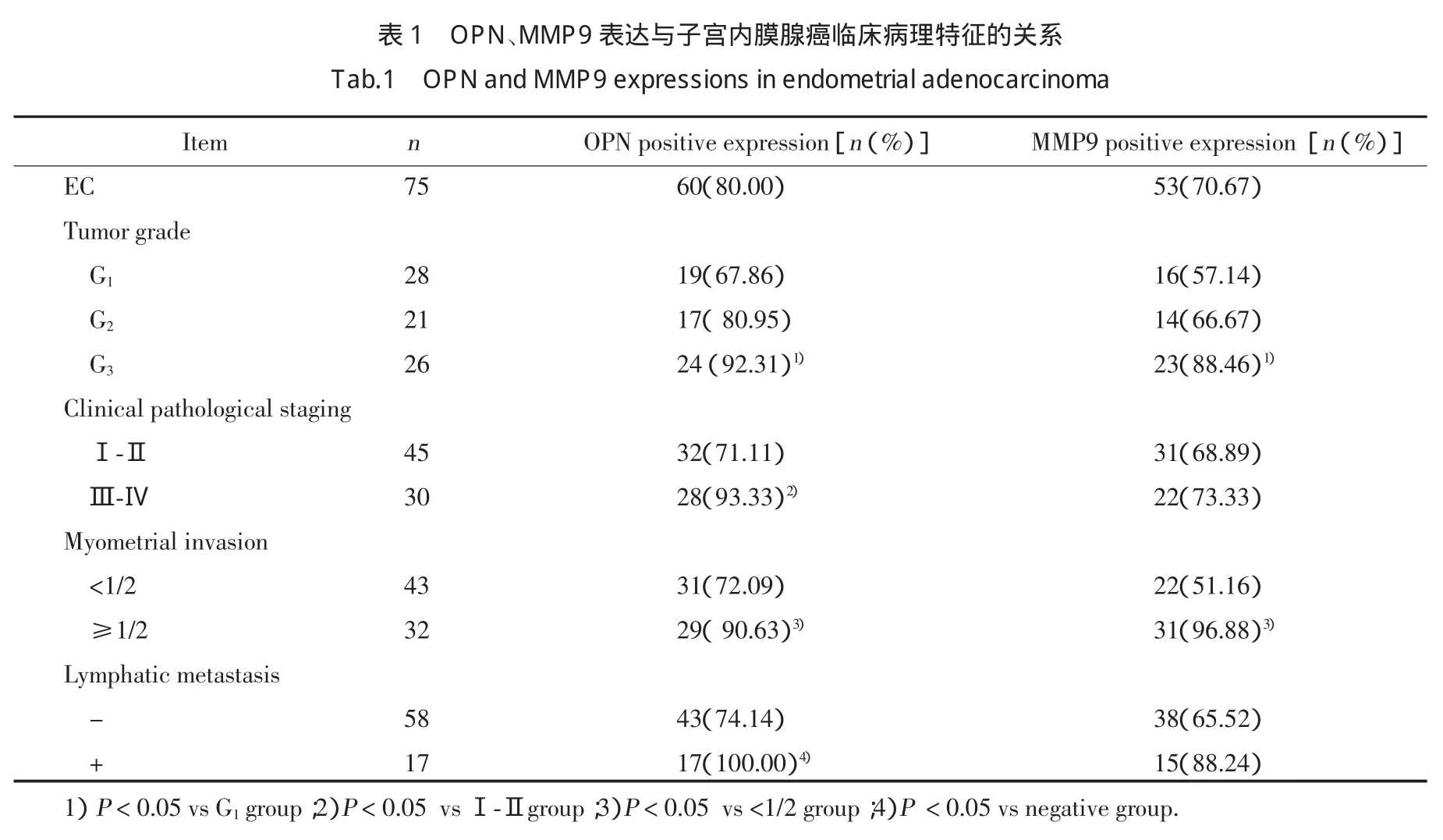
OPN、MMP9均与子宫内膜腺癌组织分级及肌层浸润程度相关,其中低分化腺癌中表达明显高于高分化腺癌(P<0.05)。OPN的表达与临床分期及淋巴转移相关(P<0.05),MMP9的表达在临床分期及淋巴转移方面差异不显著(P>0.05)。见表1。
2.3 OPN与MMP9子宫内膜腺癌中表达的相关分析
OPN和MMP9在子宫内膜腺癌中均呈高表达,二者的表达呈正相关(r=0.287 9,P<0.05)。
3 讨论
OPN 是细胞外基质(extracellularmatrix,ECM)中的一种重要的功能性非胶原蛋白。在肿瘤的发展过程中,OPN通过其分子N端的精氨酸—甘氨酸—天冬氨酸(RGD)结构域,经磷酸化后可以和肿瘤细胞表面的整合素受体结合;C端与黏附分子CD44结合,能强化肿瘤细胞的黏附、趋化和迁移,从而促进恶性肿瘤细胞的侵袭转移。此外,OPN还可促进肿瘤血管生成、抑制肿瘤细胞的凋亡等,在肿瘤的发生发展中起促进作用。OPN在恶性肿瘤组织及血清中的过度表达,与多种肿瘤的发生和侵袭转移有关[3~4]。本研究结果表明,OPN在不典型增生子宫内膜及子宫内膜腺癌中阳性表达率均明显高于正常对照组(P<0.05),因此推测OPN参与子宫内膜细胞恶性转化过程。同时OPN的阳性表达与肿瘤的组织分级、肌层浸润、临床分期及淋巴转移呈正相关(P<0.05),证实了OPN与子宫内膜腺癌的发生发展过程密切相关。
MMP9以酶原形式分泌,被激活后可降解肿瘤表面ECM中Ⅳ、Ⅴ型胶原及明胶,促进肿瘤细胞向周围组织侵袭及侵入淋巴及血管向远处转移。目前通过分子生物学等研究认为MMP9参与了肿瘤发生、侵袭及转移的多个阶段[5]。王香平等[6]检测发现子宫内膜癌患者血清中MMP9活性形式的表达高于对照组,而其酶原形式的表达没有差异,表明MMP9活性形式在子宫内膜癌的组织中起主要作用。本研究显示MMP9在子宫内膜不典型增生及子宫内膜腺癌组织中高表达,并与子宫内膜腺癌的组织分级及肌层侵润正相关(P<0.05)。可见在内膜癌的发生发展中MMP9的阳性表达及酶原激活增加,MMP9的高表达预示着内膜癌的生物学行为恶劣,预后差。
本实验对OPN、MMP9在子宫内膜病变及内膜癌中表达的相关性进行研究,结果显示2者在子宫内膜癌变过程中有相关性。在内膜癌的发生发展过程中OPN可通过激活丝裂原激活的蛋白激酶(motigen-activated protein kinase,MAPK)/核因子 κB抑制剂激酶(I kappaB alpha kinase,IKK)信号通路,使肿瘤细胞分泌MMP9等基质金属蛋白酶及尿激酶型纤溶酶原激活物(uPA)等[1],促进细胞的黏附和迁移,介导肿瘤细胞的侵袭转移[7]。体外细胞培养实验研究发现OPN可通过ERK/IKKα/β途径激活核因子诱导激酶而活化核转录因子κB,增强其调控uPA分泌和uPA依赖性蛋白MMP9的活化[8]。同时MMP9可作用于OPN分子中的MMP的酶切位点,正向调节OPN与细胞表面的整合素结合。此外2者均可促进肿瘤血管生成[9,10],参与肿瘤细胞的免疫逃逸,有关2者在此方面是否具有关联性及协同作用,有待于进一步研究。
综上所述,本研究认为OPN和MMP9与子宫内膜腺癌的发生、发展有密切的关系,能够反映肿瘤的恶性程度,通过对2者的检测将有助于判断患者的预后,同时也为临床诊治子宫内膜癌提供依据。
[1]Rittling SR,Chambers AF.Role of osteopontin in tumour progression[J].Br J Cancer,2004,90(10):1877-1881.
[2]Coppola D,Szabo M,Boulware D,et al.Correlation of osteopontin protein expression and pathological stage across a wide variety of tumor histologies[J].Clin Cancer Res,2004,10(1):184-190.
[3]Macrì A,Versaci A,Lupo G,et al.Role of osteopontin in breast cancer patients[J].Tumor,2009,95(1):48-52.
[4]于洪波,韩小兵,梁宜骞,等.OPN及survivin在前列腺癌组织中的表达及临床意义[J]. 南方医科大学学报,2010,30(5):1141-1143.
[5]Lee SO,Jeong YJ,Kim M,et al.Suppression of PMA-induced tumor cell invasion by capillarisin via the inhibition of NF-kappaB-dependent MMP-9 expression[J].Biochem Biophys Res Commun,2008,366(4):1019-1024.
[6]王香平,陈升平,周莲娥.血清明胶酶(MMP-2、MMP-9)与子宫内膜癌[J].首都医科大学学报,2005,26(3):356-357.
[7]Weber GF,Zawaideh S,Hikita S,et al.Phosphorylation-dependent interaction of osteopontin with its receptors regulates macrophage migration and activation[J].J Leukoc Biol,2002,72(4):752-761.
[8]Rangaswami H,Bulbule A,Kundu GC.Nuclear factor inducing kinase:a key regulator in osteopontin-induced MAPK/IkappaB kinase dependent NF-kappaB-mediated promatrix metalloproteinase-9 activation[J].Glycocon J,2006,23(3-4):221-232.
[9]Wang Y,Yan W,Lu X,et al.Overexpression of osteopontin induces angiogenesis of endothelial progenitor cells via the avβ3/PI3K/AKT/eNOS/NO signaling pathway in glioma cells[J].Eur J Cell Biol,2011,90(8):642-648.
[10]Vinothini G,Aravindraja C,Chitrathara K,et al.Correlation of matrix metalloproteinases and their inhibitors with hypoxia and angiogenesis in premenopausal patients with adenocarcinoma of the breast[J].Clin Biochem,2011,44(12):969-974.

