丝胶对糖尿病大鼠肾脏ERK信号通路的影响
郝祥俊,于晓敏,宋成军,王小杰,陈志宏
(承德医学院1.人体解剖学教研室;2.教务处;3.基础医学研究所,河北 承德06 7000)
细胞外信号调节激酶(extracellular signal regulated kinase,ERK)是丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)家族的一个亚族,可被多种生长因子和细胞因子激活,介导细胞的生长、增殖和分化等。已有研究发现[1,2],无论是糖尿病模型大鼠还是糖尿病患者,肾脏ERK蛋白的含量及活性均明显升高;同时,肾脏细胞增生、肥大,细胞外基质(extracellular matrix,ECM)增多等糖尿病肾病(diabetic nephropathy,DN)的典型病理改变与ERK信号通路的激活密切相关。
目前,随着糖尿病发病率的迅速上升,DN的发病率也逐渐升高。临床上主要用西药治疗糖尿病及其并发症,但西药的不良反应不容忽视。丝胶是蚕茧中具有多种生物活性的天然蛋白质,民间有蚕茧泡水降血糖的验方,本课题组的前期工作[3]已经证明,丝胶可降低糖尿病模型大鼠的血糖,保护糖尿病导致的生殖功能障碍。本研究旨在探讨丝胶对糖尿病模型大鼠肾脏ERK信号转导通路的影响及可能机制,以期为临床治疗DN提供新思路。
1 材料与方法
1.1 实验动物分组及处理
48只雄性清洁级SD大鼠,由河北医科大学实验动物学部提供(合格证号712024),体质量200~250 g。随机选取12只作为正常对照组,不作任何处理;余下的36只建立2型糖尿病大鼠模型:2%链脲佐菌素(25 mg/kg)连续腹腔注射3 d,成模标准为注射链脲佐菌素1周后空腹血糖≥16.7 mmol/L[4]。模型成功建立后36只大鼠随机均分为糖尿病模型组、丝胶治疗组和二甲双胍组,糖尿病模型组大鼠不再作任何处理,丝胶治疗组大鼠灌胃给予丝胶(2.4 g·kg-1·d-1)35 d,二甲双胍组大鼠灌胃给予二甲双胍(55.33 mg·kg-1·d-1)35 d。
1.2 药物与试剂
丝胶由彩色蚕茧(由承德医学院蚕业研究所提供)经浸泡、水煎、过滤、浓缩而成;盐酸二甲双胍(国药准字H21024375,辽宁一成药业有限公司)临用时用蒸馏水配成溶液。链脲佐菌素(美国Sigma公司)用枸橼酸钠—枸橼酸缓冲液(pH=4.4)配成2%的溶液。检测血糖试剂盒(保定长城临床试剂有限公司)、BCA蛋白定量试剂盒(北京泰格美科技有限公司),兔抗pERK1/2抗体、兔抗丝裂原活化蛋白激酶的激酶(mitogen-activated protein kinase kinase,MEK)1/2抗体、兔抗c-fos抗体(北京博奥森生物技术有限公司),小鼠抗β-actin单克隆抗体(美国Santa Cruz公司)、山羊抗兔、小鼠IgG(美国KPL公司),ERK、MEK、c-fos引物由上海生工生物工程有限公司合成,Trizol(美国Invitrogen公司)、一步法RT-PCR试剂盒(大连宝生物工程有限公司)。
1.3 检测血液指标
4%水合氯醛腹腔注射麻醉大鼠,经内眦于眶后静脉丛采血后离心(3000 r/min,20 min),取血清-20℃保存。采用葡萄糖氧化酶法、使用Boehr inger Mannhe in/Hitachi 717全自动临床生化分析仪检测血糖。
1.4 肾脏ERK信号通路相关因子表达的检测
大鼠取血后断头处死,取肾脏入液氮保存。
1.4.1 Western blot法检测各组大鼠肾脏 ERK、MEK、c-Fos蛋白的表达:取液氮保存肾脏100 mg提取蛋白,加入蛋白裂解液冰上裂解肾脏组织,BCA蛋白试剂盒测定蛋白浓度。蛋白上样量80 μg,15%SDS-PAGE凝胶电泳、PDVF膜转膜;封闭后加入一抗[β-actin(1∶1000)、MEK1/2(1∶100)、pERK1/2(1∶100)、c-fos(1∶100)],4 ℃孵育过夜;加入 HRP标记的二抗(1∶5000),室温摇床孵育1 h,Super ECL Plus超敏发光液显影。采用Quantity One-4.6.2软件分析胶片扫描后的显影条带,以目的条带和βactin条带的灰度比值作为ERK、MEK、c-Fos蛋白的相对表达水平。
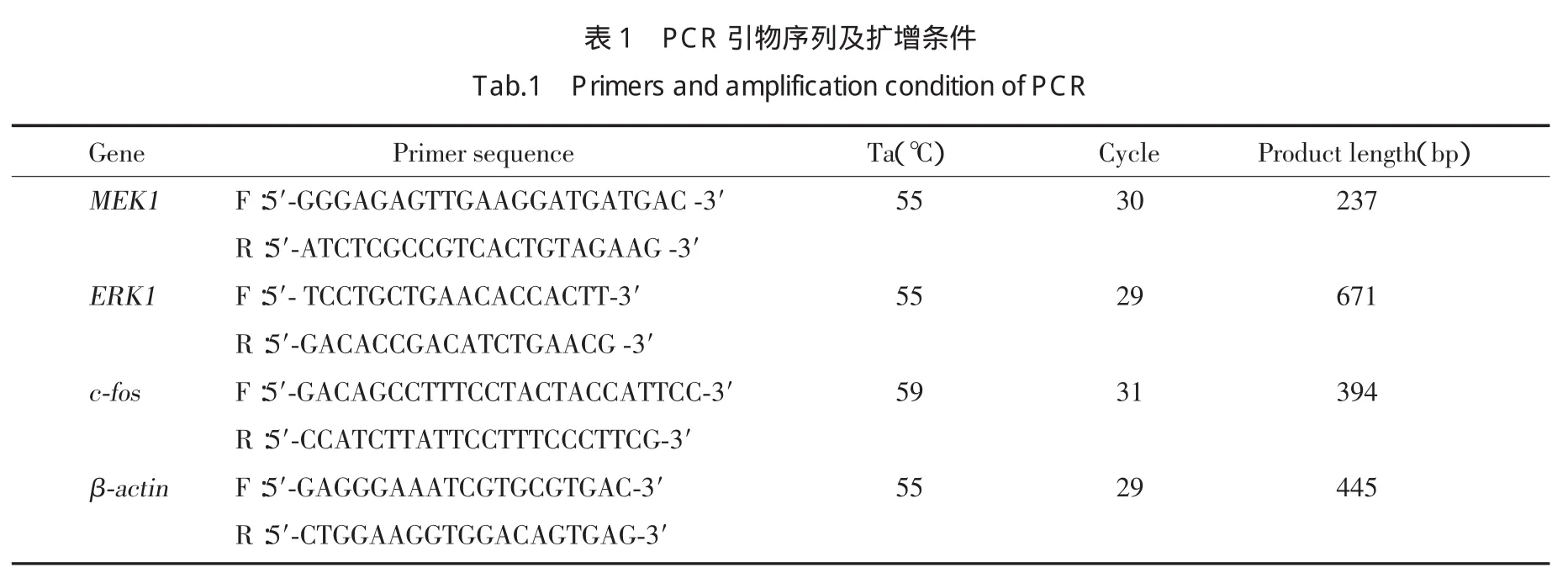
1.4.2 RT-PCR法检测各组大鼠肾脏ERK、MEK、cfosmRNA的表达:取液氮保存肾脏(100 mg),按Trizol试剂说明提取肾脏的总RNA,并反转录成cDNA,产物进行PCR。PCR引物序列、扩增条件及产物长度见表1。PCR反应体系50 μL,PCR反应条件:94℃预变性2 min,94℃变性30 s,50~65℃退火30 s,72℃延伸1 min,第2步起循环。取5 μL扩增产物及5 μL的DNA Ladder行2%琼脂糖凝胶电泳(90 V,40 min),ZF 型紫外透射反射分析仪摄像,Quantity One-4.6.2软件进行分析,以目的条带和β-actin条带吸光度的比值,作为ERK、MEK、c-fosmRNA的相对表达水平。
1.5 统计学分析
2 结果
2.1 各组大鼠的血糖结果
与正常对照组大鼠血糖[(10.83±2.03)mmol·L-1]比较,糖尿病模型大鼠的血糖[(29.45±4.82)mmol·L-1]明显升高(P<0.01);与糖尿病模型组大鼠比较,丝胶治疗组 [(13.20±4.09)mmol·L-1]、二甲双胍组[(13.18±2.30)mmol·L-1]大鼠的血糖明显降低(P <0.01)。
2.2 各组大鼠肾脏ERK的表达
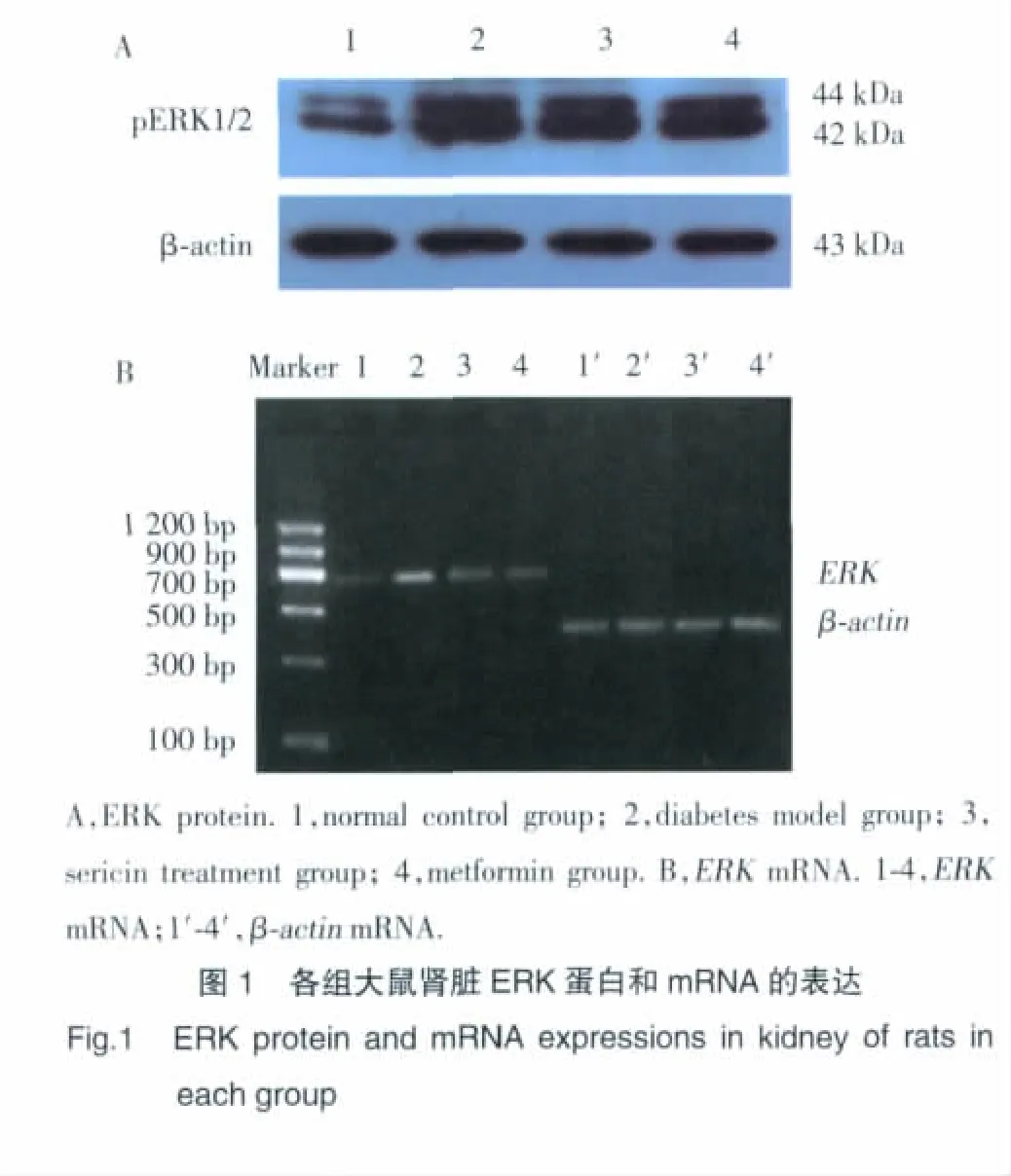
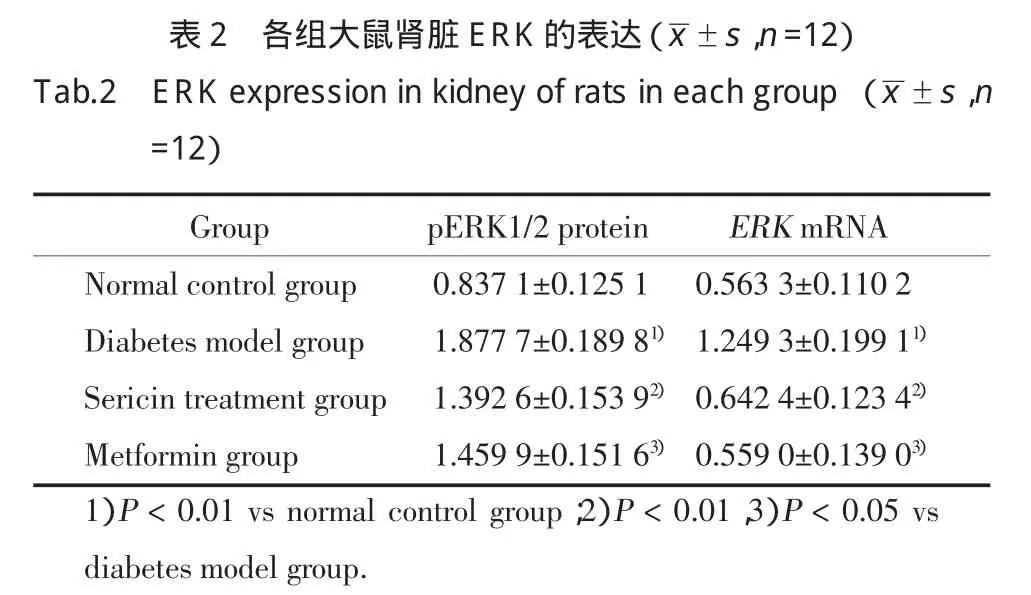
如图1、表2所示,糖尿病模型组大鼠肾脏pERK蛋白及mRNA的表达较正常对照组大鼠高,差异具有统计学意义(P<0.01);丝胶、二甲双胍均可明显降低糖尿病模型大鼠肾脏ERK的表达,丝胶治疗组、二甲双胍组大鼠肾脏pERK蛋白及mRNA的表达明显较糖尿病模型组大鼠低,差异具有统计学意义(P<0.05)。
2.2 各组大鼠肾脏MEK的表达
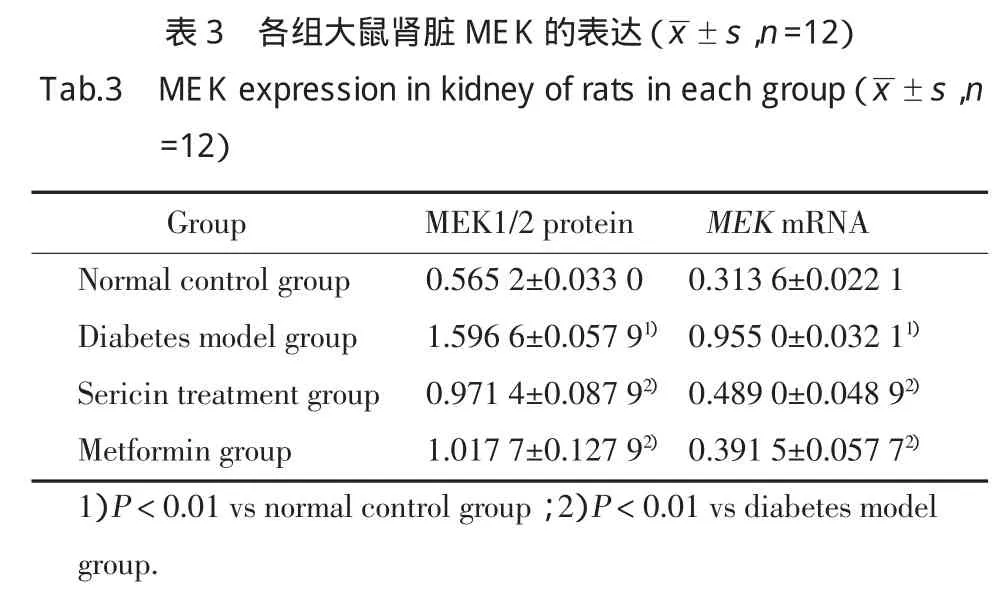
糖尿病模型组大鼠肾脏MEK蛋白及mRNA的表达较正常对照组大鼠高,差异具有统计学意义(P<0.01);丝胶、二甲双胍均可明显降低糖尿病模型大鼠肾脏MEK的表达,丝胶治疗组与二甲双胍组大鼠肾脏MEK蛋白及mRNA的表达较糖尿病模型组大鼠低,差异具有统计学意义(P<0.01)。见图2和表3。

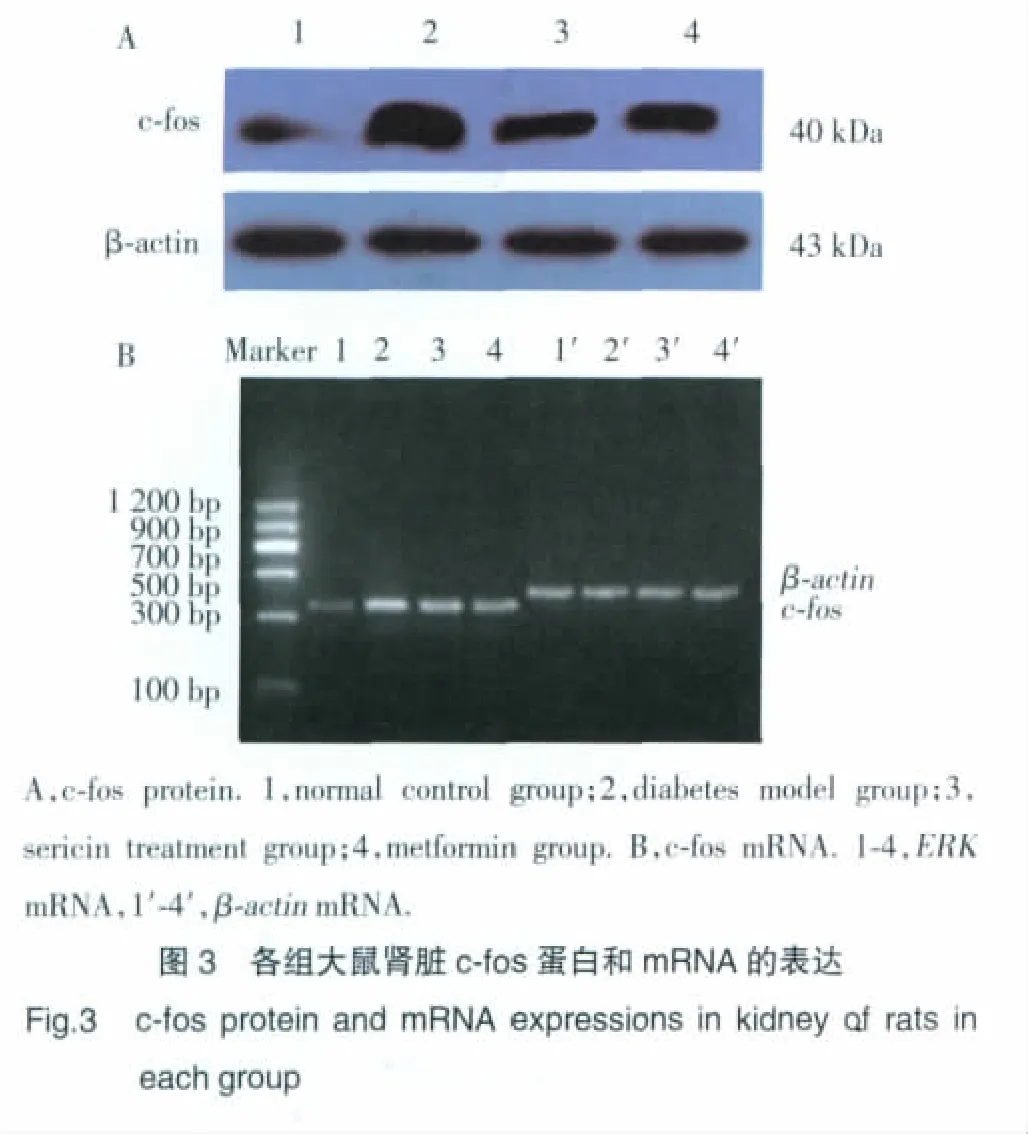
2.3 各组大鼠肾脏c-fos的表达
糖尿病模型组大鼠肾脏c-fos蛋白及mRNA的表达较正常对照组大鼠高,差异具有统计学意义(P<0.01);丝胶、二甲双胍均可明显降低糖尿病模型大鼠肾脏c-fos的表达,丝胶治疗组、二甲双胍组大鼠肾脏c-fos蛋白及mRNA的表达较糖尿病模型组大鼠低,差异具有统计学意义(P<0.01)。见图3和表4。

3 讨论
肾小球系膜增殖是DN早期的病理特征之一,也是晚期肾脏硬化的前驱表现之一[5,6]。DN时,肾小球系膜细胞是多种致病因子作用的主要靶细胞,同时系膜细胞又可合成和分泌多种细胞因子,这些细胞因子又在DN的进展中发挥了重要作用[7,8]。细胞因子对细胞行为的调节与细胞内多种信号转导通路的活化密切相关,其中,ERK信号通路是糖尿病发病过程中不同信号通路的交汇点[9]。
本研究发现,糖尿病模型大鼠肾脏ERK及其上游基因MEK1/2、下游基因c-fos的表达均明显上调,ERK信号通路处于活化状态。高血糖、肾素—血管紧张素系统激活、系膜细胞内氧化应激产物增多、血流动力学异常、内皮素、转化生长因子β1(transforming growth factor-β1,TGF-β1)及血小板衍生生长因子等均可使ERK信号通路活化[10,11]。高血糖激活ERK通路可能与高糖的直接作用或高糖通过促进非酶促糖基化反应、多元醇代谢通路活化和氧化应激加强等有关。Tian等[12]的研究发现,增高的血糖可经糖酵解途径使二脂酰甘油合成增加,从而激活蛋白激酶 C(protein kinase C,PKC);PKC 作为 Raf/MEK/ERK通路的上游激酶,导致ERK活化。因此,糖尿病时ERK通路激活被认为是DN发生发展过程中一个重要的分子机制,但具体的激活机制尚不完全清楚[9]。
ECM积聚是DN的一个显著特征。ERK信号通路活化后可激活下游多种转录因子,通过促进系膜基质增生参与ECM的积聚,从而促进DN的发生发展[13]。如 ERK 通路活化后通过激活 TGF-β1、磷酸化丝氨酸178位点使p27活化(Kip1)、增加c-fos和c-jun等基因的表达,诱导肾小球系膜细胞增殖、肥大,ECM合成增加、降解减少,导致ECM的进行性积聚[14,15];另外,TGF-β1等细胞因子还可间接激活ERK 信号通路,从而形成恶性循环[1,2]。
糖尿病属中医学“消渴症”的范畴,治疗原则是生精清热、润燥养阴。蚕茧是蚕蛾科昆虫家蚕蛾的茧壳,性甘、温,无毒,可滋阴润燥、生精止渴,主治多饮、不生肌肉、肾消白浊和上中二消。起源于中国的蚕丝业拥有几千年的悠久历史,但对蚕丝的应用主要集中于丝素,约占茧丝30%的丝胶遭到丢弃。学者们一直在探讨如何有效利用如此大量优质的蛋白质,并发现了丝胶许多新的功效,如美容、护肤、营养、抗氧化、抗癌等[16,17]。民间早有蚕茧泡水控制血糖的验方,本课题组的前期研究也证实了这一点[3]。本研究发现,丝胶治疗组大鼠肾脏MEK、ERK1/2及c-fos的表达明显低于糖尿病模型组大鼠,表明丝胶可通过下调ERK及其上游、下游基因的表达,抑制ERK信号通路的激活,减轻ERK信号通路介导的肾小球系膜细胞增生肥大,ECM合成增加、ECM进行性积聚以及细胞增殖等肾脏损伤,具有阻止糖尿病时肾脏损害的作用。同时,由于丝胶是天然的蛋白质,具有生物相容性,可生物降解,对人体无毒性,可避免化学合成药物带给人体的不良反应,因此具有良好的应用推广前景,但相关机制有待进一步研究与探讨。
[1]Nicholas SB,Aguiniga E,Ren Y,et al.Plasm inogen activator inhibitor-1 deficiency retards diabetic nephropathy[J].Kidney Int,2005,67(4):1297-1307.
[2]Haashida T,Schnaper HW.High ambient glucose enhances sensitiveity to TGF-β1 via extracellular signal-regulated kinase and protein kinase C delta activities in human mesangial cells[J].J Am Soc Nephrol,2004,15(8):2032-2041.
[3]付文亮,和亚强,马洪伟,等.丝胶对2型糖尿病大鼠睾丸生殖细胞增殖及相关因素的作用[J].中国医科大学学报,2010,39(5):332-336.
[4]Miyawaki T,Mashiko T,Ofengeim D,et al.Ischemic preconditioning blocks BAD translocation,Bcl-xL cleavage,and large channel activityinmitochondriaofpostischemichippocampalneurons[J].ProcNatl Acad Sci USA,2008,105(12):4892-4897.
[5]宛霞,黄湖辉,李劲高.氯沙坦对糖尿病大鼠肾组织MT3-MMP及TIMP2 mRNA 表达的影响[J].第一军医大学学报,2004,24(12):1391-1394.
[6]黄雯,李晓璐,陈燊,等.内源性H2 S对糖尿病肾病细胞外基质积聚的作用[J].首都医科大学学报,2009,30(2):133-136.
[7]Li YB,Yin JJ,Wang HJ,et al.Effect of simvastatin on expression of transforming growth factor-β and collagen type IV in rat mesangial cells[J].Pharmacology,2011,88(3-4):188-192.
[8]K觟ppel H,Riedl E,Braunagel M,et al.L-carnosine inhibits highglucose-mediated matrix accumulation in human mesangial cells by interfering with TGF-β production and signalling[J].Nephrol Dial Transplant,2011,26(12):3852-3858.
[9]Haneda M,Koya D,Kikkawa R.Cellular mechanisms in the development and progression of diabetic nephropathy:activation of the DAGPKC-ERK pathway[J].Am J Kidney Dis,2001,38(4 Suppl1):S178-S181.
[10]Huang D,Ding Y,Luo WM,et al.Inhibition of MAPK kinase signaling pathways suppressed renal cell carcinoma growth and angiogenesis in vivo[J].Cancer Res,2008,68(1):81-88.
[11]Toyoda M,Suzuki D,Honma M,et al.High expression of PKCMAPK pathway mRNAs correlates with glomerular lesions in human diabetic nephropathy[J].Kidney Int,2004,66(3):1107-1114.
[12]Tian W,Zhang Z,Cohen DM.MAPK signaling and the kidney[J].Am J Physiol Renal Physiol,2000,279(4):F593-F604.
[13]Lee MP,Sweeney G.Insulin increases gelatinase activity in rat glomerular mesangial cells via ERK-and PI-3 kinase-dependent signalling[J].Diabetes Obes Metab,2006,8(3):281-288.
[14]Xu ZG,Yoo TH,Ryu DR,et al.Angiotensin Ⅱ receptor blocker inhibits p27kip1 expression in glucose-stimulated podocytes and in diabetic glomeruli[J].Kidney Int,2005,67(3):944-952.
[15]Fujita H,Omori S,Ishikura K,et al.ERK and p38 mediate highglucose-induced hypertrophy and TGF-beta expression in renal tubular cells[J].Am J Physiol Renal Physiol,2004,286(1):F120-F126.
[16]Kaewkorn W,Limpeanchob N,Tiyaboonchai W,et al.Effects of silk sericin on the proliferation and apoptosis of colon cancer cells[J].Biol Res,2012,45(1):45-50.
[17]Dash R,Acharya C,Bindu PC,et al.Antioxidant potential of silk protein sericin against hydrogen peroxide-induced oxidative stress in skin fibroblasts[J].BMB Rep,2008,41(3):236-241.

