白藜芦醇增加脂肪细胞3T3-L1中脂联素表达的作用机制探讨
王添,都镇先,张海燕,邓娓娓
(中国医科大学附属第一医院1.内分泌与代谢性疾病科;2.老年病干诊科,沈阳110001)
脂联素,已知的有ACRP30、GBP28和Adipo Q,是在白色脂肪组织中特异性表达的一种补充因子,可提高脂肪酸氧化及胰岛素敏感性[1]。最近研究证实脂联素在调节葡萄糖和脂质代谢中起着重要的作用[2,3]。一些研究证实脂联素和肿瘤坏死因子α(tumor necrosis factor α,TNF-α) 在脂肪细胞中表达呈负相关,对胰岛素抵抗的调节作用相反[1,4,5]。因此,准确理解这些脂肪因子的关系及其调节机制将有助于提高胰岛素相关代谢性综合征的治疗水平。已有报道白藜芦醇能够拮抗TNF-α抑制脂联素的生成[6],但是这种拮抗机制仍不清楚,本研究采用白藜芦醇、TNF-α单独或者联合作用脂肪细胞3T3-L1,检测脂联素mRNA表达及释放、PPAR-γmRNA表达及活性,为白藜芦醇防治2型糖尿病及代谢综合征提供理论依据。
1 材料与方法
1.1 研究试剂
重组TNF-α购于美国Biosource公司。白藜芦醇、异丁基甲基黄嘌呤(isobutylmethylxanthine,IBMX)、地塞米松和胰岛素购于美国Sigma公司。3T3-L1前脂肪细胞购于美国标准生物品收藏中心(ATCC)。
1.2 3T3-L1细胞培养和分化
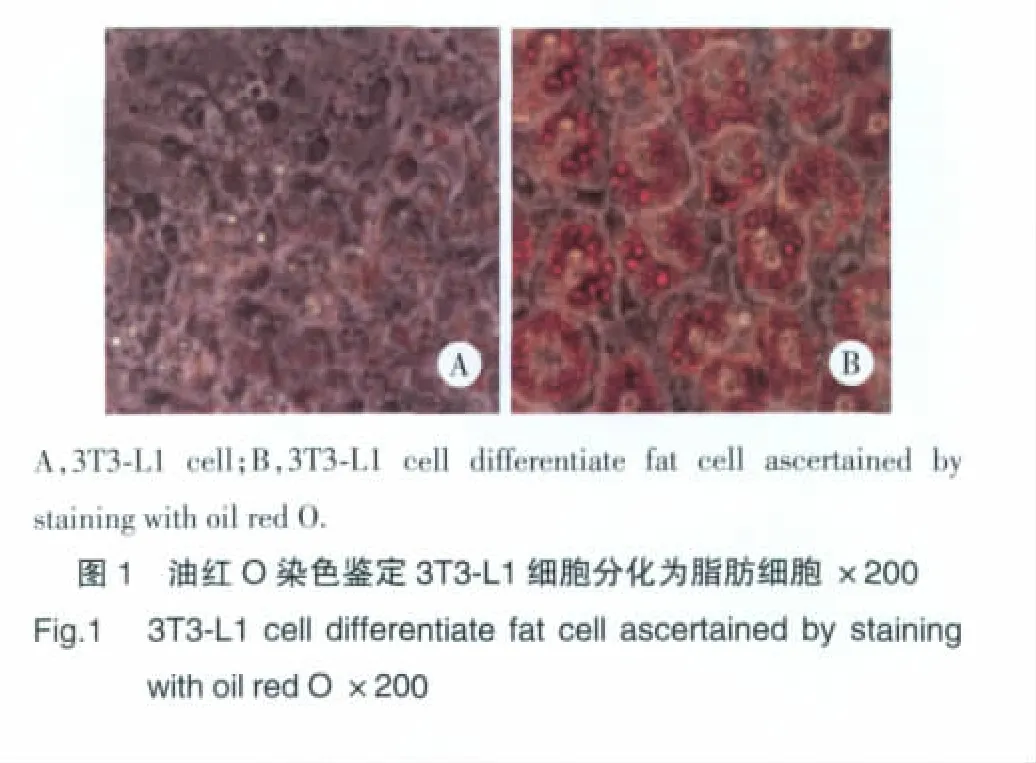
细胞于含10%胎牛血清的DMEM(美国Invit-rogen公司)中培养,以浓度为1×106/孔在6孔培养皿中培养3 d。在DMEM中加入IBMX(0.5 mmol/L)、地塞米松(5 μmol/L)和胰岛素(10 mg/L)诱导分化,诱导2 d后更换诱导培养液。在含有10%胎牛血清和10 mg/L胰岛素的DMEM中再诱导2 d后,用含有10%胎牛血清的DMEM每2 d更换培养液。在诱导分化的12~14 d,细胞用于后续实验。用原位油红O染色确定细胞的分化情况,具体操作按照油红O染色试剂盒说明书进行。超过95%的3T3-L1细胞呈脂肪细胞表型时可进行后续实验。
1.3 干预实验及分组
(1)用白藜芦醇(0,5,10,20,50 μmol/L)培养分化3T3-L1脂肪细胞24 h后,用实时定量PCR法检测白藜芦醇对过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPAR-γ)和脂联素基因表达的影响;(2) 用 TNF-α(0,1.0,2.5,5.0,10.0,20.0 μg/L)培养分化3T3-L1 脂肪细胞24 h,用实时定量PCR法检测各组TNF-α对脂联素基因的表达;(3)在细胞分化 6~8 d,用白藜芦醇(0,5,10,20,50 μmol/L)孵育3T3-L1 脂肪细胞 8 h。然后用或不用 TNF-α(10 ng/mL)孵育24 h,实时定量 PCR 法检测各组脂联素基因的表达;(4)设立空白对照组、TNF-α组和白藜芦醇+TNF-α组。在分化6~8 d时,用白藜芦醇(20 μmol/L)或培养液孵育3T3-L1脂肪细胞 8 h,然后用 TNF-α(10 μg/L)或培养液孵育24 h,收集各组细胞,用实时定量PCR法检测PPAR-γ基因表达。
1.4 实时定量PCR法
收集各组3T3-L1脂肪细胞,参照说明书,采用异硫氰酸肌法提取总RNA,用12~18的oligo(dT)和super scriptⅡ进行逆转录,用双标记荧光探针混合物在ABI prism7500自动序列分析系统中进行实时定量PCR分析,每组重复3次。PPAR-γ基因引物特异序列为上游5′-ATGGGTGAAACTCTGGGA-3′和下游5′-TCGGCACTCAATGGCCAT-3′。脂联素基因引物特异序列为上游5′-TTGGTCCTAAGGGAG ACATC-3′和下游5′-CAGTGGAGCCATCATAGTGG-3′。β-actin作为内参照,其引物特异序列为上游5′-GAGACCTTCAACACCCCAGCC-3′和下游5′-GGAT CTTCATGAGGTAGTCAG-3′。PCR反应条件为变性95℃15 s,退火 60℃ 4 min,延伸 60℃ 4 min,30个循环。两种基因扩增结果用β-actin进行标化。
1.5 酶联免疫吸附试验(ELISA)
检测干预实验(1)、(2)、(3)中脂联素释放。收集各组3T3-L1脂肪细胞的条件培养液。依据小鼠脂联素ELISA试剂盒说明书分析脂联素的浓度。每个浓度用标准曲线标化,并用相对未处理组百分数来表示。
1.6 提取细胞核并测定PPAR-γDNA结合活性
将干预实验⑷各组3T3-L1细胞颗粒悬于A缓冲液中(10 mmol/L Hepes,pH 7.9,1.5 mmol/L MgCl2,10 mmol/L KCl和蛋白酶抑制剂的混合物)。测定PPAR-γ的活性,按照PPAR-γ转录因子测定试剂盒的说明书进行操作。
1.7 统计学方法
数据分析采用SPSS13.5软件处理,所有实验均重复3次,结果以±s表示,采用单因素方差分析(one-way ANOVA)和 post hoc Dunnett′s test,以 P﹤0.05为差异有统计学意义。
2 结果
2.1 白藜芦醇对PPAR-γ在3T3-L1脂肪细胞中表达的影响
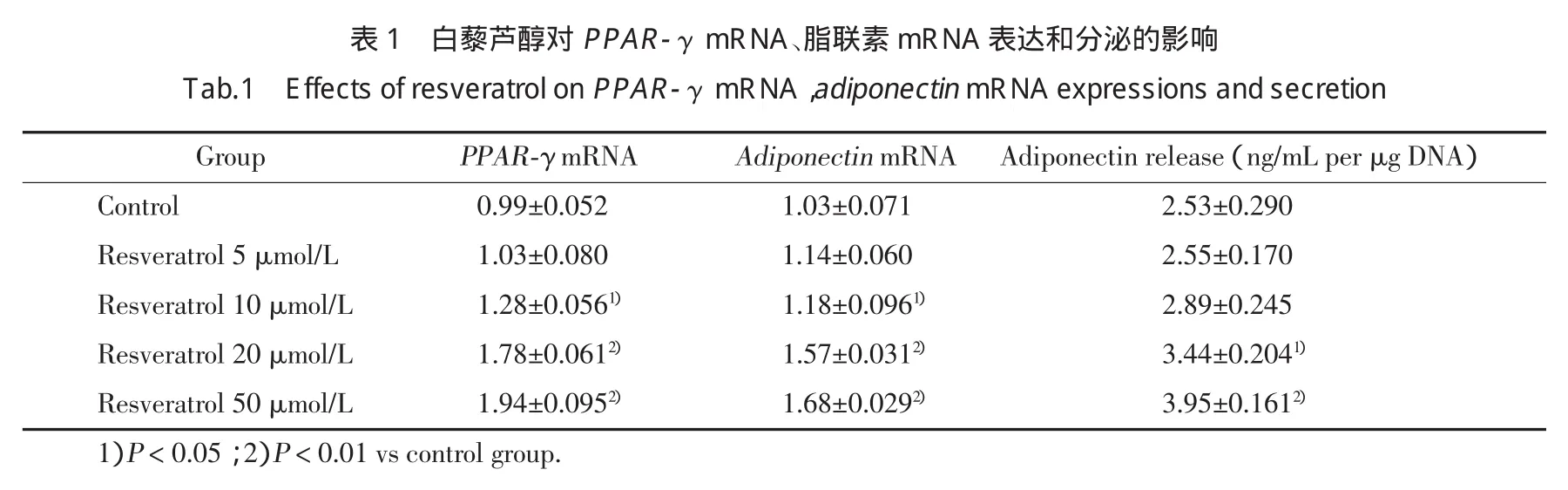
3T3-L1细胞系由成纤维细胞分化成脂肪细胞,分化10~12 d后>95%的细胞呈现出显著的多囊泡脂质沉积(图1)。脂肪分化的重要标志(成熟的脂肪细胞)是转录因子PPAR-γ,在成纤维细胞(0 d)中没有转录因子表达,但是在分化步骤中开始增加[前脂肪细胞(2 d)、不成熟或者年轻的脂肪细胞(4~8 d)、成熟的脂肪细胞(12 d)]。白藜芦醇增加PPAR-γ表达呈剂量依赖方式,与对照组比较,50 μmol/L白藜芦醇处理组中PPAR-γmRNA水平增加近2倍(表1)。
2.2 白藜芦醇对脂联素在分化3T3-L1脂肪细胞中表达及分泌的影响
为探讨白藜芦醇对脂联素表达及分泌的作用,用不同浓度白藜芦醇处理完全分化的3T3-L1脂肪细胞24 h。与对照组比较,白藜芦醇在浓度为10~50 μmol/L时,脂联素mRNA的表达呈剂量依赖方式增加(P<0.05);与此相平行,脂联素的分泌释放也呈现剂量依赖方式增加(表1)。
2.3 TNF-α对脂联素在分化3T3-L1脂肪细胞中表达及释放的影响
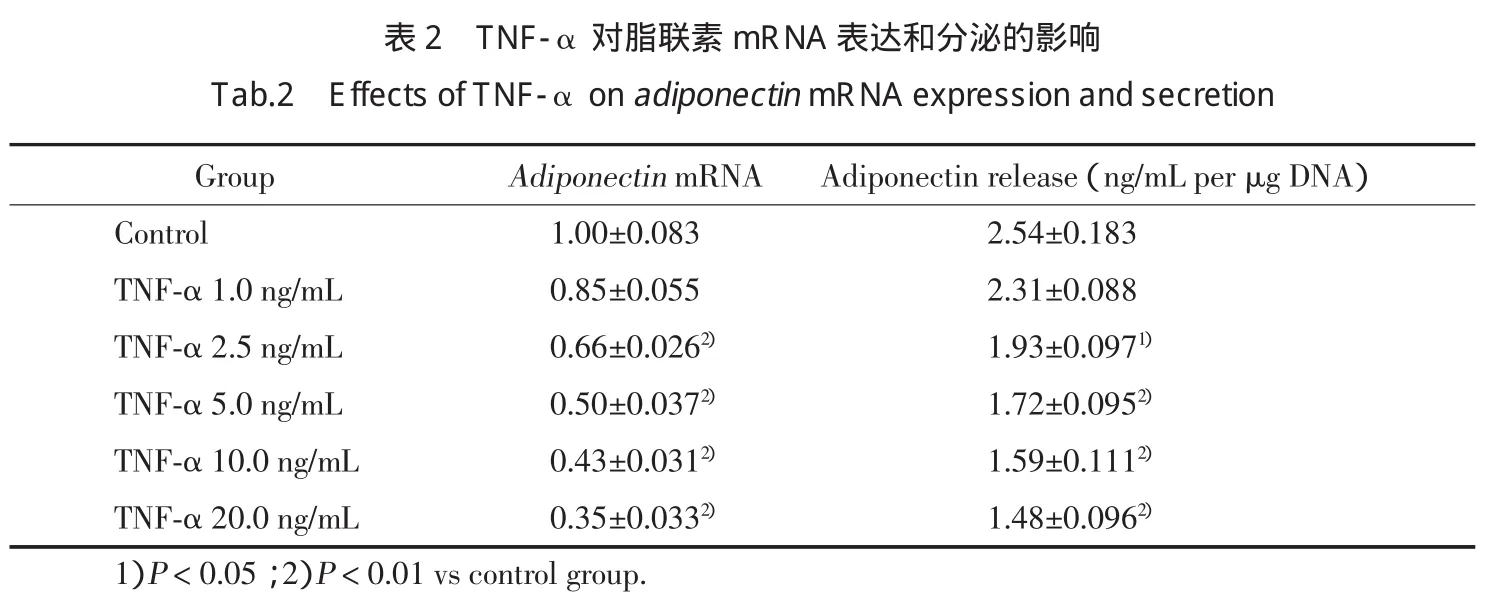
为了证实TNF-α对脂联素mRNA表达及分泌的作用,不同浓度的重组鼠TNF-α作用于完全分化的3T3-L1脂肪细胞24 h。与对照组比较,从浓度2.5 ng/mL开始,脂联素mRNA表达水平成剂量依赖效应增加(P<0.01)。与mRNA表达相平行,ELISA检测结果显示:TNF-α组中脂联素分泌的减少也呈现剂量依赖方式(表2)。
2.4 白藜芦醇对TNF-α抑制的脂联素表达及分泌的影响
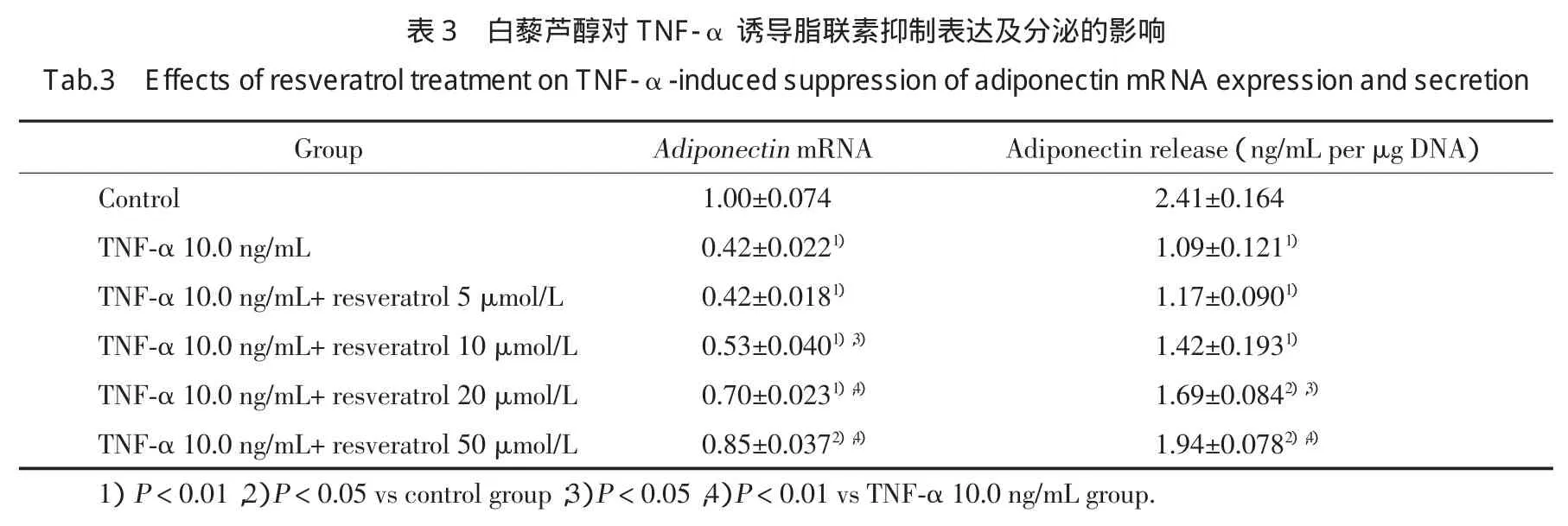
白藜芦醇显著拮抗TNF-α诱导的脂联素分泌减低,与TNF-α组比较,白藜芦醇+TNF-α组在白藜芦醇浓度为20 μmol/L及50 μmol/L时脂联素分泌显著增加,差异具有统计学意义(P<0.05)。与脂联素的分泌模式相平行,在mRNA水平上,白藜芦醇部分拮抗TNF-α介导的脂联素表达抑制,见表3。这个结果提示白藜芦醇对脂联素分泌的作用源于脂联素表达的调节。另外,尽管白藜芦醇的拮抗作用呈剂量依赖方式,但是最大的抑制效应也是部分的。
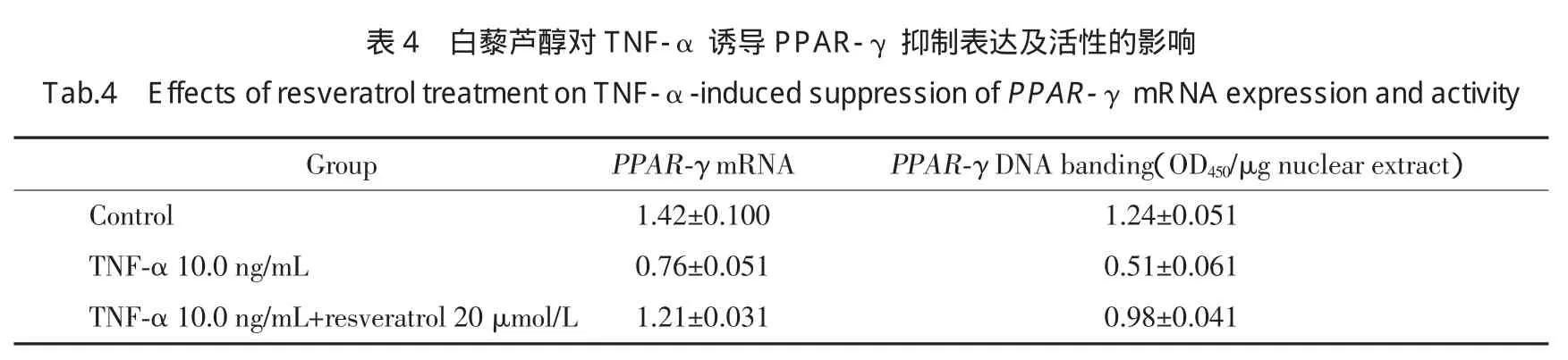
2.5 白藜芦醇对TNF-α诱导PPAR-γmRNA表达及活性抑制的影响
为了明确白藜芦醇的调节作用是否通过PPAR-γ介导,我们测定3T3-L1脂肪细胞细胞核提取物中PPAR-γDNA结合活性。结果显示:TNF-α显著抑制PPAR-γ活性,白藜芦醇拮抗TNF-α抑制PPAR-γ DNA的结合活性(P<0.01)。用实时定量PCR法检测白藜芦醇对PPAR-γmRNA表达的作用,得到相似的结果,白藜芦醇拮抗TNF-α介导的PPAR-γ mRNA抑制(P<0.01),见表4。
3 讨论
胰岛素抵抗与代谢综合征(包括2型糖尿病和肥胖)密切相关。胰岛素抵抗的患者及动物模型中,脂联素血浆浓度和mRNA表达是下降的[7]。脂联素生成调控的分子机制尚不十分明确。有报道证实,脂肪细胞中影响胰岛素敏感性的一些激素和细胞因子对脂联素表达和分泌有正面或者负面的影响。例如,噻唑烷二酮是PPAR-γ激动剂,可以增加脂肪细胞中脂联素基因的表达以及循环中脂联素的水平[8]。相反,另外一种可以诱导胰岛素抵抗的细胞因子——TNF-α,作为脂联素主要的负性调节剂导致代谢紊乱[9]。脂联素和TNF-α在脂肪细胞中呈负相关表达,在胰岛素抵抗的调节上起着相反的作用[1,4,5]。由于脂联素对胰岛素相关的代谢性疾病的保护性作用,TNF-α诱导脂联素表达减少可能是胰岛素抵抗进展的主要事件。
白藜芦醇是一种自然存在的多酚,在红酒、蓝莓和花生中的含量较高。尽管已有报道证实白藜芦醇有许多有益的作用,但对于脂联素的调节机制尚不明确。本研究证实白藜芦醇增加脂联素在分化的3T3-L1脂肪细胞中的表达及分泌;这与陈思凡等[10]报道的无论胰岛素存在与否,白藜芦醇都可使胰岛素抵抗状态下的3T3-L1脂肪细胞脂联素的mRNA表达增加,提示白藜芦醇可能通过增加脂联素的表达水平来改善胰岛素抵抗相一致。但也有报道[11]证实白藜芦醇抑制脂连素mRNA的表达,在抑制脂肪细胞分化方面,添加不同剂量的白藜芦醇可明显抑制细胞的分化,减少脂肪的蓄积。导致两种不同结论的原因可能与脂肪细胞分化程度不同有关。本研究证实白藜芦醇增加脂联素在分化的3T3-L1脂肪细胞中表达及分泌的机制是白藜芦醇增加PPAR-γ在3T3-L1脂肪细胞中的表达;并能有效抑制TNF-α诱导脂联素分泌的下降,脂联素mRNA的表达与白藜芦醇诱导脂联素的分泌呈平行变化;白藜芦醇通过调节PPAR-γ活性拮抗TNF-α诱导下调脂联素分泌及mRNA表达。有文献报道[12]在高脂饮食诱导肥胖小鼠模型中证实PPAR-γ激动剂通过调控脂肪细胞分泌的脂肪细胞因子脂联素的表达,改善胰岛素抵抗,但调节机制没有阐明。本研究可以部分证明白藜芦醇增加脂连素的表达是通过增加PPAR-γ活性拮抗TNF-α对脂联素分泌及mRNA表达的抑制作用来实现的。
综上所述,本研究提示白藜芦醇能够通过调节PPAR-γ的转录活性继而拮抗TNF-α诱导下调3T3-L1脂肪细胞中脂联素的表达及分泌,这一结果将有助于设计新的治疗药物或治疗方法,促进胰岛素抵抗及2型糖尿病治疗手段的发展。
[1] Yamauchi T,Kamon J,Waki H,et al.The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity[J].Nat Med,2001,7(8):941-946.
[2]Ouchi N,Kobayashi H,Kihara S,et al.Adiponectin stimulates angiogenesis by promoting cross-talk between amp-activated protein kinase and akt signaling in endothelial cells[J].J Biol Chem,2004,279(2):1304-1309.
[3]Chen H,Montagnani M,Funahashi T,et al.Adiponectin stimulates production of nitric oxide in vascular endothelial cells[J].J Biol Chem,2003,278(45):45021-45026.
[4]Maeda N,Shimomura I,Kishida K,et al.Diet-induced insulin resistance in mice lacking adiponectin/acrp30[J].Nat Med,2002,8(7):731-737.
[5]You M,Considine RV,Leone TC,et al.Role of adiponectin in the protective action of dietary saturated fat against alcoholic fatty liver in mice[J].Hepatology,2005,42(3):568-577.
[6]Ahn J,Lee H,Kim S,et al.Resveratrol inhibits tnf-alpha-induced changes of adipokines in3t3-l1 adipocytes[J].Biochem Biophys Res Commun,2007,364(4):972-977.
[7]Kadowaki T,Yamauchi T.Adiponectin and adiponectin receptors[J].Endocr Rev,2005,26(3):439-451.
[8]Yang WS,Jeng CY,Wu TJ,et al.Synthetic peroxisome proliferatoractivated receptor-gamma agonist,rosiglitazone,increases plasma levels of adiponectin in type2diabetic patients[J].Diabetes Care,2002,25(2):376-380.
[9]Cawthorn WP,Sethi JK.Tnf-alpha and adipocyte biology[J].FEBS Lett,2008,582(1):117-131.
[10]陈思凡,柯梁汝,郑琳,等.白藜芦醇对胰岛素抵抗3T3-L1脂肪细胞葡萄糖代谢的影响[J].食品科学,2010,31(23):285-288.
[11]陈思凡,肖新才,孙延双,等.白藜芦醇对小鼠3T3-L1细胞增殖与分化的影响及其机制[J].中国药理学通报,2010,26(1):108-111.
[12]谢宇,朱亭,刘娟,等.吡格列酮对肥胖小鼠脂肪细胞因子脂联素表达的影响[J].南京医科大学学报(自然科学版),2008,28(7):872-875.

