单核细胞增生性李斯特菌fbpa基因敲除菌株的构建
李胜军,阎雪晶,王舰
(中国医科大学1.基础医学院免疫学教研室;2.第95期临床医学七年制;3.基础医学院病原生物学教研室,沈阳110001)
单核细胞增生性李斯特菌(Listeria monocytogenes,LM)广泛存在于自然界中,是一种人畜共患病的病原菌,能通过污染的食品引起人、畜的李氏特菌病,易感者为新生儿、孕妇、40岁以上的成人和免疫功能缺陷者,感染后主要表现为食物中毒、败血症、脑膜炎和单核细胞增多[1~3]。在LM感染过程中,LM对宿主细胞的黏附发挥关键性作用,这种黏附与LM的一些表面蛋白有关,如InlA、InlB、VIP、SrtA、纤维黏连蛋白结合蛋白(FbpA)等[4]。FbpA有570个氨基酸,与肺炎链球菌表面的黏附分子PavA、化脓性链球菌表面的黏附分子Fbp54具有高度的同源性,在LM黏附宿主细胞过程中发挥重要作用[5]。本研究通过PCR从LM基因组中扩增出fbpa基因全序列及其上、下游基因序列,并构建可用于其基因敲除的质粒,将基因敲除质粒导入LM后,通过同源重组的方法构建LM的fbpa基因敲除菌株(Δfbpa)以便进一步研究其致病机制及fbpa基因功能。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒及培养基:LM1b1684标准株、大肠杆菌DH5α菌株、质粒pCRⅡ、pAULA(中国医科大学免疫学教研室),胰酶大豆肉汤(Tryptic Soy broth,TSB)、溶菌肉汤(Luria-Bertani,LB)培养基(美国BD Biosceneces公司)。
1.1.2 实验试剂:限制性内切酶BamHⅠ、KpnⅠ、SalⅠ 、 碱 性 磷 酸 酶 、DNA Marker DL1000、DNA Marker DL2000(日本TaKaRa公司),T4 DNA ligase(美国Promega公司),基因组DNA小量抽提试剂盒、DNA凝胶回收试剂盒(碧云天生物技术研究所),细菌PCR试剂盒(美国GENERON公司),Plasmid mini kitⅠ(美国 Omega公司),Western blot试剂盒(蓝基生物科技)。
1.1.3 实验仪器:PTC-200型PCR扩增仪(美国MJ RESEARCH公司),MUPID电泳仪(美国Advance公司),GDS-8000型全自动凝胶成像分析仪(美国UVP公司)。
1.2 实验方法
1.2.1 LM、Δfbpa和大肠杆菌DH5α菌株的培养:LM、Δfbpa以TSB培养基,大肠杆菌以LB培养基,37℃、120 r/min培养。
1.2.2 LM基因组DNA的制备:收集过夜培养的LM,按基因组DNA小量抽提试剂盒说明书抽提基因组DNA,置于-20℃冰箱冻存备用。
1.2.3 fbpa(IMO1829)及其上下游基因(IMO1828、IMO1830)片段的克隆及扩增:取10 ng基因组DNA为模板,采用正向、反向引物(表1)进行全序列扩增,反应条件:94 ℃5 min,94 ℃30 s,60 ℃30 s,72℃55 s,72℃4 min,30个循环,72℃10 min。PCR 产物经2%琼脂糖电泳后,按DNA凝胶回收试剂盒说明书回收目的基因片段。回收片段与载体质粒pCRⅡ相连,分别常规转化大肠杆菌DH5α,平板培养并筛选出阳性克隆,LB培养基37℃恒温振荡过夜培养,收集菌体,按Plasmid mini kitⅠ试剂盒说明书提取质粒。获得的质粒分别命名为pCRⅡ-fbpa、pCRⅡ-IMO1828、pCRⅡ-IMO1830。分别以 KpnⅠ、BamHⅠ、SalⅠ限制性内切酶双酶切3种质粒,经2%琼脂糖电泳后,回收目的基因片段,置于-20℃冰箱冻存备用[6]。
1.2.4 敲除质粒的构建:采用KpnⅠ、BamHⅠ双酶切,将pAULA载体质粒线性化,采用碱性磷酸酶进行线性化载体质粒尾端去磷酸化,防止自连,经1.25%琼脂糖电泳后,胶回收、纯化载体。取前一操作制备的上游基因片段(534 kb)与线性化的pAULA载体在14℃连接过夜。连接物常规转化大肠杆菌DH5α,阳性克隆采用KpnⅠ、BamHⅠ限制性内切酶双酶切鉴定。获得的质粒命名为pAULA-upstream。按照如上操作,以BamHⅠ、SalⅠ双酶切pAULA-upstream,连接下游基因片段(575 kb)与线性化的pAULA-upstream,常规转化大肠杆菌DH5α,获得的质粒命名为 pAULA-Δfbpa[5]。
1.2.5 基因敲除菌株的构建:将pAULA-Δfbpa质粒与LM放入2 mm电转杯,在2.5 kV、5 ms条件下将pAULA-Δfbpa质粒转入LM后实现同源重组,LBEm培养筛选出温度敏感突变株[7]。
1.2.6 蛋白质提取与Western blot鉴定:LM、Δfbpa经TSB培养基37℃振荡过夜培养,收集菌体,超声裂解细菌,15000 r/min、4℃离心15 min,取上清5 μL进行定量,蛋白定量后取30 μg总蛋白经10%SDS-PAGE凝胶分离,4℃过夜,恒压转移至PVDF膜上,按Western blot试剂盒说明书进行FbpA鉴定。
2 结果
2.1 fbpa(IMO1829)基因及其上下游基因片段的克隆及鉴定结果
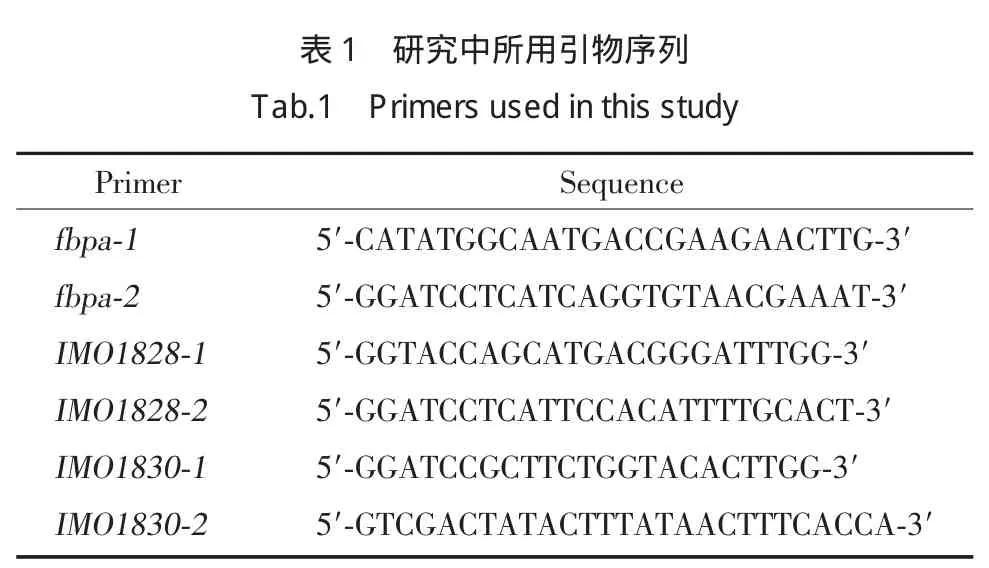
将PCR扩增的fbpa及其上下游基因(IMO1828、IMO1830)与pCRⅡ连接后,分别常规转化大肠杆菌DH5α,扩增后抽提质粒,双酶切后琼脂糖凝胶电泳检测,显示fbpa、IMO1828、IMO1830基因片段成功克隆(图1)。
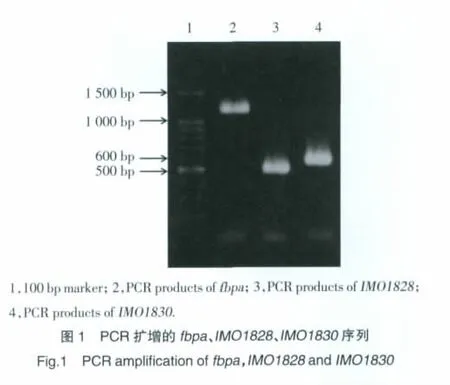
2.2 敲除质粒构建及鉴定结果
构建的敲除质粒pAULA-Δfbpa采用KpnⅠ和SalⅠ双酶切后琼脂糖凝胶电泳检测,鉴定得1109 bp和未切完全的原质粒(约9 kb)2个条带的克隆为阳性克隆(图2)。
2.3 敲除菌株鉴定结果
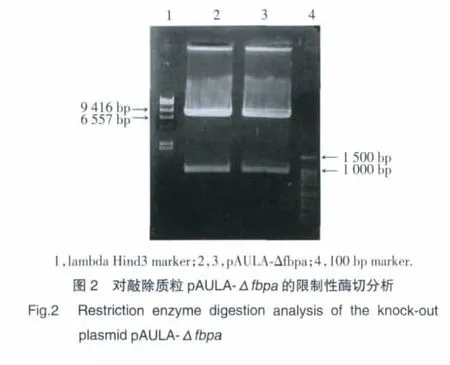
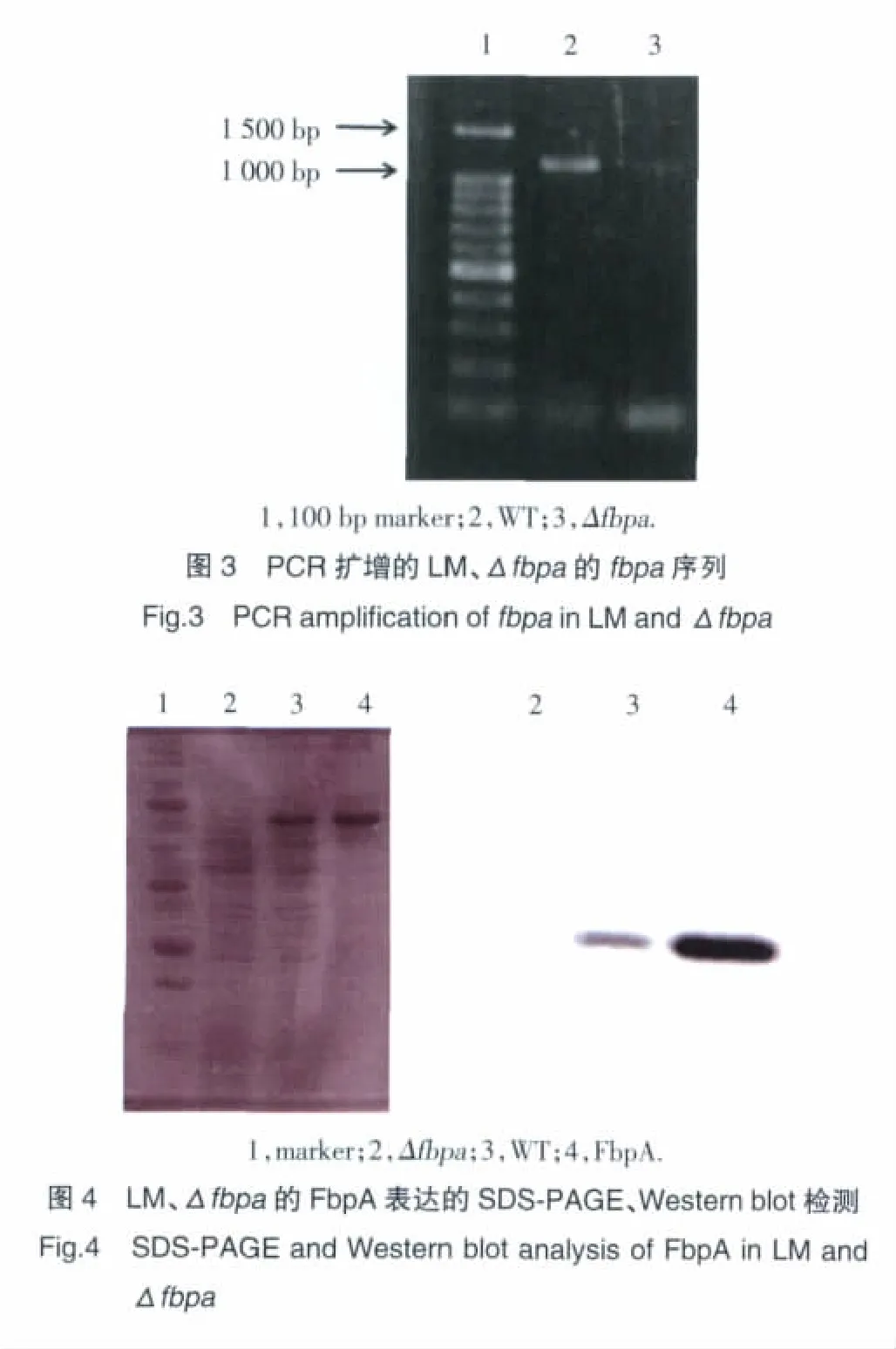
抽提LM、Δfbpa的基因组DNA,采用fbpa基因正向、反向引物,PCR扩增,PCR产物电泳结果显示Δfbpa基因组DNA无fbpa基因片段(图3)。LM、Δfbpa过夜培养后,收集并超声裂解细菌,提取蛋白并定量后,进行SDS-PAGE凝胶电泳和Western blot检测,结果显示Δfbpa无FbpA蛋白表达(图4)。
2.4 敲除菌株生长特性鉴定结果
LM、Δfbpa过夜培养,以5%的接种量转接到新鲜的100 mL TSB培养基中,37℃、120 r/min培养,分别在0、1、2、4、6、12、24 h 检测菌体的生长情况,敲除菌株与标准菌株生长趋势基本一致(图5)。
3 讨论
LM是广泛存在于自然界中经由食物传染的革兰阳性菌,可以引起人和动物的各种感染症,感染后主要表现为食物中毒、败血症、脑膜炎和单核细胞增多[1~3]。LM可侵袭宿主专职及非专职吞噬细胞,侵袭过程包括侵入宿主细胞、裂解吞噬溶酶体或内溶酶体、在细胞质内增殖、细胞与细胞之间的传播等[8~11]。
LM对宿主细胞的黏附发挥关键性作用,这种黏附与LM的一些表面蛋白有关,如InlA、InlB、VIP、SrtA、FbpA 等[4]。FbpA 有570个氨基酸,与肺炎链球菌表面的黏附分子PavA、化脓性链球菌表面的黏附分子Fbp54具有高度的同源性,在LM黏附宿主细胞过程中发挥重要作用[5]。
在研究细菌表面黏附分子FbpA在LM感染症发病机制中的作用时,有必要表达并提纯重组FbpA蛋白及构建fbpa基因敲除菌株。本文作者已表达并提纯重组FbpA蛋白。在本研究中,我们通过PCR从LM基因组中扩增出fbpa基因全序列及其上、下游基因序列,并构建可用于其基因敲除的质粒,将基因敲除质粒导入LM后,通过同源重组的方法构建LM的fbpa基因敲除菌株(Δfbpa)。本研究成果有利于进一步研究FbpA蛋白在LM侵袭宿主细胞过程中,对LM黏附宿主细胞、LM从吞噬溶酶体或内溶酶体逃脱、LM在细胞质内的增殖、LM在细胞与细胞之间的传播的影响。
[1]胡昕,诸葛青云,潘长旺,等.温州市海洋贝类微生物污染状况的调查[J].南方医科大学学报,2010,30(7):1624-1625.
[2]冯延芳,冉陆,张立实.2000-2009年中国李斯特菌病文献报告病例分析[J].疾病监测,2011,26(8):654-659.
[3]Allerberger F,Wagner M.Listeriosis:a resurgent food borne infection[J].Clin Microbiol Infect,2010,16(1):16-23.
[4]Mostowy S,Cossart P.Virulence factors that modulate the cell biology ofListeriainfection and the host response [J].Adv Immunol,2012,113:19-32.
[5]Innocentin S,Guimar觔es V,Miyoshi A,et al.Lactococcus lactis expressing eitherStaphylococcus aureusfibronectin-binding protein A orListeria monocytogenesinternalin A can efficiently internalize and deliver DNA in human epithelial cells[J].Appl Environ Microbiol,2009,75(14):4870-4878.
[6]张育先,白启轩,马超,等.人脂联素真核表达质粒构建及其在LX-2 中的表达[J].首都医科大学学报,2009,30(3):326-330.
[7]Sch覿ferkordt S,Chakraborty T.Identification,cloning,and characterization of the Ima operon,whose gene products are unique toListeria monocytogenes[J].J Bacteriol,1997,179(8):2707-216.
[8]Cossart P,Bierne H.The use of host cell machinery in the pathogenesis ofListeria monocytogenes[J].Curr Opin Immunol,2001,13(1):96-103.
[9]Vazquez-Boland JA,Kuhn M,Berche P,et al.Listeriapathogenesis and molecular virulence determinants [J].Clin Microbiol Rev,2001,14(3):584-640.
[10]Cossart P.Actin-based motility of pathogens:the Arp2/3 complex is a central player[J].Cell Microbiol,2000,2(3):195-205.
[11]Stavru F,Archambaud C,Cossart P.Cell biology and immunology of Listeria monocytogenesinfections:novel insights [J].Immunol Rev,2011,240(1):160-184.
——一道江苏高考题的奥秘解读和拓展

