谷胱甘肽S-转移酶P1蛋白在肺癌中的表达及临床病理学意义
陈传萍,何群,潘忠诚,吴广平,赵雨杰
(中国医科大学1.生物芯片中心,卫生部细胞生物学重点实验室,沈阳110001;2.附属第一医院病理科,沈阳110001)
肺癌是最常见的恶性肿瘤之一,5年存活率约为10%~15%,已成为我国恶性肿瘤死亡原因的第一位[1]。目前对肺癌尚缺乏有效的早期诊断和治疗手段,深入研究与肺癌发病机制相关的因子对提高肺癌的诊断率、早期发现肿瘤复发和转移、监测疗效以及判断预后具有重要的意义。谷胱甘肽S-转移酶P1(glutathione S-transferase P1,GSTP1)是谷胱甘肽S-转移酶(GSTs)家族的重要成员。研究发现,GSTP1在喉癌、非小细胞肺癌、乳腺癌、胃癌、大肠癌、前列腺癌及卵巢癌等多种肿瘤组织中表达异常[2~11],提示它与肿瘤的发生发展密切相关。GSTP1是肺脏重要的解毒酶,它在肺癌中的表达情况尚不清楚。本研究拟应用免疫组织化学和Western blot技术检测GSTP1在肺癌组织中的表达,旨在探讨其临床病理学意义。
1 材料与方法
1.1 材料
收集2006年1月至2011年12月中国医科大学附属第一医院具有完整临床资料的原发性肺腺癌手术切除标本50例,其中35例有完整随访资料。癌旁正常肺组织20例,肺转移性腺癌11例,肺鳞癌14例。此外有8例肺腺癌、鳞癌及癌旁正常组织,取样后立即置液氮中冷冻保存。
GSTP1羊抗鼠单克隆抗体购自美国Santa Cruz公司(sc-66000);SP法免疫组织化学试剂盒、DAB显色液购自福州迈新公司;蛋白裂解液、蛋白酶抑制剂、上样缓冲液、BCA定量及ECL发光试剂盒均购自上海碧云天生物公司。
1.2 方法
1.2.1 免疫组织化学SP法:标本经10%甲醛固定,常规石蜡包埋,4 μm厚度切片,二甲苯脱蜡,梯度乙醇水化。3%过氧化氢室温15 min去除内源性过氧化酶。PBS清洗后,置于柠檬酸缓冲液(pH6.0)121℃高压热抗原修复1 min,至自然冷却,PBS清洗。滴加山羊血清,室温封闭20 min。滴加一抗GSTP1(1︰500),4℃孵育过夜。次日室温放置30 min后,PBS清洗,滴加鼠二抗,37℃10 min。PBS清洗,滴加链霉菌抗生物素蛋白—过氧化物酶,37℃10 min。DAB显色,苏木素复染,盐酸乙醇分化后常规脱水,透明,封片后于光学显微镜下观察结果。参照文献[12]评分方法制定染色判断标准。每张切片400倍显微镜下随机选取5个视野,每个视野记数100个细胞,计算5个视野的阳性细胞的平均百分数,分为4级:1%~24%为1分,25%~49%为2分,50%~74%为3分,≥75%为4分;染色强度:无着色0分,浅黄色1分,黄或深黄色2分,褐或棕褐色3分。上述2项相乘为分级标准:≥4分定义为高表达。
1.2.2 Western blot:称取50 mg冷冻保存的癌及癌旁正常组织,加入300 μL裂解液和4 μL蛋白酶抑制剂,冰上超声裂解组织5 s,重复4次。静置30 min后,12000 r/min 4℃离心10 min,收集上清-70℃保存。测定蛋白浓度,样品均定量为5 μg/μL,每泳道上样50 μg蛋白,SDS-PAGE 电泳,60 V 70 min电转移至PVDF膜。5%脱脂奶粉封闭2 h,加入一抗(GSTP11︰500,GAPDH1︰1000)。4℃孵育过夜。TBST洗膜后,1︰5000羊抗鼠二抗室温孵育1.5 h,TBST清洗,ECL发光并以凝胶显像仪(MF-chemibis3.2 DNR,以色列)显像。运用quantity one软件,根据ECL发光成像后条带和电泳条带的面积和密度计算每个条带的灰度值。
1.3 统计学分析
采用SPSS13.0统计软件进行统计学分析。免疫组化检测癌与癌旁组织蛋白表达差异及GSTP1蛋白表达水平与患者临床病理学参数的关系采用χ2检验。Western blot检测GSTP1蛋白表达差异采用独立样本t检验。Kaplan-Meier计算累积生存率,Log-rank进行生存时间差异检验。P<0.05为差异有统计学意义。
2 结果
2.1 GSTP1蛋白在肺癌组织中的表达
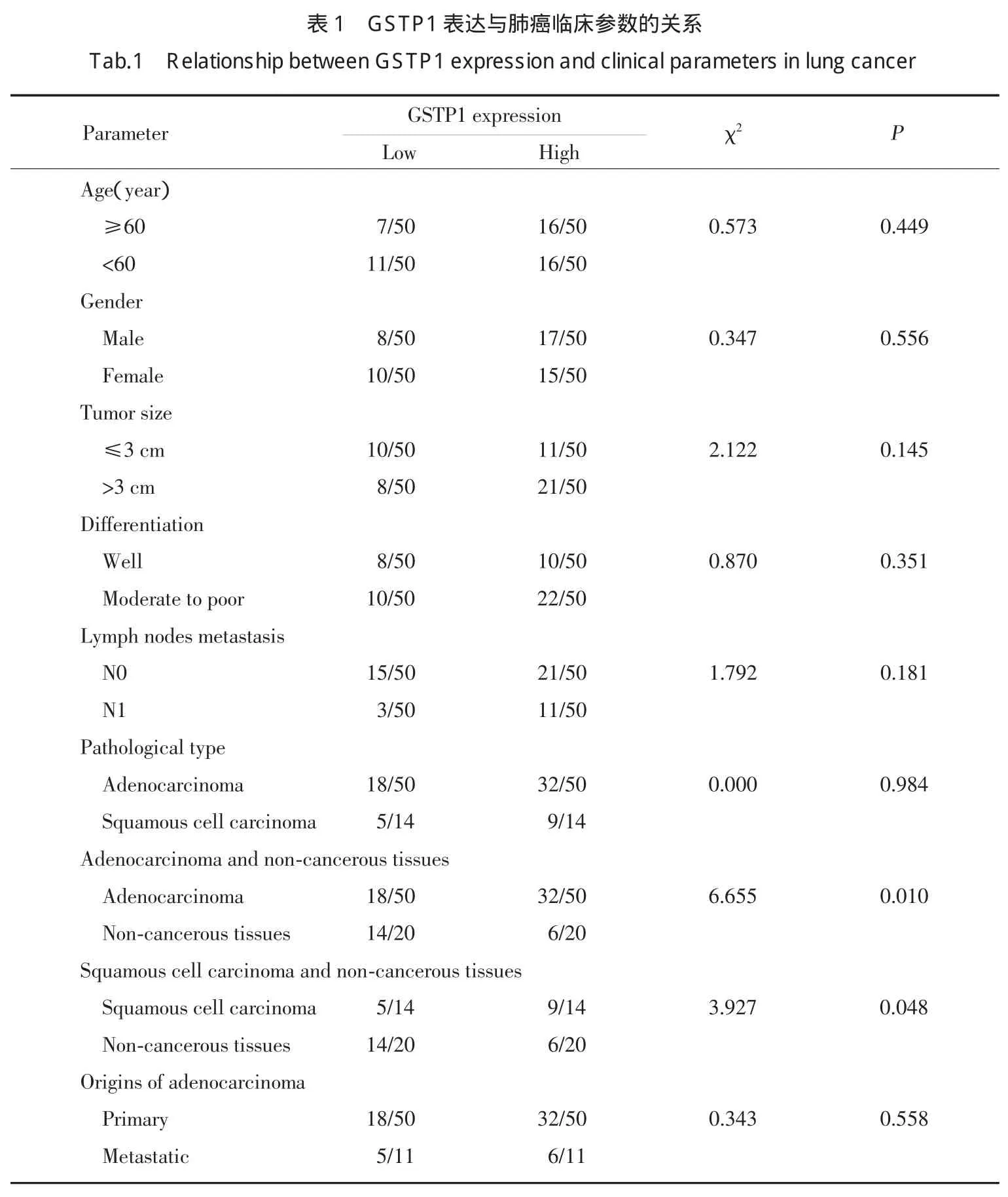
GSTP1在肺癌中呈胞核及胞质表达,在50例原发性肺腺癌及14例肺鳞癌组织中分别有32及9例呈高表达,明显高于癌旁正常组织表达水平(χ2=6.665,P=0.010;χ2=3.927,P=0.048)(图1,表1)。但GSTP1在原发性肺腺癌、肺鳞癌及肺转移性腺癌中的表达无明显差异(P>0.05)(表1)。
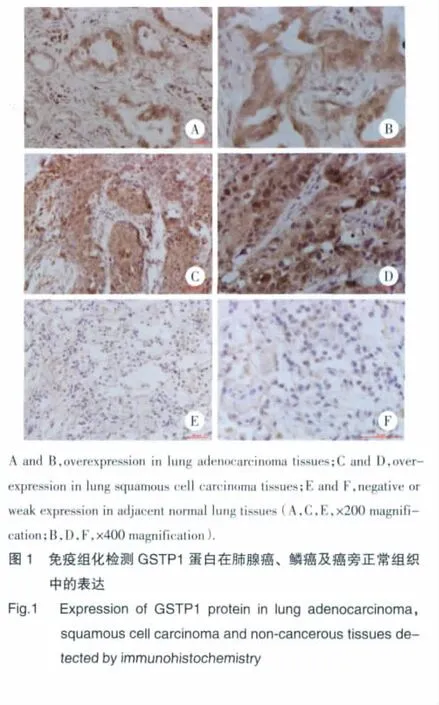
2.2 GSTP1蛋白表达与肺腺癌患者临床病理学参数的关系
χ2检验结果显示:GSTP1蛋白表达与肺癌患者年龄、性别、肿瘤大小、分化程度及淋巴结转移均无明显相关性(P>0.05)(表1)。
2.3 GSTP1蛋白表达与肺腺癌患者术后生存时间的关系
GSTP1高表达肺腺癌患者术后中位生存时间(37个月)明显低于GSTP1低表达患者(47个月),差异有统计学意义(χ2=4.171,P=0.041)(图2)。
2.4 Western blot结果
Western blot结果显示:肺癌旁组织 GSTP1/GAPDH灰度比为0.249±0.057,腺癌组织为0.370±0.089,鳞癌组织为0.337±0.084。与癌旁组织相比,GSTP1在肺腺癌与鳞癌中表达明显上调(t=2.545,P=0.023;t=2.337,P=0.035)(图3)。

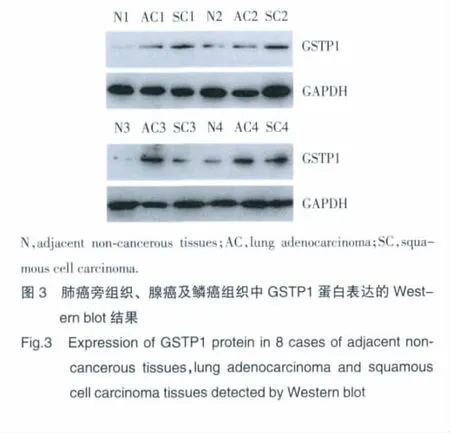
3 讨论
研究发现,卵巢正常组织、良性病变及癌变组织中,GSTP1表达阳性率逐渐上升;肿瘤分化程度越低、临床分期越晚其表达越强[11];乳腺良性病变、乳腺癌组织中GSTP1表达水平明显高于乳腺正常组织[5];唾液腺腺样囊性癌中GSTP1的表达也明显高于癌旁腺体[13]。但在结肠癌及前列腺癌中,GSTP1低表达或缺失能够促进肿瘤的发生[8,10]。此外,GSTP1可增强癌细胞对抗肿瘤药物的代谢与转运能力,使细胞产生抗药性。提示GSTP1与肿瘤中发生、发展及化疗耐药密切相关[14]。本研究通过免疫组化和Western blot证实,GSTP1在肺腺癌及鳞癌中的表达明显高于癌旁正常组织。虽然目前未见有关GSTP1在原发性肺腺癌、鳞癌及正常组织中表达差异的报道,但在非小细胞肺癌中已证实,GSTP1在肿瘤中表达水平明显高于癌旁正常组织[3,4]。提示GSTP1在癌变组织内的高表达可能是一种诱导表达的结果,即其在肿瘤恶性转变过程中被诱导激活而获得较高的表达量,GSTP1基因的转录激活是化学致癌早期或启动阶段的重要分子事件,很可能是一个启动信号或标志[15]。但GSTP1在不同病理类型及不同组织来源的肺癌中表达无明显差异,这与韩志刚等[16]报道另一个GST家族成员GST-π在非小细胞肺癌、肺鳞癌及腺癌中表达的结果一致。提示GSTP1不能作为判断肺癌病理类型及癌组织来源的一个可靠指标。
GSTP1在肺癌中表达上调,但与肺腺癌患者临床病理学参数均未见明显相关性。在非小细胞肺癌、食管癌及胃癌的研究中同样发现GSTP1表达与临床病理学参数无明显相关性[3,17,18],提示单纯检测GSTP1表达不能作为判断肿瘤侵袭等生物学行为的预测指标。此外,有限的样本量很难真实反映结果的客观性,后期我们将通过增加样本量并完善病历资料,进一步明确GSTP1与肺癌患者临床病理学参数的关系。
本研究结果还发现,GSTP1高表达肺腺癌患者较低表达患者预后不良。胃癌中同样发现GSTP1高表达组无复发生存率和总生存率均显著低于低表达组[18];食管癌中携带GSTP1变体Val等位基因患者较未携带者预后明显不良(P=0.045)[17]。此外,卵巢癌多因素分析发现,GSTP1高表达患者无病生存率及总生存率明显降低(Log-rank:P=0.047,P=0.033)[19],提示其可以作为评估肿瘤患者预后的1个独立指标。GSTP1可能通过以下3个方面影响肿瘤患者预后:(1)GSTP1 甲基化:Nelson 等[20]发现,90%以上的前列腺癌及70%前列腺上皮肉瘤发生GSTP1“CpG岛”甲基化,GSTP1甲基化致功能的缺乏使正常前列腺上皮细胞易受到各种致瘤性转化因素的攻击;(2)GSTP1多态性与肿瘤易感性:GSTP1基因多态性在肿瘤的发生中起重要作用,可引起其表达的相应酶的活性差异,导致解毒功能发生改变,从而增加个体对环境致癌物易感性及患肿瘤的危险[21,22];(3)肿瘤耐药性:GSTP1 能催化亲电子物质与还原型谷胱甘肽结合,并可与亲脂性细胞毒药物结合增强其水溶性,而促进药物排泄,降低抗癌药的作用。此外,GSTP1还能把抗癌药产生的过氧化物还原,抑制烷化剂类化疗药物引起的癌细胞DNA交联,最终减低药物对癌细胞的杀伤作用[14]。
综上所述,本研究结果表明,GSTP1在肺腺癌中表达上调,并与肺腺癌患者预后相关。
[1]支修益,陈东红.非小细胞肺癌外科治疗现状和进展[J].首都医科大学学报,2009,30(3):298-305.
[2]Sedat A,Serpil O,Nurdan G,et al.Immunohistochemical localization ofglutathione s-transferase isoenzymes (gsta,Gstp,Gstm4,and Gstt1)and tumour marker p53 in matched tissue from normal larynx and laryngeal carcinoma:correlations with prognostic factors[J].J Otolaryngol Head Neck Surg,2010,39(5):542-550.
[3]Oguztuzun S,Aydin M,Demirag F,et al.The expression of GST isoenzymesandP53innon-smallcelllungcancer[J].FoliaHistochem Cytobiol,2010,48(1):122-127.
[4]Grimminger PP,Maus MK,Schneider PM,et al.Glutathione S-trans-ferase PI (GST-PI)mRNA expression and DNA methylation is involved in the pathogenesis and prognosis of NSCLC[J].Lung Cancer,2012,78(1):87-91.
[5]Arun BK,Granville LA,Yin G,et al.Glutathione-s-transferase-pi expression in early breast cancer:association with outcome and response to chemotherapy[J].Cancer Invest,2010,28(5):554-559.
[6]俞鹏飞,郭剑民,徐琦.耐药基因相关蛋白在胃癌术后辅助化疗及预后评价中的意义[J].中华胃肠外科杂志,2010,13(4):289-293.
[7]Kim SH,Kwon HC,Oh SY,et al.Prognostic value of ERCC1,thymidylate synthase,and glutathione-S-transferase pi for5-FU/oxaliplatin chemotherapy in advanced colorectal cancer[J].Am J Clin Oncol,2009,32(1):38-43.
[8]Ritchie KJ,Walsh S,Sansom OJ,et al.Markedly enhanced colon tumorigenesis in ApcMin mice lacking glutathione S-transferase Pi[J].Proc Natl Acad Sci USA,2009,106(49):20859-20864.
[9]Kanwal R,Pandey M,Bhaskaran N,et al.Protection against oxidative DNA damage and stress in human prostate by glutathione S-transferase P1[J].Mol Carcinog,2012,doi:10.1002/mc.21939.
[10]Okino ST,Pookot D,Majid S,et al.Chromatin changes on the GSTP1 promoter associated with its inactivation in prostate cancer[J].Mol Carcinog,2007,46(10):839-846.
[11]Kolfschoten GM,Hulscher TM,Pinedo HM,et al.Drug resistance features and S-phase fraction as possible determinants for drug response in a panel of human ovarian cancer xengrafts[J].Br J Cancer,2000,83(7):921-927.
[12]Sung CO,Han SY,Kim SH.Low expression of claudin-4 is associated with poor prognosis in esophageal squamous cell carcinoma[J].Ann Surg Oncol,2011,18(1):273-281.
[13]韩婧,张春叶,夏荣辉,等.GSTP1在唾液腺腺样囊性癌中的表达及意义[J].中国口腔颌面外科杂志,2011,9(3):212-216.
[14]Ruzza P,Rosato A,Rossi CR,et al.Glutathione transferases as targets for cancer therapy[J].Anticancer Agents Med Chem,2009,9(7):763-777.
[15]王琳,吴逸.GSTP1与肿瘤关系的研究进展[J].国外医学卫生学分册,2006,33(5):300-304.
[16]韩志刚,单利,刘春玲.晚期非小细胞肺癌患者血清酸性谷胱甘肽-S转移酶的表达及临床意义[J].肿瘤防治研究,2007,34(5):336-339.
[17]Lee JM,Wu MT,Lee YC,et al.Association of GSTP1 polymorphism and survival for esophageal cancer[J].Clin Cancer Res,2005,11(13):4749-4753.
[18]华东,黄朝晖,邓建忠.GSTP1、MRP mRNA表达与胃癌辅助化疗预后的关系[J].肿瘤学杂志,2008,14(5):397-399.
[19]Kolwijck E,Zusterzeel PL,Roelofs HM,et al.GSTP1-1 in ovarian cyst fluid and disease outcome of patients with ovarian cancer[J].Cancer Epidemiol Biomarkers Prev,2009,18(8):2176-2181.
[20]Nelson WG,De Marzo AM,Deweese TL,et al.The molecular pathogenesis of prostate cancer:Implications for prostate cancer prevention[J].Urology,2001,57(4 Suppl1):39-45.
[21]何英,周钢桥,李欣,等.GSTM1基因编码区SNP位点T1270533G与鼻咽癌的相关性[J].南方医科大学学报,2009,29(1):36-39.
[22]王亚林,江军.谷胱甘肽巯基转移酶基因多态性与前列腺癌风险相关性[J].临床泌尿外科杂志,2005,20(2):123-126.

