截短NDV F 蛋白的原核表达
王杰,王宇鹏,刘振格,杨鸣发,林红丽,田斌,侯喜林
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.黑龙江八一农垦大学生命科学技术学院)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的一种高度接触性传染病。NDV 属副粘病毒科、副粘病毒亚科、腮腺炎病毒属[1-2],禽副粘病毒Ⅰ型(APMV-Ⅰ),是一种有囊膜的单链负股RNA 病毒。
新城疫病毒的感染能力主要是由两个外膜蛋白决定的;一个是血凝素神经氨酸酶(HN),另一个是融合蛋白(F)。HN 蛋白参与病毒粒子与宿主细胞表面受体吸附过程,F 蛋白介导病毒与宿主细胞膜之间发生融合,进而使病毒侵入宿主细胞,达到致病的目的[3]。据报道,在鸡的被动免疫过程中,相应的单克隆抗体可以直接作用于F 蛋白的2 个抗原表位,抑制病毒增殖,从而成功的预防了由该病毒导致的鸡的死亡[4]。因此,HN 蛋白和F 蛋白成为目前亚单位疫苗和基因疫苗研究的首选抗原[5-6]。
由于F 蛋白的结构比较复杂,在原核表达系统中很难获得全蛋白的高效表达,所以本研究根据已知的F 蛋白的3 个中和抗原表位(第72、161 和343个氨基酸残基上),对NDV LaSota 株F 蛋白基因的三个抗原表位进行分段克隆,期望在原核表达系统中获得高效表达。并对重组蛋白进行检测与分析,为以后NDV 的诊断方法和疫苗研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 毒株、菌种、载体
NDV LaSota 弱毒疫苗株购自哈尔滨维科生物技术开发公司(生产批号:080012040),E.coli DH5α 和BL21(DE3)由本实验室保存,原核表达载体pET-30a(+)由本实验室保存,克隆载体pMD18-T 购自于大连宝生物工程有限公司。
1.1.2 主要试剂
BamH Ⅰ和Hind Ⅲ限制性内切酶购自宝生物工程(大连)有限公司;T4 DNA 连接酶购自Promega 公司;胶回收试剂盒、质粒纯化试剂盒购自北京索莱宝公司;NDV 标准阳性血清购自哈尔滨兽医研究所,HRP 标记的羊抗鸡IgG-购自北京博奥森生物技术有限公司。
1.1.3 引物设计
参照GenBank 中已发表的LaSota(登陆号:AF077761.1)株的F 基因,设计两对特异性引物,在每对引物的上、下游5′端加入保护性碱基和BamH Ⅰ、Hind Ⅲ限制性内切酶切位点(酶切位点用下划线标出),送往上海生工生物技术有限公司合成。引物序列如下:

表1 PCR 反应引物Table 1 Primers for PCR
1.2 方法
1.2.1 F780和F760片段的扩增
提取鸡胚尿囊液中(NDV 标准LaSota 株)的RNA,反转录成cDNA。RT-PCR 扩增体系如下:ddH2O 18.3 uL;La Taq Buffer 2.0 uL;dNTP(2.5 mM)2.0 uL;上下游引物各1.0 uL;模板cDNA 0.5 uL;La Taq 0.2 uL。F780反应条件:94 ℃预变性5 min;94 ℃40 s,62 ℃40 s,72 ℃40 s,共30 个循环;72 ℃延伸10 min。F760反应条件:94 ℃预变性5 min;94 ℃40 s,61 ℃40 s,72 ℃45 s,共30 个循环;72 ℃延伸10 min。将PCR 产物经1%琼脂糖凝胶电泳检查结果。
1.2.2 PCR 产物的克隆与测序
PCR 产物采用琼脂糖凝胶DNA 回收试剂盒回收目的片段,将回收的目的片段连接到pMD18-T 载体上,转化DH5α 感受态细胞中,均匀涂布于LB/AMP+固体培养基上,37 ℃培养过夜,至出现单个菌落。挑取阳性单个菌落经BamHⅠ、Hind Ⅲ限制性内切酶双酶切鉴定,并送上海生工生物工程技术服务有限公司测序。
1.2.3 重组表达载体的构建
将实验室保存的pET30a(+)质粒经BamHⅠ和Hind Ⅲ限制性内切酶进行双酶切,将酶切产物回收,获得目的片段。将目的片段与载体片段进行连接,采用10 μL 连接体系:10×T4 ligase Buffe 1.0 μL,T4 DNA ligase 0.5 μL,目的片段6.0 μL,pET30a(+)载体2.5 μL。22 ℃水浴连接过夜。将连接产物转入BL21 感受态细胞中,冰水浴30 min,42 ℃水浴热休克90 s,立即冰浴2 min,然后加入800 uL 预热的LB无抗性液体培养基,37 ℃220 r·min-1摇床上振荡45~60 min,5 000 r·min-1离心5 min,弃上清,留下约100~200 μL 菌液混匀后,均匀涂于含Kan+的LB 平板上,放置37 ℃培养箱中培养过夜。
1.2.4 重组菌的诱导表达
将阳性重组菌和空载体分别接入到含Kan+的LB 液体培养基中,37 ℃培养,当OD600达到0.5~0.8时,在菌液中加入IPTG(终浓度为1 mmol·L-1),进行诱导表达。分别在诱导后3、5 小时取出1 mL 菌液,经SDS-PAGE 分析,观察结果。
1.2.5 Western blot 鉴定
重组蛋白经SDS-PAGE 电泳后,将其转移到NC膜上。将转移成功的NC 膜浸入5%脱脂乳中,置于水平摇床上4 ℃封闭过夜,次日用PBST 洗涤3 次;每次10 min,将膜浸入1∶500 稀释的NDV 多抗血清中,室温作用2 h,洗涤3 次;将膜浸入以1∶2000 稀释的HRP 标记的羊抗鸡IgG 中,室温缓慢振荡1 h,在DAB 中显色并观察结果。
2 结果
2.1 RT-PCR 扩增结果
利用两对特异性引物对NDV LaSota 疫苗株F基因进行RT-PCR 扩增,经1%琼脂糖凝胶电泳分析,分别在705 bp 和624 bp 出现两条清晰的条带,与预期的目的片段大小一致,结果见图1。

图1 PCR 产物的琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of PCR product
2.2 重组表达质粒pET30-F760、pET30-F780 PCR 和双酶切鉴定结果
重 组 质 粒pET30-F760、pET30-F780经BamH I、Hind Ⅲ限制性内切酶双酶切,1%琼脂糖凝胶电泳分析后,得到5422 bp 的pET30 载体片段和两条大小为705 bp 和624 bp 的目的片段(图2),结果表明目的片段已经克隆到pET30a(+)表达载体上,成功构建了pET30-F760、pET30-F780原核表达系统。
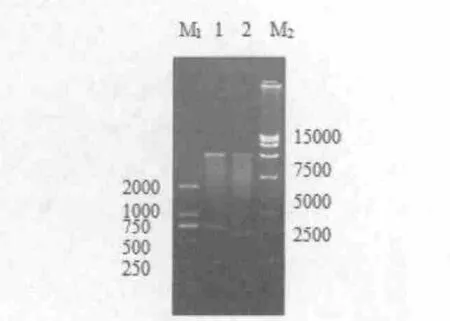
图2 重组质粒pET30-F760、pET30-F780 的双酶切鉴定Fig.2 Identification of pET30-F760、pET30-F780by enzyme digestion
2.3 重组蛋白的SDS-PAGE 结果
经IPTG 诱导后,重组蛋白经12% SDS-PAGE分析后,清晰可见大小分别为27.9 kDa 和31.1 kDa的蛋白条带,大小与目的蛋白的理论值一致(图3)。

图3 重组质粒pET30-F760、pET30-F780表达产物SDS 分析结果Fig.3 SDS-PAGE results of the pET30-F760 and pET30-F780 recombinant protein expressed
2.4 重组蛋白的Western blot 鉴定结果
将经过SDS-PAGE 电泳后获得的目的蛋白条带转印到NC 膜上,以鸡源抗NDV 阳性血清作为一抗,以HPR 标记的羊抗鸡IgG 作为二抗,最后经DAB 显色,在相对分子量约27.9 kDa 和31.1 kDa 处各出现一条明显的棕色条带,与预计的目的片段大小一致,而阴性对照并未出现任何条带(图4)该结果说明表达的重组蛋白具有良好的免疫反应性。

图4 重组蛋白的Western blot 检测结果Fig.4 Western blot analysis of the recombinant protein
3 讨论
由于NDV F 蛋白结构的复杂性,在原核表达系统中很难获得F 基因的全长表达。冉旭华[7]曾尝试将NDV F48E8 株的完整的F 蛋白进行表达,结果没有成功。孙淑娜[8]也曾尝试表达LaSota 株的F 蛋白,却得到了同样的结果。在后续的研究中张桂芝将(F48E9)的F 蛋白去掉了N 端信号肽和C 端跨膜区,并根据F 蛋白已知的三个抗原表位的位置,分别位于第72、161 和343 个氨基酸残基上,将F 蛋白分成两段进行原核表达。程宝艳[9]则将三个抗原表位分别单独表达,结果二者都成功的获得了截断蛋白的高效表达。研究对NDV LaSota 株F 蛋白基因的三个抗原表位进行了分段克隆,通过大肠杆菌原核表达系统进行表达。成功的获得的截断蛋白的高效表达。并通过研究了解NDV 部分抗原表位的特点,为以后NDV F 蛋白在亚单位疫苗方面的研究奠定基础。
[1] 殷震,刘景华.动物病毒学[M]. 2 版.北京:科学出版社,1997.
[2] 陶静,叶红. 新城疫F 蛋白基因工程疫苗的研究现状[J].安徽农业科学,2011,39(17):10468-10469.
[3] Corey E A,Mirza A M,Levandowsky E,et al. Fusion deficiency induced by mutations at the dimer interface in the Newcastle disease virus hemagglutinin-neuraminidase is due to a temperature -dependent defect in receptor binding [J]. Journal of Virology,2003,77(12):6913-6922.
[4] Umino Y,Kohama T,Sato T,et al. Protective effect of monoclonal antibodies to newcastle disease virus in passive immunization [J]. Journal of general virology,1990,71(5):1199-1203.
[5] 孙景秀,王桂华,侯喜林.锚定NDV HN 蛋白重组干酪乳杆菌诱导雏鸡黏膜免疫应答[J].黑龙江八一农垦大学学报,2012,24(2):43-47.
[6] Wu Y,Peng DX,Liu X,et al. A recombinant fowlpox virus expressing the fusion protein of Newcastle disease virus strain F48E8 and its protective efficacy[J].Chinese journal of biotechnology,2000,16(5):591.
[7] 冉旭华,闻晓波,赵喜红.新城疫病毒F 和HN 蛋白的原核表达[J]. 生物技术,2008,18(3):11-13.
[8] 孙淑娜. 新城疫病毒F 基因和HN 基因的克隆、表达及其ELISA 抗体检测方法的初步建立[D]. 武汉:华中农业大学,2006.
[9] 程宝艳. NDV F 蛋白抗原表位结构域基因的表达及免疫原性研究[D]. 合肥:安徽农业大学,2008.

