紫花苜蓿茎尖离体再生体系的建立
郭永霞,孙强,王丽艳,荆瑞勇,殷奎德
(黑龙江八一农垦大学,大庆 163319)
紫 花 苜 蓿(Medicago sativa L.) 属 于 豆 科(leguminosae)苜蓿属多年生牧草作物,因其品质优良而成为世界上种植面积最大并且经济效益最高的牧草[1]。随着现代分子生物学的快速发展,人们利用转基因技术来对紫花苜蓿进行品种改良,成为目前紫花苜蓿研究领域的新方向和热点[2]。1972 年,美国学者Saunders 等[3]利用苜蓿子房、未成熟的花药、子叶诱导愈伤组织,进一步诱导分化,成功获得再生植株,标志着苜蓿再生体系研究的开始。由于基因的遗传转化多采用愈伤组织进行,因此通过愈伤组织进行再生体系建立研究的比较多[4-6]。但其有一个弊端就是转基因成功后不能直接进行快速繁殖,如果能够利用茎尖进行快速繁殖则能够有效的解决这一问题,因此试验利用紫花苜蓿无菌苗茎尖为材料,建立离体再生体系,为转基因后植株的快速繁殖奠定基础。
1 材料和方法
1.1 试验材料
紫花苜蓿成熟种子,“敖汉苜蓿”,取自黑龙江省畜牧研究所。
1.2 消毒方法
选取健康饱满的紫花苜蓿种子,首先用75%的乙醇浸泡30~45 s,将乙醇倒出后加入0.1%的升汞浸泡10 min,倒掉后用无菌水冲洗4~5 次,备用。
1.3 无菌苗的获得
将消毒好的种子接种到MS 培养基中,种子萌发获得无菌苗。
1.4 茎尖的分化增殖
将无菌苗茎尖切下后接种到茎尖分化增殖培养基中。
培养基的设计采用在MS 培养基中分别添加6-BA 的浓度为0.5、1.0 、1.5、2.0 mg·L-1;NAA 的浓度为0.05 、0.1 、0.2、0.5 mg·L-1;最适激素浓度配比的筛选采用二因素完全随机设计进行,总计16 个处理组合(见表1)。将种子萌发得到的无菌苗的茎尖切下后接入到表1 的培养基中进行培养,每个处理接种10 瓶,每瓶接种4 个茎尖,每个处理总计接种40个茎尖。30 d 后统计其增殖系数。以增殖系数为指标进行来最适培养基的筛选。增殖系数=分化出芽的总数/茎尖总个数。
1.5 组培苗生根
将分化出的丛生芽分成单株,接种在生根培养基中。
培养基的设计采用在MS 培养基中分别附加0 、0.01 、0.05、0.10 mg·L-1IBA,每个处理接种20 瓶,每瓶接种1 株,每个处理总计接种20 株。20 d 后统计侧根的条数及生根率。
1.6 培养条件
所有培养基皆以浓度为0.8%的植物琼脂固化,加入的蔗糖浓度为3%,在高温高压灭菌前将pH 值调至5.8,培养室的温度为(25±2)℃。光照强度为1 500~2 000 Lx,每天光照时数为12~14 h。
2 结果与分析
2.1 种子发芽获得无菌苗
将灭好菌的种子在超净工作台中接种到MS 培养基中进行培养,培养7 d 时统计发芽情况。结果显示,当培养7 d 时,发芽率达到了100%,并且无菌苗长势良好,没有污染(见图1)。

图1 紫花苜蓿种子发芽Fig.1 Buds of Medicago sativa L.
2.2 紫花苜蓿茎尖分化增殖培养
将由种子发芽获得的无菌苗茎尖切下,接种到添加不同激素浓度配比的处理组合中,培养30 d 后,茎尖分化出丛生芽(见图2),对其进行相关数据的统计分析,结果见表1。

图2 紫花苜蓿茎尖分化增殖Fig.2 Differentiation and proliferation of Medicago sativa L. stem tip

表1 植物激素配比对紫花苜蓿茎尖分化增殖培养的影响Table 1 Effects of plant hormon ratio on proliferation of Medicago sativa L. stem tip
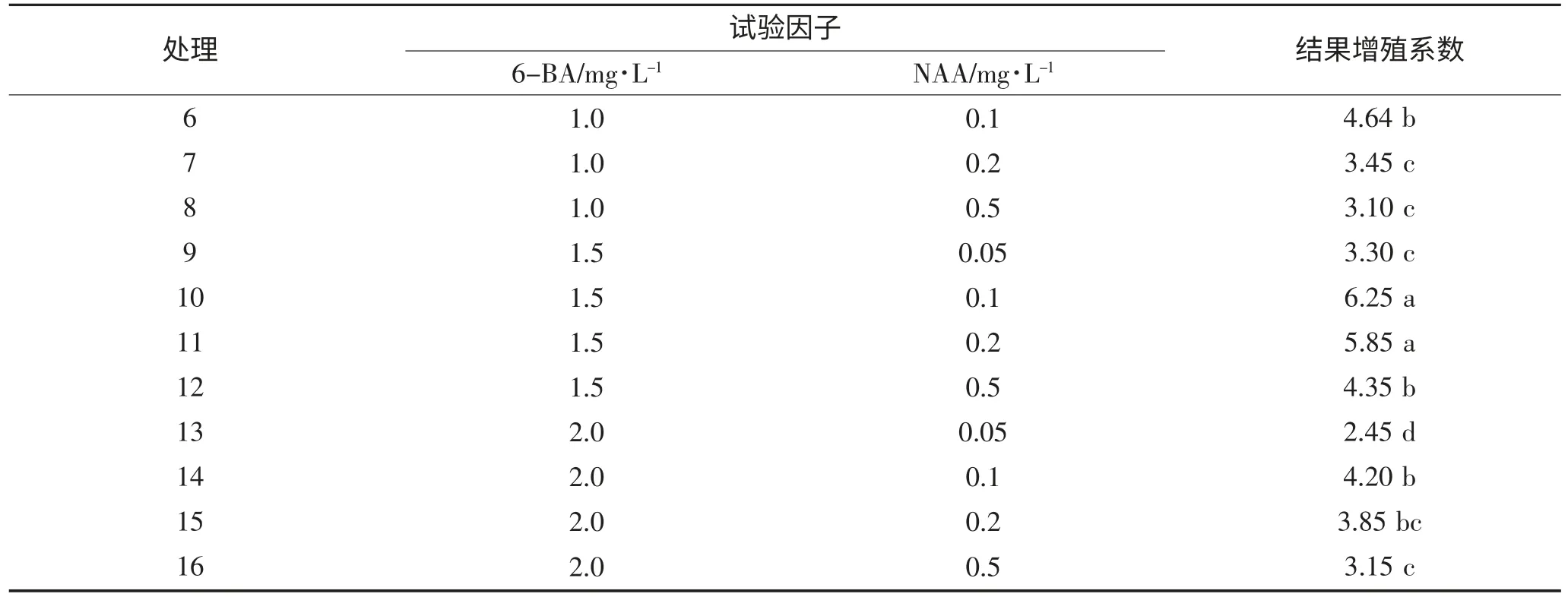
续表1 植物激素配比对紫花苜蓿茎尖分化增殖培养的影响Continued table1 Effects of plant hormon ratio on proliferation of Medicago sativa L. stem tip
从表1 可以看出,在处理1~4 培养基中紫花苜蓿茎尖的增殖系数为0,即不能分化增殖,而在处理5~16的培养基上紫花苜蓿均有不同程度的分化增殖,但增殖系数各不相同,其中处理10 的增殖系数最大为6.25,其次是处理11,增殖系数为5.85,从方差分析可以看出处理10 与处理11 之间差异不显著,而两个处理与其他各处理之间差异达显著。从表中还可以看出,两种激素即6-BA 和NAA 对紫花苜蓿的增殖系数均产生一定的影响,其中当6-BA 的浓度为0.5 mg·L-1时,无论NAA 的浓度是多少紫花苜蓿茎尖的增殖系数均为0。当6-BA 的浓度增大到1.0~2.0 mg·L-1时,紫花苜蓿均有不同程度的增殖,当浓度为1.5 mg·L-1时,增殖系数均较高;在此6-BA 浓度下,NAA 的浓度对增殖系数也有一定的影响,当浓度在0.05~0.2 mg·L-1范围内,随着NAA 浓度的增加增殖系数呈先增大后降低的趋势。当NAA 浓度为0.1 mg·L-1时,增殖系数最大。因此试验筛选出紫花苜蓿茎尖分化增殖的最佳培养基为MS+6-BA1.5 mg·L-1+NAA0.1 mg·L-1。紫花苜蓿分化增殖情况见图2。
2.3 紫花苜蓿组培苗生根
选择增殖培养后生长健壮的试管苗,将试管苗分成单株,分别接种到不同的生根培养基上培养,20 d 时观察生根情况并统计结果(表2)。统计结果表明,IBA 的浓度以0.05 mg·L-1为最佳,平均侧根数最多为28.5 条,平均生根率也最大达到93.5%。从方差分析可以看出,在此浓度下的平均侧根数以及平均生根率与其他各浓度差异均达到显著水平,因此筛选出的最适生根培养基为MS+IBA0.05 mg·L-1。紫花苜蓿生根情况见图3。

图3 紫花苜蓿生根情况Fig.3 Rooting conditions of Medicago sativa L.

表2 生长素对紫花苜蓿组培苗生根的影响Table 2 Effects of NAA on rooting of seeding in tissue culture
3 结论
紫花苜蓿茎尖分化增殖的最佳培养基为MS+6-BA1.5 mg·L-1+NAA0.1 mg·L-1,平均增殖系数为6.25;紫花苜蓿组培苗生根的最适培养基为MS+IBA0.05 mg·L-1,平均侧根数为28.5 条,平均生根率达到93.5%。以往进行组织培养时主要是利用下胚轴为材料,通过诱导愈伤组织,完全脱分化后,再进一步进行分化增殖的[4-7],而利用茎尖做材料进行增殖培养的研究鲜有报道。试验中以紫花苜蓿的茎尖为试验材料,进行丛生芽的诱导,分化形成大量的丛生芽,增殖系数最大为6.25。虽然增殖系数不太高,但培养周期短,并且能够培养增殖多代,为通过基因工程进行遗传转化后转基因植株的快速繁殖奠定了基础。
[1] 王文斌. 紫花苜蓿耐逆性及AtNDPK2、codA 基因的遗传转化研究[D].杨凌:西北农林科技大学,2009.
[2] 马晖玲,卢欣石,曹致中,等.紫花苜蓿基因转化的影响因素分析[J].草业学报,2006,15(5):94-102.
[3] Saunders J W,Bingham E T. Production of alfalfa plants from callus tissue[J]. Crop Science,1972,12(6):804-808.
[4] 杨丽辉,陈耀锋,韩巧玲,等.紫花苜蓿下胚轴高频离体再生体系的建立[J]. 西北农林科技大学学报,2008,36(11):29-34.
[5] 杨起简,周禾,孙彦,等.紫花苜蓿的愈伤组织诱导及组织培养[J].北京农学院学报,2004,19(2):28-30.
[6] 刘青芳,步怀宇,赵宇玮,等.紫花苜蓿离体培养植株再生及其RAPD 分析[J].草业学报,2006,15(5):115-121.
[7] 宋淑敏,刘伟伟,潘静,等.大蒜花序轴离体培养产生鳞茎方法的研究[J].黑龙江八一农垦大学学报,2012,24(2):5-7.

