外源Toll 样受体2 转基因绵羊的构建与鉴定
张弘韬,潘求真,冯国兴,邓守龙,连正兴
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.中国农业大学动物科技学院)
Toll 样受体2(Toll-like receptor 2,TLR2)是Toll样受体家族的一种受体,研究结果表明TLR2 识别的病原配体种类最多。TLR2 作为一种广谱病原相关分子模式识别受体,能识别革兰氏阳性细菌[1],还能识别革兰氏阴性细菌、真菌、结核杆菌、螺旋体以及支原体等,它在多种病原微生物所引起的感染中均起重要作用,被归属为中枢性模式识别(Central pattern recognition)受体,受到高度的关注[2]。而且,TLR2 具有很大数量的配体,这些配体可以通过TLR2 信号转导途径诱导激活免疫系统,它参与炎症因子其释放的信号转导过程,能够激活先天性免疫以及获得性免疫[3]。
转基因动物是指将外源基因稳定整合到自身染色体内并能稳定遗传的一类动物。原核显微注射法是直接把DNA 注射到受精卵的原核中。Gordon 等[4]首次采用原核显微注射法将外源基因导入小鼠的受精卵。此后Hamme 等[5]将鼠的金属硫蛋白基因和人生长激素基因转入绵羊中,成功获得了使用显微注射法制备的世界上第一只转基因羊。
原核显微注射法制备转基因羊包括以下主要程序:首先制备具有良好表达活性的目的基因,然后用显微注射装置把目的基因导入到羊的受精卵雄性原核,将含有外源基因的受精卵移植入到受体母羊的输卵管,再经过妊娠和分娩,最后获得后代。这种方法可靠且重复性好,但其制作效率很低[5]。因为这种整合方法具有较大的随机性,不能够进行定点整合。当外源基因被注入到原核后,可以插入到受体染色体基因组的任何一个部位,而且是完全随机,这就导致基因的表达以及遗传的稳定性得不到保证,从而造成子代非转基因个体较多。因此,对转基因子代的检测与鉴定尤为重要。
通过显微注射的方法对绵羊进行外源基因TLR2 整合,通过PCR、Southern blotting、Real time PCR 对其进行鉴定,确认TLR2 转基因绵羊,为通过转基因绵羊模型研究TLR2 基因在绵羊抗病中的作用提供基础。
1 材料与方法
1.1 3S-Loxp-TLR2 载体的构建
摘取刚宰杀的绵羊的脾脏,放入液氮中保存然后带回实验室。参照试剂盒的说明书用EASYspin 组织/细胞RNA 快速提取试剂盒(RNA kit,OMEGA)提取总RNA。采用M-MLV 反转录酶(Promega)按其操作说明进行cDNA 合成。根据NCBI 上发表TLR2基因(GenBank ID∶GU984 768.1)序列,使用primer 5软件进行引物设计。引物用于绵羊TLR2 基因的克隆及真核表达载体的构建,上游引物加上酶切位点XhoI 和保护性碱基taa;下游引物加上酶切位点BmaI 和保护性碱基ta;引物是由上海生物工程技术服务有限公司合成,序列如下:Sheep TLR2-F:5'-TAA CTC GAG ATG CCA CGT GCT TTG TGG AC-3',Sheep TLR2-R:5'-TAG GAT CCC TAG GAC CTT ATT GCA GCT C-3'。
切除载体pEGFP-N1 中的EGFP,得到载体pN1,在pN1 两侧分别连接一个LoxP,再与载体pIRES2-EGFP 进行连接,得到3S-Loxp 的质粒。将3S-Loxp 质粒转化DH5α 感受态细胞,37 ℃恒温摇床过夜培养后,使用小量质粒提取试剂盒提取质粒。用XhoI、BmaI 两种限制性内切酶分别酶切T- TLR2质粒和3S-Loxp 质粒,胶回收后连接,将连接产物转化DH5α 感受态细胞,然后挑取单菌落37 ℃恒温箱过夜培养。取5 mL 菌液提取质粒,然后-20 ℃保存备用。双酶切鉴定及测序后正确的质粒进行大量扩增提取[6]。
1.2 实验动物与转基因注射
提纯3S-Loxp-TLR2 质粒,显微注射到绵羊精卵雄核,注射后在M16 继续培养2~4 h,挑选生长状态好的卵移卵于绵羊输卵管中。注射羊为3 年龄杜寒杂交羊,体重为50 kg 左右,转基因动物扩繁工作于2010~2012 年在天津试验羊牧场完成。非转基因普通奶绵羊为该试验羊牧场同种绵羊。
1.3 TLR2 转基因羊的PCR 鉴定
转基因羊与非转基因羊均为6 月龄杜寒杂交羊,体重为25 kg。分别对每只待测羊剪耳采样,采用分子克隆实验指南的酚-氯仿抽提方法提取DNA,使用Thermo 公司的DreamTaq 酶进行PCR 检测。PCR检测设计了两对引物,第一对引物的上游引物位于CMV 片段上,下游引物位于TLR2 片段上,第二对引物的上游引物位于TLR2 片段上,下游引物位于SV40 片段上。引物序列分别为:cmvTLR2F:5′-TGT TCC CAT AGT AAC GCC AAT A-3′,cmvTLR2R:5′-ACA GAG AAG AAG CCT GAT GAG AG -3′;TLR2sv40F:5′-TTC TCC CAC TTC CGT CTC-3′,TLR2sv40R:5′-CCC TAT CTC GGT CTA TTC TT-3′,扩增的目的片段约565 bp 和618 bp。PCR 扩增体系:94 ℃预变性3 min;94 ℃变性30 s、58 ℃退火30 s、72℃延伸40 s,35 个循环;72 ℃延伸10 min,4 ℃保存。5 μL 扩增产物,在1%Agrose、120 V 条件下电泳20 min 后拍照鉴定。两对PCR 结果都呈阳性的个体,为整合转基因羊。
1.4 TLR2 转基因羊的Southern blot 鉴定
采用DIG(Roche)标记,用PCR 方法扩增作为探针。20 μg 基因组DNA 分别加入6 μL 的内切酶NdeI、HindⅢ-HF,总体积200 μL,37 ℃消化过夜。真空干燥浓缩至50 μL,0.8%琼脂糖胶分离酶处理的DNA,转移到Hybond-N+尼龙膜(GE Healthcare Life Sciences 产 品,RPN303B),UV 交 联 仪 固 定。用15 mL Dig Easy Hyb granules(Roche)进行预杂交,用DIG 标记的探针进行杂交。用含有2×,0.5×SSC,0.1% SDS 溶液洗涤滤膜,X 光片曝光处理。
1.5 转基因羊的TLR2 表达量的测定
采集转基因羊与对照羊血液,分离单核细胞,提取RNA(TRIzol Reagent,Invitrogen),反转录成cDNA(Thermo)。采用时实定量PCR 法测定转基因羊与对照羊的TLR2 表达量。定量PCR 引物的设计与序列根据外源基因的碱基序列,利用软件Primer 5 设计。引物:F:5′- TGC TGT GCC CTC TTC CTG TT-3′;R:5′GGG ACG AAG TCT CGC TTA TGA A-3′。
反应于Agilent Stratagene 实时荧光定量PCR 仪(吉泰生物有限公司)。25 μL 反应体系的包括:引物0.3 μM,模版1 μL,2 × SRBR Green Mix 12.5 μL,补水至25 μL,按照如下的程序进行反应:95 ℃10 min,95 ℃30 s,60 ℃30 s,72 ℃20 s,共40 循环。转基因羊TLR2 基因表达量的定量分析按照Karsai 的方法[7]进行。采用相对定量法计算目标基因转录的变化倍数[8],β-actin 为内参基因。用实时定量PCR 检测mRNA 表达,利用已知起始拷贝数的标准品作出标准曲线,从标准曲线上即可计算出样品的起始拷贝数。
1.6 统计学处理
所有数据用SAS 9.1 进行单因素方差分析,P<0.05 为差异有统计学意义。
2 结果与分析
2.1 构建的3S-Loxp-TLR2 重组载体的酶切鉴定
3S-Loxp-TLR2 载体如图(图1)所示。用XhoI 和BamHI 对3S-Loxp-TLR2 质粒进行双酶切后电泳,结果显示3S-Loxp-TLR2 酶切为两条带,大小别为2.35 kbp 和5.3 kbp (图2);结果表明构建的3S-Loxp-TLR2 重组载体正确。
2.2 TLR2 转基因羊的PCR 鉴定
将p3S-LoxP-TLR2 质粒AseI 酶切线性化,经纯化和稀释为5 ng·μL-1后作为显微注射用的DNA。共注射148 个受精卵,移植到41 只受体羊中,共产下15 只小羊。第一对引物跨MCV 和TLR2,第二对引物跨TLR2 和SV40,所以野生型羊不会有扩增产物。PCR 扩增结果显示,转基因成功羊产物约为565 bp和618 bp(图3,图4),且在15 个小羊中有9 只小羊的PCR 扩增出现目的条带。

图2 XhoI 和BamHI 双酶切质粒结果Fig.2 p3S-LoxP-TLR2 plasmids digestion result by XhoI and BamHI

图3 引物为cmvTLR2F/R 转基因羊的PCR 结果Fig.3 Result of transgenic sheep by PCR of primer cmvTLR2F/R
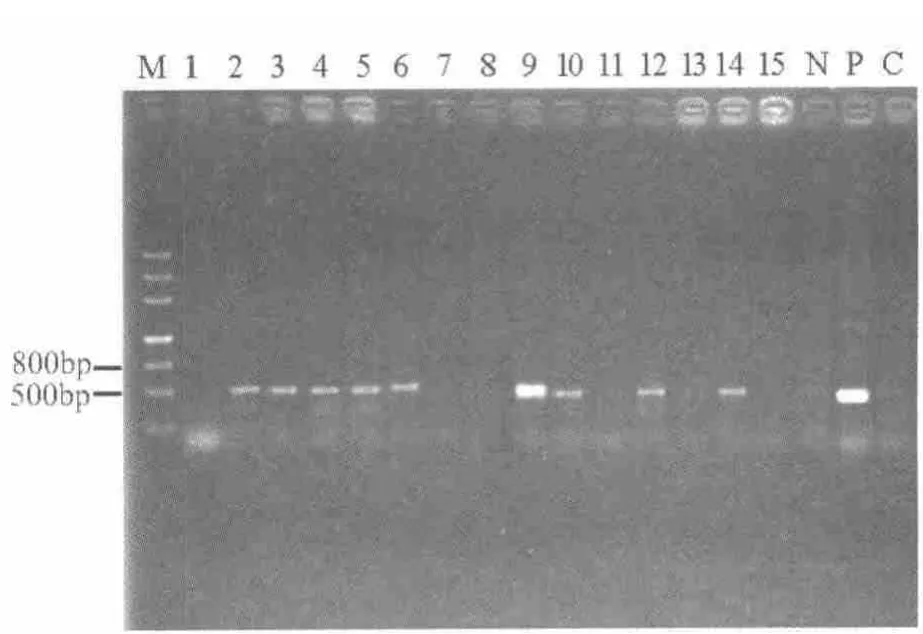
图4 引物为TLR2sv40F/R 转基因羊的PCR 结果Fig.4 Result of transgenic sheep by PCR of primer TLR2sv40F/R
2.3 TLR2 转基因羊的Southern blot 鉴定
以不同拷贝数的p3S-LoxP-TLR2 质粒对照,对导入绵羊中的目的TLR2 基因进行Southern blot 分析,并检测其拷贝数。Southern 杂交结果发现,PCR 检测阳性的转TLR2 小羊的基因组中8 只整合了TLR2基因,且均为单拷贝(图5)。

图5 转基因羊的Southern 分析Fig.5 Southern analysis of transgenosis sheep
2.4 转基因羊的TLR2 表达量的测定
采用时实定量PCR 方法检测转基因羊TLR2 表达量,结果表明,转基因羊的TLR2 mRNA 表达明显高于对照(P<0.05)(图6)。结果还显示,在转基因羊之间无明显表达差异,在非转基因内也无明显表达差异,但在转基因羊与非转基因羊间有明显表达差异。

图6 相对定量检测TLR2 mRNA 的表达Fig.6 Relative quantitative analysis of TLR2 mRNA expression
3 讨论
实验中所用的载体是由pIRES2-EGFP 质粒改造而成,命名为3S-Loxp。该载体全长为5.3 kb,其含有SV40 early ployA 信号序列、SV40 复制起始位点、SV40 早期启动子、人巨细胞病毒早期启动子(Human cytomegalovirus immediate earlypromoter,pCMV)、内部核糖体进入位点序列(Internal ribosome entry site,IRES)、增强型绿色荧光蛋白、卡那和新霉素抗性基因和pUC 质粒复制起始位点。这个载体能够在大肠杆菌中高拷贝复制,而且在多数动物细胞中也能高效表达。3S-Loxp 载体因为带有SV40 早期启动子和pCMV 启动子,它们都是组成型的强启动子,因此3S-Loxp 载体的转录状态比较恒定。又因为这些启动子在动物细胞中没有明显的调节控制因子,所以它的转录与表达很少受到其他调控因素的干扰。这个表达载体还有一个优点,因为它含有绿色荧光蛋白(Green Fluorescent Protein,GFP)基因,利用这个蛋白可以实时监测蛋白的表达并定位。另外,该载体还带有一个筛选标记(新霉素抗性基因,Neor),可以用G418 来对阳性细胞进行筛选,从而鉴定转染外源基因的细胞。此外,3S-Loxp 载体上还有保证转基因安全性的两个序列,即两个同方向的Loxp 序列,如果用Cre 酶处理后可以从转基因细胞中去除外源基因以外的其他序列。
实验中共注射14 个受精卵,移植到41 只受体羊中,共产下15 只小羊,其中8 只小羊为成功转基因羊,转基因率为53%。显微注射法是目前制备转基因动物应用较为广泛的一种方法,但其存在的主要问题是转基因动物成活率低,其成活率小鼠为2.6%、大鼠4.4%、兔1.5%、羊0.9%、猪0.7%、牛0.7%。本研究转基因率较高的原因可能与使用的质料特点和基因类型有关,这有待于进一步研究。
外源基因的表达水平是决定转基因效果的重要因素,通常外源基因的表达水平受到多种因素的影响而在一个较大的范围内变动。Schoneveld 等[9]研究表明TLR2 识别链球菌的脂蛋白和脂磷壁酸,TLR6和TLR2 共同识别链球菌肽聚糖,TLR2 mRNA 水平的表达呈现时间和剂量的依赖性;董静等[10]研究表明小鼠感染肺炎衣原体后肺组织TLR2 mRNA 表达迅速升高,以第4 d 和第7 d 明显,14 d 以后开始下降。Shoulong Dong 的研究表明[11],Pam3CSK4 刺激山羊单核细胞后2 h 时转基因羊的TLR2 mRNA 表达量最高,刺激后8 h 时最低,而对照羊TLR2 mRNA 表达量在各检测时间段变化不大,几乎没有表达上的时间差异性。这与Schoneveld 等、董静等的研究结果不同。这可能与动物种类、刺激物及剂量、刺激方式等不同有关,还需要进一步的研究。
4 结论
通过显微注射的方法对绵羊进行外源基因TLR2 整合,通过PCR、Southern blot、Real time PCR对其进行鉴定、拷贝数验证和表达量分析。结果表明,注射148 个受精卵,共产下15 只小羊,其中8 只小羊检测为阳性;Southern 杂交结果发现转TLR2 小羊的基因组中外源TLR2 基因均为单拷贝;定量结果转基因羊TLR2 mRNA 表达明显高于对照(P<0.05)。
[1] Kirsching C J,Schumann R R. TLR2:cellular sensor for microbial and endogenous molecular patterns[J]. Curr Top Microbiol Immunol,2002,270:121-144.
[2] Smith M F Jr,Mitchell A,Li G,et al. Toll-like receptor(TLR) 2 and TLR5,but not TLR4,are required for Helicobacter pylori-induced NF-kappa B activation and chemokine expression by epithelial cells [J]. Journal Biological Chemistry,2003,278(35):32552-32560.
[3] Wang Q,Dziarski R,Kirschning C J,et al. Micrococci and Peptidoglycan Activate TLR2 -MyD88 -IRAK -TRAF -NIK -IKK -NF -kB Signal Transduction Pathway That Induces Transcription of Interleukin-8 [J].Infection and Immunity,2001,69(4):2270-2276.
[4] Gordon J W,Scangos GA,Ploskin D J,et al. Genetic transformation of mouse embryo by mi -croinjection of purified DNA[J].Proceedings of the National Academy of Sciences of the USA,1980,77(12):7380-7384.
[5] Hanumer RE PV,Rexroad CE Jr,Wall R J,et al.Production of transgenic rabbits,sheep and pigs by croinjection[J]. Nature,1985,315:680-683.
[6] 于永忠,郭雯,吴欣媛,等.靶向ORFV-DNA polymerase基因shRNA 表达载体的构建[J].黑龙江八一农垦大学学报,2012,24(4):38-41.
[7] Karsai A,Muller S,Platz S,et al. Evaluat ion of a homemade SYBR Green I reaction mixture for Real-Time PCR quantification of gene expression [J]. Bio Techniques,2002,32(4):790-2,794-6.
[8] Mason G,Provero P,Vaira A M,et al. Estimating the number of integrations in transformed plants by quantitative real-time PCR [J]. BMC Biotechnology,2002,20(2):1472-6750.
[9] Schoneveld A H,Hoefer I,Sluijter J P G,et al.Atherosclerotic lesion development and Toll like receptor 2 and 4 responsiveness [J].Atherosclerosis,2008,197(1):95-98.
[10] 董静,施毅,宋勇,等. 小鼠肺炎衣原体肺炎TLR2 基因表达及信号传导机制的实验研究[J]. 中国呼吸与危重监护杂志,2009,8(3):267-270.
[11] Dong S L,Yu K,Zhang H T,et al.Effects of overexpression of TLR2 intransgenic goats on pathogen clearance and role of up-regulation of lysozyme secretion and infiltration of inflammatory cells[J].BMC Veterinary Research,2012(8):196.

