牛粪堆肥高温期氨氧化古菌与氨氧化细菌的多样性分析
孙志远,晏磊,王彦杰,林匡飞,李辉,王伟东
(1.黑龙江八一农垦大学农学院,大庆163319;2.黑龙江八一农垦大学生命科学技术学院;3.华东理工大学资源与环境工程学院)
堆肥是牛粪等农业有机固体废弃物最有效的无害化处理和资源化利用技术之一,堆肥化后的产品是有机肥,可用于农业生产。粪便等废弃物在发酵过程中存在着严重的氮素损失,减轻堆肥过程中氮的损失对于保护环境和提高堆肥质量至关重要[1]。硝化作用在氮循环中起着重要的作用,首先通过氨氧化细菌的氨氧化作用将氨氧化为亚硝酸盐,然后利用亚硝酸细菌的亚硝酸盐氧化作用将亚硝酸盐氧化为硝酸盐,其中氨氧化细菌介导的氨氧化是其限速步骤,主要由氨氧化细菌(AOB)的细菌来完成氨的氧化过程[2]。
随着氨氧化关键功能基因—氨单加氧酶功能基因(amoA)在泉古菌(Crenarchaeota)中的发现,研究者们发现在海洋[3-5]、土壤[6-10]、淡水沉积物[11-12]、陆地热泉[13-17],生物反应器[18-19]、河口沉积物[20-22]、地下水[23-25]、水族馆[26]、冰川[27]等环境中的氨氧化过程都有氨氧化古菌(AOA)的踪迹。氨氧化古菌的广泛发现使人们改变了对氮循环的认识,因此,研究堆肥环境中AOB和AOA 的种类特征对于理解堆肥中的氮元素循环有着积极的作用,它们可能在堆肥环境中的氮循环中发挥着作用。
近年来,国内外学者利用分子生态学方法以16S rRNA 基因或amoA 基因为标记,对堆肥过程中AOB和AOA 种群特征和系统发育状况进行分析研究[28-29]。研究采用克隆技术对一牛粪为原料的条垛式堆肥高温期的AOB 和AOA 群落结构的进行分析,通过研究AOA 和AOB 的生物多样性及系统发育,希望为堆肥中氮循环研究提供理论和数据基础。
1 材料与方法
1.1 堆肥原料
堆肥样品采自哈尔滨菁菁堆肥厂,原料为新鲜牛粪和秸秆。将牛粪与秸秆按体积比1∶1 混合,调节含水量60%~65%。每4 d 翻堆1 次。样品采自堆肥化过程中的高温期(第10 d)。各项理化参数见表1。

表1 堆肥样品理化参数Table 1 Physico-chemical features of compost sample
1.2 堆肥样品的采集,DNA 提取及纯化
于堆肥高温期从堆体上、中、下3 层5 个位置取样,充分混合均匀,现场测量样品温度及其他各项理化参数,将样品置于在-20 ℃冰箱保存。采用氯苯法[30]对样品进行DNA 的提取,用DNA 凝胶纯化试剂盒(TaKaRa)纯化DNA。
1.3 amoA基因的扩增
利用引物对amoA-1F∶5′-GGGGTTTCTACTGGT GGT-3′和amoA-2R∶
5′-CCCCTCKGSAAAGCCTTCTTC-3′进行AOB amoA 基因的扩增[31]。PCR 扩增条件:94 ℃预变性4 min;94 ℃变性45 s,60 ℃复性45 s,72 ℃延伸1 min,扩增35 个循环;最后72 ℃延伸10 min。
利用引物对Arch-amoAF∶5′-STAATGGTCTGGC TTAGACG-3′和Arch-amoAR∶
5′-GCGGCCATCCATCTGTATGT-3′进 行AOA amoA 基因的扩增[32]。PCR 扩增条件:95 ℃预变性4 min;94 ℃变性30 s,58 ℃复性20 s,72 ℃延伸1 min,扩增30 个循环。最后72 ℃延伸10 min。
PCR 产物在1.2%琼脂糖凝胶电泳中检测。
PCR 扩增产物使用DNA 纯化试剂盒Agarose Gel DNA Purification Kit Ver.2.0(TaKaRa)进行纯化。
1.4 克隆文库构建和系统进化分析
将纯化后PCR 产物,与pGEM-Teasy 载体(Promega,Madison,WI)在4 ℃条件下进行连接,连接时间为16 h,将连接好的载体转化入DH5α 大肠杆菌感受态细胞中。分别从涂有X-gal 和IPTG 的氨苄霉素的两个LB 平板上(AOA,AOB)随机挑取50 个克隆子采用特异引物M13-47 和RV-M 的PCR 扩增进行阳性古菌克隆子的筛选,最终将其中经鉴定为阳性克隆子的30 个克隆子送上海生工测序,将其序列用mouth 软件按相似度97%对AOA、AOB 序列进行划分,各分为5 个OTU,从每个OTU 中选出一条序列与NCBI GenBank 数据库中的同源序列进行比对。根据比对结果,选取相似度最高的同源序列作为参照序列,与研究代表序列结合在一起。然后,通过Bioedit 软件包中的Clustal W,将序列对齐,并将对齐后的序列文件转为MEGA4.0 软件的文件输入格式。最后,用MEGA4.0 软件做系统进化分析。
2 结果与分析
2.1 堆肥样品总DNA 提取、PCR 扩增
采用氯苯法提取的DNA 条带较为清晰。AOA 与AOB amoA 基因的PCR 扩增采用DNA 原液稀释的方法进行DNA 样品PCR 扩增,浓度稀释在10~50 倍之间可达到较理想的扩增效果。试验将DNA 原液稀释20 倍为模板,扩增堆肥样品AOB 和AOA amoA基因。结果分别得到490 bp 和610 bp 大小的条带(图1 和图2)。

图1 氨氧化细菌(AOB)PCR 产物Fig.1 Ammonia-oxidizing bacteria(AOB)PCR products
2.2 AOB 种群构成及多样性
研究氧化细菌的amoA 功能基因系统发育树中的引物均属于β-Proteobacteria,分别为亚硝化单胞菌属(Nitrosomonas)分支和亚硝化螺菌(Nitrosospira)分支,2 个分支未找到相似的已知菌种amoA 功能基因序列。从系统发育树来看,Nitrosospira Cluster 序列与主要来自于耕作土壤、湖泊底泥、热泉、生物反应器的amoA 基因序列聚集在同一分支上,其中CCS-4序列与Uncultured Nitrosomonas sp. clone AOB-R4-1(HQ230333) 的 同 源 性 为87% 。 这 与Nozomi Yamamoto[28]发现的amoA 基因序列相似,可能为一种新的氨氧化细菌。Nitrosomonas Cluster 主要与来自土壤、生物反应器的amoA 基因序列聚集在同一分支上,种群结构相对单一(图3)。

图2 氨氧化古菌(AOA)PCR 产物Fig. 2 Ammonia-oxidizing Archaea(AOA)PCR products
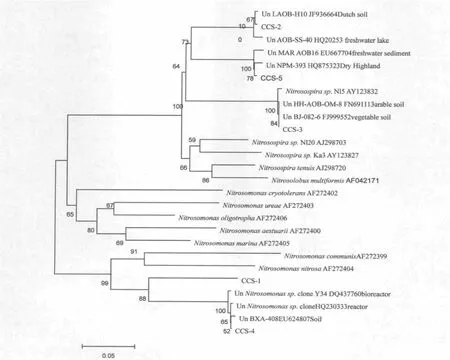
图3 基于amoA 基因构建的堆肥高温期样品的氨氧化细菌系统发育树Fig.3 Phylogenetic trees of ammonia-oxidizing bacteria(AOB)targeted on amoA gene
2.3 AOA 种群构成及多样性
从系统发育树来看(图4)研究AOA amoA 基因系统发育较为单一,克隆序列都属于未培养的Crenarchaeota(泉古菌门)。通过amoA 功能基因序列构建系统发育树发现,试验检测到的AOA 与已知AOA 并不聚类到一个分支上,其中CCS6、7、9、10 所代表的OTU 克隆序列在研究样品中AOA 基因文库中占94.2%,与来自土壤、热泉、生物反应器,湖泊沉积物的AOA amoA 基因序列聚集在同一分支上;而与海洋沉积物的AOA amoA 基因序列相似性较高的仅有CCS-8 序列所代表的一个OTU。
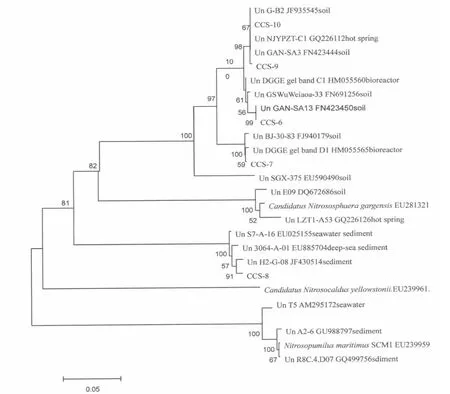
图4 基于amoA 基因构建的堆肥高温期样品的氨氧化古菌系统发育树Fig.4 Phylogenetic trees of ammonia-oxidizing archaea(AOA)targeted on amoA gene
3 讨论
AOB 是一类化能自养型的微生物,广泛分布于各种自然环境中。在伯杰氏细菌鉴定手册第九版中将其分为5 个属:亚硝化单胞菌属(Nitrosomonas)、亚硝 化 螺 菌 (Nitrosospira)、 亚 硝 化 叶 菌 属(Nitrosolobus)、亚硝化弧菌属(Nitrosovibrio)和亚硝化球菌(Nitrosococcus)。研究利用AOB amoA 功能基因检测到Nitrosospira 和Nitrosomonas,Nitrosomonas克隆子占整个克隆文库的59.3%,Nitrosospira 为40.7%。从进化树看研究的AOB 基因序列与分布在淡水沉积物、干旱土壤、蔬菜土壤、生物反应器等环境中的序列有很大的相似度,这与虞泳[33]和Shimaya[34]等以农业废弃物为原料的堆肥化过程中Nitrosospira 和Nitrosomonas 为堆肥中AOB 的优势种属的研究结果一致。Nitrosomonas 是耐受性较强的种属,存在于整个堆肥过程中。Chikako Shimaya 和Tomoyoshi Hashimoto 在50 ℃高温条件下成功富集培养了堆肥中的嗜热AOB,随着培养条件的不断成熟,人工培养的AOB 可能很快就会在实际的堆肥生产中发挥除氨固氮作用。
氨氧化古菌(AOA)在氮素循环中的重要作用是最近几年才被发现的,它们是一类以重碳酸盐为碳源、利用铵态氮氧化产生细胞能量进行化能无机自养生长的独立于AOB 进化分支外的进化类群,属于泉古菌门(Crenarchaeota)。AOA 不仅广泛存在于自然界中,并且在菌体数量上也大大超过了AOB[35],有报道在牛粪堆肥过程中古菌的数量大于AOB[28]。研究在高温好氧堆肥中同样证实了AOA 的存在,所获得的AOA amoA 基因序列都属于泉古菌门(Crenarcharota),AOA 群落结构比较单一,与土壤的同源性高的AOA 占大多数,与海水及海洋沉积物中的AOA 的amoA 基因序列相似性很低,这表明堆肥环境中AOA 与土壤中AOA 可能有着相似近缘关系。由于数量与功能之间不一定是绝对相关,因此,AOA 与AOB 在堆肥环境氮循环中的哪个更起到主要作用还需要通过活性检测,但是由于AOA 的不可培养性限制了相关研究。
当然只根据所得到的序列还不足以说明AOB、AOA 与堆肥环境因子之间的响应关系,尤其是AOA与AOB 哪种菌群在堆肥环境中对氮循环作用更大一些。研究发现温度是影响硝化细菌的关键因子[36-37],并可能是影响硝化古菌的重要环境条件,嗜热AOA 对温度的变化具有很高的耐受能力,它们能够活跃在38~97 ℃的温泉、地矿等受地热影响的环境中[38-40]。由于研究样品采自堆肥高温期,因此温度可能是造成这种现象的因素,该AOA 菌群应属于嗜热AOA 菌群。AOA 在堆肥环境中的发现拓宽了人们研究堆肥环境中氮循环的思路,为堆肥中的氮循环提供了新的研究方向。
[1] 邓伟,陈文浩,王彦杰,等. 接菌剂对牛粪堆肥化过程中主要成分含量的影响[J]. 黑龙江八一农垦大学学报,2010,22(6):15-18.
[2] Oved T,Shaviv A,Goldrath T,et al. Influence of effluent irrigation on community composition and function of ammonia -oxidizing bacteria in soil [J]. Applied and Environmental Microbiology,2001,67:3426-3433.
[3] Hongyue Dang,Li J,Chen R P,et al. Diversity,Abundance,and Spatial Distribution of Sediment Ammonia-O xidizing Betaproteobacteria in Response to Environmental Gradients and Coastal Eutrophication in Jiaozhou Bay,China [J]. Appl and Environ Microbiol,2010,76(14):4691-4702.
[4] Takuro N,Hanako O,Miwako N,et al. Archaeal Diversity and Distribution along Thermal and Geochemical Gradients in Hydrothermal Sediments at the Yonaguni Knoll IV Hydrothermal Field in the Southern Okinawa Trough[J].Appl and Environ Microbiol,2010,76(4):1198-1211.
[5] Park B J,Park S J,Yoon D N,et al. Cultivation of Autotrophic Ammonia -Oxidizing Archaea from Marine Sediments in Coculture with Sulfur-Oxidizing Bacteria[J].Appl and Environ Microbiol,2010,76(22):7575-7587.
[6] Zhang L M,Pierre R. Offre,He J Z,et al. Autotrophic ammonia oxidation by soil thaumarchaea[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(40):17240-17245.
[7] Jung M Y,Park S J,Deullae Min,et al. Enrichment and Characterization of an Autotrophic Ammonia -Oxidizing Archaeon of Mesophilic Crenarchaeal Group I.1a from an Agricultural Soil[J]. Appl and Environ Microbiol,2011,77(24):8635-8647.
[8] Bannert A,Kleineidam K,Wissing L,et al. Changes in Diversity and Functional Gene Abundances of Microbial Communities Involved in Nitrogen Fixation,Nitrification,and Denitrification in a Tidal Wetland versus Paddy Soils Cultivated for Different Time Periods [J]. Appl and Environ Microbiol,2011,77(17):6109-6116.
[9] John J. Kelly,Policht K,Grancharova T,et al. Distinct Responses in Ammonia-Oxidizing Archaea and Bacteria after Addition of Biosolids to an Agricultural Soil[J]. Appl and Environ Microbiol,2011,77(18):6551-6558.
[10] Yao H Y,Gao Y M,Nicol G W,et al. Singh.Links between Ammonia Oxidizer Community Structure,Abundance,and Nitrification Potential in Acidic Soils[J].Appl and Environ Microbiol,2011,77(13):4618-4625.
[11] Herrmann M,Saunders A M,Schramm A,et al. Effect of Lake Trophic Status and Rooted Macrophytes on Community Composition and Abundance of Ammonia-Oxidizing Prokaryotes in Freshwater Sediments[J]. Appl and Environ Microbiol,2009,75(10):3127-3136.
[12] Auguet J C,Nomokonova N,Camarero L,et al. Seasonal Changes of Freshwater Ammonia -Oxidizing Archaeal Assemblages and Nitrogen Species in Oligotrophic Alpine Lakes [J]. Appl and Environ Microbiol,2011,77(6):1937-1945.
[13] Zhang C L,Qi Y,Huang Z Y,et al. Global Occurrence of Archaeal amoA Genes in Terrestrial Hot Springs[J]. Appl and Environ Microbiol,2008,74(20):6417-6426.
[14] Jiang H C,Huang Q Y,Dong H L,et al. RNA-Based Investigation of Ammonia -Oxidizing Archaea in Hot Springs of Yunnan Province,China[J]. Appl and Environ Microbiol,2010,76(13):4538-4541.
[15] Zhang C L,Ye Q,Huang Z,et al. Global occurrence of archaeal amoA genes in terrestrial hot springs[J]. Appl and Environ Microbiol,2008,74(20):6417-6426.
[16] Hatzenpichler R,Lebedeva E V,Spieck E,et al. A moderately thermophilic ammonia -oxidizing crenarchaeote from a hot spring [J]. PNAS,2008,105(6):2134-2139.
[17] De la Torre,Walker C B,Ingalls A E,et al. Cultivation of a thermophilic ammonia oxidizing archaeon synthesizing crenarchaeol[J]. Environ Microbiol,2008,10(3):810-818.
[18] Park H D,Wells G F,Bae H,et al. Occurrence of Ammonia-Oxidizing Archaea in Wastewater Treatment Plant Bioreactors [J]. Applied and Environmental Microbiology,2006,72(8):5643-5647.
[19] Avrahami S,Jia Z J,Neufeld J D,et al. Active Autotrophic Ammonia -Oxidizing Bacteria in Biofilm Enrichments from Simulated Creek Ecosystems at Two Ammonium Concentrations Respond to Temperature Manipulation [J]. Appl. Environ. Microbiol,2011,77(20):7329-7338.
[20] Pitcher A,Hopmans E C,Mosier A C,et al. Core and Intact Polar Glycerol Dibiphytanyl Glycerol Tetraether Lipids of Ammonia-Oxidizing Archaea Enriched from Marine and Estuarine Sediments[J]. Appl and Environ Microbiol,2011,77(10):3468-3477.
[21] Anne E,Bernhard,Zachary C,et al. Abundance of Ammonia -Oxidizing Archaea and Bacteria along an Estuarine Salinity Gradient in Relation to Potential Nitrification Rates [J]. Appl and Environ Microbiol,2010,76(4):1285-1289.
[22] Wankel S D,Mosier A C,Hansel C M,et al. Spatial Variability in Nitrification Rates and Ammonia-Oxidizing Microbial Communities in the Agriculturally Impacted Elkhorn Slough Estuary,California[J]. Appl and Environ Microbiol,2011,77(1):269-280 .
[23] Paul van der Wielen,Stefan Voost,Dick van der Kooij.Ammonia -Oxidizing Bacteria and Archaea in Groundwater Treatment and Drinking Water Distribution Systems[J]. Appl and Environ Microbiol,2009,75(14):4687-4695.
[24] Rogers D R,Casciotti K L. Abundance and Diversity of Archaeal Ammonia Oxidizers in a Coastal Groundwater System[J]. Appl and Environ Microbiol,2010,76(22):7938-7948.
[25] Reed D W,Smith J M,Francis C A,et al. Responses of Ammonia-Oxidizing Bacterial and Archaeal Populations to Organic Nitrogen Amendments in Low -Nutrient Groundwater[J]. Appl and Environ Microbiol,2010,76(22):2517-2523.
[26] Urakawa H,Tajima Y,Numata Y,et al. Low Temperature Decreases the Phylogenetic Diversity of Ammonia -Oxidizing Archaea and Bacteria in Aquarium Biofiltration Systems[J]. Appl and Environ Microbiol,2008,74(3):894-900.
[27] Boyd E S,Lange R K,Mitchell A C,et al. Diversity,Abundance,and Potential Activity of Nitrifying and Nitrate-Reducing Microbial Assemblages in a Subglacial Ecosystem [J]. Appl and EnvironMicrobiol,2011,77(14):4778-4787.
[28] Yamamoto N,Otawa K,Nakai Y.Diversity and abundance of ammonia-oxidizing bacteria and ammonia-oxidizing archaea during cattle manure composting[J]. Microbial Ecology,2010,60(4):807-815.
[29] Shimaya C,Hashimoto T. Improvement of media for thermophilic ammonia-oxidizing bacteria in compost[J].Soil Science and Plant Nutrition,2008,54(4):529-533.
[30] Zhu H,Qu F,Zhu L H. Isolation of genomic DNAs from plants,fungi and bacteria using benzyl chloride[J].Nucleic Acids Research,1993,21:5279-5280.
[31] Nicolaisen M H,Ramsing N B. Denaturing gradient gel electrophoresis(DGGE)approaches to study the diversity of ammonia -oxidizing bacteria [J]. Journal of Microbiological Methods,2002,50(2):189-203.
[32] Francis C A,Roberts K J,Beman J Met al. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean [J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(41):14683-14688.
[33] 虞泳,曾光明,陈耀宁,等. 农业废物好氧堆肥中氨氧化细菌的群落结构[J]. 环境科学,2011,32(10):3067-3072.
[34] Shimaya C,Hashimoto T. Improvement of media for thermophilic ammonia-oxidizing bacteria in compost[J].Soil Science and Plant Nutrition,2008,54(4):529-533.
[35] Herrmann M,Saunders A M,Schramm A. Archaea dominate the ammonia -oxidizing community in the rhizosphere of the freshwater macrophyte Littorella uniflora [J]. Applied and Environmental Microbiology,2008,74(10):3279-3283.
[36] Koops H P,Purkhold U,Pommerening-Roser A,et al.The Lithoautotrophic Ammonia-Oxidizing Bacteria[M].Germany:Springer,2006,778-811.
[37] Avrahami S,Bohannan B J M. Response of Nitrosospira sp. Strain AF-Like ammonia oxidizers to changes in temperature,soil moisture content,and fertilizer concentration[J]. Appl and Environ Microbiol,2007,73(4):1166-1173.
[38] Reigstad L J,Richter A,Daims H,et al. Nitrification interrestrial hot springs of Iceland and Kamchatka[J].FEMS Microbiology Ecology,2008,64(2):167-174.
[39] Weidler G W,Gerb F W,Stan-Lotter H. Crenarchaeota and their role in the nitrogen cycle in a subsurface radioactive thermal spring in the Austrian central Alps[J]. Appl and Environ Microbiol,2008,74(19):5934-5942.
[40] Spear J R,Barton H A,Robertson C E. Microbial community biofabrics in a geothermal mine adit[J]. Appl and Environ Microbiol,2007,73(19):6172-6180.

