OxyR蛋白对不同应激条件下伤寒沙门菌生存能力的影响
詹莉芳,张晓磊,翁晓琴,张海方,徐顺高,黄新祥
(江苏大学基础医学与医学技术学院,江苏镇江212013)
伤寒沙门菌(Salmonella enterica serovar Typhi,S.Typhi)是一种重要的人类肠道致病菌,能引起全身性感染。S.Typhi从外界进入人体时,需要适应宿主体内酸、碱、渗透压、氧和营养等环境的变化[1]。多种代谢途径及环境中活性氧的累积,可对细菌的生理代谢、蛋白质、膜脂质及核酸等物质造成一系列的损伤[2]。oxyR(过氧化氢诱导的调节活化因子)基因最初在鼠S.Typhi和大肠埃希菌(E.coli)中被报道,其表达蛋白OxyR可以监测活性氧的产生,并且通过上调40多种基因的表达来调节细菌的生理代谢[3],但在S.Typhi中关于 OxyR 的研究还未见报道。本研究拟构建S.Typhi oxyR基因缺陷株以及oxyR基因缺陷回补株,通过对其在不同应激下生长曲线的分析,以及荧光实时定量PCR(qRT-PCR)检测氧化应激相关的亚铁螯合酶(hemH)基因和甘露糖酸脱水酶(uxuA)基因的表达量,研究OxyR蛋白对细菌生存能力的调节。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 野生型 S.Typhi GIFU 10007由日本岐阜大学医学院微生物学教研室馈赠;E.coli DH5α、质粒 pET28a(Kanr)、质粒 pBAD/gⅢ由本室保存;质粒pKD46由北京军事医学科学院微生物流行病研究所馈赠。
1.1.2 主要试剂与材料 Ex Taq和r Taq DNA聚合酶、XhoⅠ和 EcoRⅠ限制性内切酶、dNTP、DL 2 000 DNA标准参照物、T4DNA连接酶、qRT-PCR试剂盒均为TaKaRa公司(大连)产品;Pfu DNA聚合酶、RNA酶为Fermentas公司产品,L-阿拉伯糖、氨苄西林、卡那霉素为Sigma公司产品;质粒提取试剂盒为Axygen公司产品;反转录试剂盒为Invitrogen公司产品。
1.1.3 主要仪器 恒温摇床(Thermo scientific);PCR扩增仪2720 Thermal Cycler(ABI);凝胶成像分析系统(Syngene);核酸检测仪Speetrophotometer ND-100(NanoDrop);电转化仪Gene Pulsero II(Bio-Rad);超速冷冻离心机5417R(Eppendorf);金属浴(Grant-bio);分光光度计Bio Photometer(Eppendorf);实时定量PCR仪CFX96TM(Bio-Rad)。
1.2 方法
1.2.1 引物设计 根据本室测定的 S.Typhi野生株GIFU 10007基因组序列信息(未公布)和pET28a(Kanr)序列信息,利用Oligo 6.0软件设计oxyR缺陷株、oxyR缺陷株验证、oxyR缺陷回补株及qRTPCR引物。
(1)oxyR缺陷株引物设计(图1):依据GIFU 10007基因序列显示,oxyR编码基因全长918 bp,分别设计2对引物L1-Kl/R1-Kr,L2/R2产生89 bp上下游同源臂,用于敲除oxyR基因全部的开放阅读框。
(2)oxyR缺陷株验证引物V-L/V-R设计(图1):V-L来自基因序列中上游同源臂外侧一段16 bp的序列,V-R来自卡那霉素抗性基因中一段16 bp的序列。
(3)oxyR缺陷回补株引物设计:在oxyR基因上下游设计引物L3/R3,并在5'端分别加上XhoⅠ及EcoRⅠ酶切位点用以连接pBAD/gⅢ载体。
(4)qRT-PCR引物设计:根据GIFU 10007基因组中的uxuA、hemH基因序列,各自设计一对扩增片段长度为150 bp左右的特异性引物,通过qRT-PCR来检测这两个基因的表达情况。所有引物均由上海生工生物技术服务有限公司合成,见表1。
1.2.2 Red重组功能的诱导和感受态细胞的制备将编码Red重组系统的质粒pKD46电击转化至S.Typhi野生株中,筛选阳性克隆,作为下一步转化的宿主菌,命名为007-pKD46。挑取007-pKD46单菌落接种于1 mL等渗LB培养液中,37℃ 250 r/min振荡培养过夜,然后以1∶100的比例转种至20 mL等渗LB培养液中,37℃ 250 r/min振荡培养至D(600 nm)为0.6,并在培养终止前1 h加入L-阿拉伯糖(终浓度为1 mmol/L)诱导Red系统重组蛋白的表达。离心,收集菌体,用冰浴无菌水漂洗3次,再用10%的无菌甘油漂洗1次,最后将菌体重悬,取50 μL用于电击转化。
1.2.3 S.Typhi oxyR 缺陷株的制备 S.Typhi oxyR基因缺陷变异株根据文献[4]制备,主要步骤见图2。以环状质粒pET28a(Kanr)为模板,用特异性引物L1-Kl/R1-Kr扩增出带有oxyR基因上下游同源臂的卡那霉素抗性基因片段F1。然后以第1轮PCR产物为模板,用L2/R2引物扩增出延长了同源臂的片段F2。取2 μg经酚-氯仿纯化后的F2电击转化入007-pKD46中,37℃倒置过夜培养后,检测转化子的生长状况,然后用菌落进行PCR(引物VL/V-R),筛选到的阳性转化子即为oxyR基因缺陷株,命名为ΔoxyR。

表1 引物序列Tab 1 Sequences of primers

图2 Red重组系统基因敲除原理示意图Fig 2 The schematic diagram of Red recombination system for gene knocking out
1.2.4 S.Typhi oxyR基因缺陷回补株的制备 根据文献[5]制备,在S.Typhi野生株oxyR基因上下游设计引物L3/R3,并在5'端分别加上 XhoⅠ及EcoRⅠ酶切位点,以S.Typhi野生株GIFU 10007的基因组DNA为模板,用高保真的Pfu DNA聚合酶扩增出目的片段,酚-氯仿纯化后由XhoⅠ及EcoRⅠ进行双酶切反应,通过T4DNA连接酶将其与经同样酶切的pBAD/gⅢ质粒16℃连接2 h。用热击法将酶接产物转化至E.coli DH5α,筛选阳性克隆并用酶切和PCR进行初步鉴定,再用DNA测序分析验证(测序由上海生工生物技术服务有限公司完成)。阳性克隆质粒和空质粒pBAD/gⅢ分别电击导入ΔoxyR变异株中,命名为ΔoxyR+pBAD-oxyR,ΔoxyR+pBAD。
1.2.5 生长曲线 分别挑取 S.Typhi野生株、oxyR缺陷株、oxyR缺陷回补株和空质粒株单菌落于1 mL等渗LB培养液中,37℃ 250 r/min振荡培养过夜;过夜细菌以1∶100分别转种于新配制的、预热的等渗液(NaCl 150 mmol/L)、高渗液(NaCl 300 mmol/L)、酸(pH=4.2)及氧(4 mmol/L H2O2)的LB培养液中,37℃ 250 r/min振荡培养,每隔1 h用分光光度计检测D(600 nm)值并记录,直至24 h。每组实验重复3次,以D(600 nm)值为纵坐标,培养时间为横坐标制作生长曲线,分别比较4种菌株在不同环境下的生长状况。
1.2.6 总 RNA提取、反转录与 qRT-PCR 分别提取S.Typhi野生株、oxyR缺陷株、oxyR缺陷回补株和空质粒株在对数期氧应激下的总RNA。细菌培养至对数期后给予氧应激(4 mmol/L H2O2)30 min后,用Trizol法提取 RNA并消化残余DNA。总RNA提取后用随机引物N8反转录成cDNA。反转录体系:4 μg 总 RNA,4 μL N8,1 μL dNTP 和6.7 μL DEPC 处理水,混合后 65 ℃ 1min,冰上迅速冷却后加入 4 μL 5 × 反转录缓冲液,0.1 μL RNA 酶抑制剂,0.2 μL 反转录酶,总体积 20 μL;反转录反应条件:25℃10 min,50℃ 50 min,70℃15 min。之后按TaKaRa公司的qRT-PCR试剂盒操作说明进行实验。qRT-PCR实验重复3次,每次均设平行对照。
1.3 统计学分析
数据分析采用SPSS 16.0统计软件。多组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 S.Typhi oxyR基因缺陷变异株的制备
以pET28a(Kanr)环状质粒DNA为模板,L1-Kl为5'端引物,R1-Kr为3'端引物,进行PCR扩增,得到产物F1。以F1片段为模板,L2/R2为特异性引物进行PCR扩增,获得产物F2。在含卡那霉素(终浓度为50 mg/L)的普通LB平板上培养后,筛选阳性克隆,以V-L和V-R为引物进行PCR,均得到相同的DNA片段,与预期结果一致,证实ΔoxyR基因缺陷株制备成功。见图3。
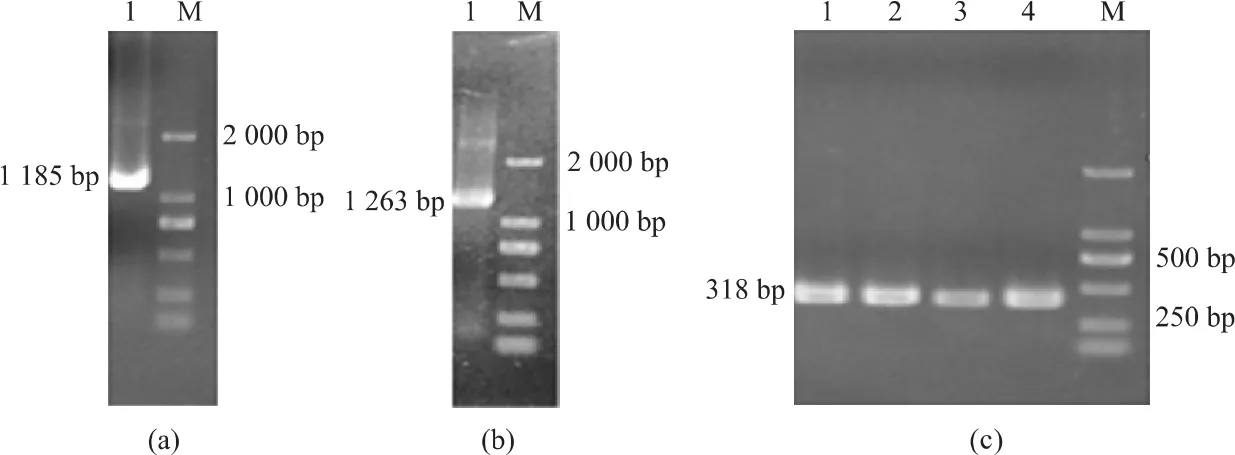
图3 S.Typhi oxyR基因缺陷变异株的制备Fig 3 Preparation of the oxyR deleted mutant of S.Typhi
2.2 S.Typhi oxyR基因缺陷回补株的制备
以野生株基因组DNA为模板,用引物L3/R3进行PCR扩增,获得oxyR基因回补片段。将扩增目的片段经双酶切后与同样双酶切后的表达载体pBAD/gⅢ进行连接,热击导入E.coli DH5α中,获得阳性初筛菌,将疑似阳性克隆进行酶切和PCR鉴定。经DNA测序分析显示,插入的回补片段与目的基因完全一致,说明含oxyR基因的载体成功转入缺陷株中,S.Typhi oxyR基因缺陷回补株制备成功。见图4。
2.3 不同菌株在不同应激条件下的生长能力
S.Typhi野生株、oxyR缺陷株、oxyR缺陷回补株和空质粒株在等渗、酸、氧及高渗环境中的生长状况,如图5所示。生长曲线分析结果显示,在等渗、酸、高渗环境中,oxyR缺陷株的生存能力与野生株比较,差异无统计学意义(P>0.05);而在氧应激条件下,oxyR缺陷株的生存能力明显低于野生株(P<0.05)。在各种条件下,回补株的生存能力恢复达到野生株水平,而回补空质粒菌株的生存能力与缺陷株比较,差异无统计学意义,说明pBADg/Ⅲ载体对菌株的生存能力无明显影响。
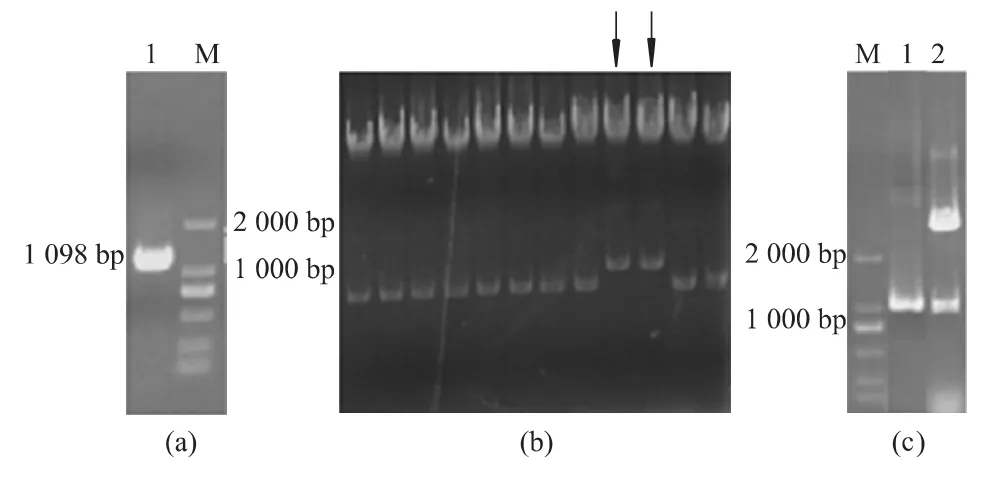
图4 伤寒沙门菌oxyR基因缺陷回补株的制备Fig 4 Rescue of oxyR in the oxyR deleted mutant of S.Typhi

图5 不同菌株在不同应激条件下的生长曲线Fig 5 Growth curve analysis of different strains in different stressive conditions
2.4 qRT-PCR分析氧化调节相关基因的表达
为进一步探讨OxyR对S.Typhi氧化调节相关基因表达的影响,我们分别提取了S.Typhi野生株、oxyR缺陷株、oxyR缺陷回补株和空质粒株在对数期给予氧应激后的总RNA,并用qRT-PCR分析4种菌株中uxuA、hemH基因的mRNA水平。如图6所示,氧应激时,与野生株相比,oxyR缺陷株中uxuA基因mRNA的水平显著升高(P<0.01)、hemH基因mRNA的水平显著降低(P<0.01);与此同时,缺陷回补株uxuA基因和hemH基因的表达水平与空质粒株相比,差异也有统计学意义(P<0.01)。

图6 氧应激时不同菌株中氧化调节相关基因的表达Fig 6 Expression of oxidative stress-related genes in different strains
3 讨论
近年来关于OxyR参与基因表达调控的报道越来越多,在许多革兰阳性和阴性菌中均可检测到OxyR。其在细菌的多种代谢活动中都起着重要的作用,包括氧化应激损伤、细菌毒力、生物膜形成、定植以及菌毛合成等[6-9]。
OxyR是转录因子亮氨酸家族中的一种蛋白[10],在氨基末端有螺旋-转角-螺旋的结构域,羧基末端有参与调解寡聚反应的基序。当细菌处于氧应激环境中,OxyR被氧化,蛋白分子内的2个半胱氨酸残基(Cys199和Cys208)形成二硫键,进而结合到特定靶基因的调控区域发挥作用[11]。OxyR作为一种抗氧化调节蛋白,在E.coli中,既可以作为过氧化物探测器,又可以激活相关基因的表达,包括dps(一种在营养缺乏条件下产生的DNA结合蛋白)、garA(GSH还原酶)、grxA(谷氧还原蛋白)、katG(过氧化氢酶)、aphCF(NADPH氧化还原酶类)以及fur(Fe3+转运调节蛋白)等基因[12]。此外,E.coli的OxyR激活还可以促进OxyS的产生,进而调节20多种基因的表达[13]。然而,OxyR并非总是作为激活剂调节基因的表达[14]。在奈瑟菌属中,当不存在氧化应激时,OxyR则抑制过氧化氢酶的表达;当存在氧化应激时,如受到过氧化物的刺激,则作为激活剂促进过氧化氢酶的表达。白喉棒状杆菌的OxyR与E.coli相比,具有52%的同源性,也含有监测过氧化物的2个半胱氨酸,但是作为cat(过氧化物酶)基因表达的抑制剂,其作用的发挥不依赖过氧化物诱导的氧化应激[15]。
在本研究中,我们利用λ噬菌体的Red重组系统成功构建了S.Typhi oxyR基因缺陷株,为研究OxyR蛋白在S.Typhi中的作用奠定了基础。我们通过胞外应激条件研究了S.Typhi OxyR对细菌生存能力的影响,结果显示,当细菌处于氧应激时,oxyR缺陷株的存活能力明显下降。qRT-PCR结果表明,OxyR蛋白激活hemH基因的表达而抑制uxuA基因的表达。HemH参与血红素的生物合成,并且是过氧化氢酶(katG和katE)合成的辅助因子[12];UxuA是细菌磷酸烯醇丙酮酸糖磷酸转移酶系统途径的重要组分。以上结果提示,S.Typhi在氧应激时,OxyR可能作为一种调控因子,直接或间接地激活或抑制一些基因的表达,来对抗所受到的应激。关于S.Typhi OxyR发挥作用的具体机制以及是否有更多的基因受到调节,还有待进一步研究。
[1] Foster JW,Spector MP.How Salmonella survive against the odds[J].Annu Rev Microbiol,1995,49:145-174.
[2] Storz G,Tartaglia LA,Farr SB,et al.Bacterial defenses against oxidative stress[J].Trends Genet,1990,6(11):363-368.
[3] Whitby PW,Morton DJ,Vanwagoner TM,et al.Haemophilus influenzae OxyR:Characterization of its regulation,regulon and role in fitness[J].PLoS One,2012,7(11):e50588.
[4] 王恒樑,冯尔玲,史兆兴,等.用 Red系统快速敲除痢疾杆菌 asd基因[J].军事医学科学院院刊,2002,26(3):161-164.
[5] 王菲,孟彦辰,黄新祥,等.伤寒沙门菌核糖核酸酶G对胞内非编码RNA T3956水平的影响[J].江苏大学学报:医学版,2012,22(3):114-118.
[6] Antelmann H,Helmann JD.Thiol-based redox swit
ches and gene regulation[J].Antioxid Redox Signal,2011,14(6):1049-1063.
[7] Hoopman TC,Liu W,Joslin SN,et al.Identification of gene products involved in the oxidative stress response of Moraxella catarrhalis[J].Infect Immun,2011,79(2):745-755.
[8] Hishinuma S,Yuki M,Fujimura M,et al.OxyR regulated the expression of two major catalases,KatA and KatB,along with peroxiredoxin,AhpC in Pseudomonas putida[J].Environ microbiol,2006,8(12):2115-2124.
[9] Tseng HJ,Mcewan AG,Apicella MA,et al.OxyR acts as a repressor of catalase expression in Neisseria gonorrhoeae[J].Infect Immun,2003,71(1):550-556.
[10] Schell MA.Molecular biology of the LysR family of transcriptional regulators[J].Annu Rev Microbiol,1993,47:597-626.
[11] Zheng M,Aslund F,Storz G.Activation of the OxyR transcription factor by reversible disulfide bond formation[J].Science,1998,279(5357):1718-1721.
[12] Zheng M,Wang X,Templeton LJ,et al.DNA microarray-mediated transcriptional profiling of the Escherichia coli response to hydrogen peroxide[J].J Bacteriol,2001,183(15):4562-4570.
[13] González-Flecha B,Demple B.Role for the oxyS gene in regulation of intracellular hydrogen peroxide in Escherichia coli[J].J Bacteriol,1999,181(12):3833-3836.
[14] Seib KL,Wu HJ,Srikhanta YN,et al.Characterization of the OxyR regulon of Neisseria gonorrhoeae[J].Mol Microbiol,2007,63(1):54-68.
[15] Kim JS,Holmes RK.Characterization of OxyR as a negative transcriptional regulator that represses catalase production in Corynebacterium diphtheriae[J].PLoS One,2012,7(3):e31709.

