非小细胞肺癌患者外周血上皮细胞黏附分子和黏蛋白的诊断价值
朱文芳,李坚,唐兴萍
(江苏大学附属医院1.肾内科,2.呼吸内科,江苏 镇江212001)
转移是恶性肿瘤的标志和特征,也是其治疗失败的主要原因。癌细胞主要通过循环系统和淋巴管播散[1]。其可从原发部位进入血液,在血循环中存活并播散,之后循环肿瘤细胞(CTC)可定位到其他器官部位,在多种细胞因子作用下,与靶器官的组织发生细胞间的相互作用,进而生长形成转移灶。已有研究报道,在恶性肿瘤患者的外周血中可检测出CTC,其与患者的预后密切相关。为了探讨作为CTC 分子标志物的上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)mRNA 和黏蛋白1(MUC1)mRNA 检测对非小细胞肺癌(non-small cell lung cancer,NSCLC)诊断与病情评估的临床价值,我们前瞻性研究了实时荧光定量-PCR(qRTPCR)技术检测NSCLC 患者外周血EpCAM mRNA和MUC1 mRNA 表达与临床病理学的相关性。
1 对象与方法
1.1 研究对象
选自2011年11月至2012年11月在江苏大学附属医院住院的NSCLC 患者45例,均为未接受过任何抗肿瘤治疗的初发就诊病例,并除外其他肿瘤肺部转移。患者均经病理组织学(纤维支气管镜活检、手术切除、经皮肺穿刺针吸活检、淋巴结穿刺活检)检查确诊为NSCLC。45例患者中鳞癌27例,腺癌18例;其中,男28例,女17例,年龄42 ~88岁,平均63 岁。依据国际抗癌联盟(UICC)2002年制定的TNM 分期标准,Ⅰ+Ⅱ期18例,Ⅲ+Ⅳ期27例。
另选择同期住院21例肺部良性疾病患者作为对照组,分别为肺炎9例,慢性阻塞性肺疾病6例,支气管哮喘2例,间质性肺病2例,硅肺病1例,结核性胸膜炎1例。为评测实验结果的稳定性,同时选取健康志愿者14例血标本作为对照(样本mRNA 校对值)。
1.2 方法
1.2. 1 主要试剂和仪器 Trizol 试剂购自美国Invitrogen公司,反转录试剂盒购自美国Fermentas 公司,荧光定量试剂盒购自日本Toyobo 公司,荧光定量PCR 仪CFX96 购自美国Bio-Rad 公司。
1.2.2 样本采集 所有入选患者均空腹抽取外周静脉血4 mL,置于EDTA 抗凝管,用淋巴细胞分离液分离有核细胞。按Trizol 试剂盒操作说明溶解细胞,提取总RNA,于紫外分光光度计定量后,严格按反转录试剂盒说明进行反转录反应。
1.2.3 引物设计 参考EpCAM基因和MUC1 基因序列设计引物,另设计管家基因β-肌动蛋白作为内参照,所有引物均由上海生工生物工程有限公司合成。见表1。

表1 引物序列Tab 1 Oligonucleotide sequences of primers
1.2.4 qRT-PCR 每份血标本均扩增β-肌动蛋白、EpCAM 以及MUC1。按每个反应终体积20 μL,其中反转录混合物2 μL,DEPC 处理水7 μL,上下游引物各0.5 μL,PCR 混合液10 μL。梯度实验提示2种基因的退火温度接近,故PCR 条件均为95 ℃预变性30 s,按下述步骤循环,95 ℃5 s;59 ℃30 s;72 ℃30 s延伸,共40 个循环。
1.2.5 结果分析 根据上述方法检测EpCAM mRNA 和MUC1 mRNA 的表达,所得的CT 值采用2-ΔΔCT方法计算出靶基因mRNA 相对表达量,构建ROC 曲线,找出确定EpCAM mRNA 和MUC1 mRNA敏感性和特异性的折点(上限值),分别为3.02 和1.52,高于该上限值为阳性。
1.3 统计学分析
采用SPSS 16.0 统计软件进行数据处理。鉴于测得的EpCAM mRNA 和MUC1 mRNA 表达量为非正态分布,两组间的比较采用Mann-WhitneyU检验。EpCAMmRNA 和MUC1mRNA 表达水平之间的相关性采用Spearman 相关系数分析。两组间的阳性率比较采用χ2检验或Fisher精确检验,P<0.05为差异有统计学意义。
2 结果
2.1 外周血中EpCAM mRNA 和MUC1 mRNA 的表达
NSCLC 患者外周血中EpCAM mRNA 和MUC1 mRNA 的表达水平均明显高于肺部良性疾病患者(P=0.025和P=0.018)。NSCLC 患者和肺部良性疾病患者的EpCAM mRNA 与MUC1 mRNA 的表达水平之间均无明显相关性(NSCLC 患者,r=0.135,P>0.05;肺部良性疾病者,r=0.118,P>0.05)。以3.02 和1.52分别作为EpCAM mRNA 和MUC1 mRNA 表达水平的上限时,NSCLC 患者外周血中EpCAM mRNA 和MUC1 mRNA 的阳性表达率分别为48.9%和53.3%;肺部良性疾病患者阳性表达率分别为4.7%和0.0%。两组间比较差异有统计学意义(P均=0.001)。见表2。
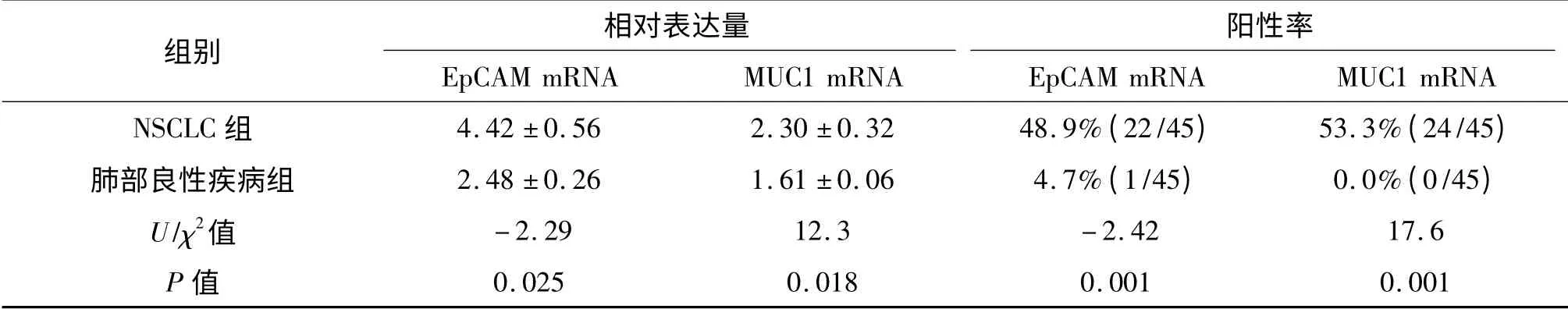
表2 两组患者外周血中上皮细胞黏附分子和黏蛋白1 表达的比较Tab 2 Comparison of mRNA expressions of epithelial cell adhesion molecule (EpCAM)and mucin1 in peripheral blood between two groups
2.2 外周血中EpCAM mRNA 和MUC1 mRNA 检测的敏感性和特异性
分别取3.02 和1.52 为EpCAM mRNA 和MUC1 mRNA 表达量的上限,检测其诊断NSCLC 的敏感性、特异性、阳性预测值和阴性预测值。结果表明,两者对NSCLC 外周血微转移均有一定的诊断价值。见表3。

表3 外周血中上皮细胞黏附分子和黏蛋白1 对NSCLC 的诊断价值 %(n/n)Tab 3 Diagnostic value of mRNA expressions of epithelial cell adhesion molecule(EpCAM)and mucin1 in peripheral blood from patients with non-small cell lung cancer
2.3 外周血中EpCAM mRNA 和MUC1 mRNA 表达阳性率与临床病理特征之间的相关性
结果显示(表4),NSCLC 患者外周血中EpCAM mRNA 和MUC1 mRNA 的表达阳性率与其年龄、性别、肿瘤病理类型无明显相关性;与临床TNM 分期显著相关,Ⅲ+Ⅳ期患者外周血中EpCAM 和MUC1 mRNA 表达阳性率明显高于Ⅰ+Ⅱ期患者(EpCAM mRNA,P=0.021;MUC1 mRNA,P=0.005)。

表4 NSCLC 患者外周血中上皮细胞黏附分子和黏蛋白1 表达与临床特征的相关性Tab 4 Correlations between epithelial cell adhesion molecule (EpCAM)and mucin1 and clinical characteristics in peripheral blood from patients with non-small cell lung cancer
3 讨论
NSCLC 患者的高病死率与癌细胞发生隐匿性微转移有关。在病程的早期,癌细胞就可播散到原发灶的远处部位,而传统的诊断学方法并不能检测到这种转移的隐匿性单个癌细胞或癌细胞集落。癌细胞只有以存活状态经血液循环黏附于小血管或毛细血管,才有可能发生血行转移。由于RNA 极易被降解,故在NSCLC 患者外周血中检测到肿瘤特异性基因的表达,就提示循环系统中有存活状态的肿瘤细胞,也就预示着肿瘤具有较高的转移倾向。目前尚未发现某个肿瘤特异性基因能在所有NSCLC 中表达。为此,国内外学者应用反转录PCR 及相关技术,寻找NSCLC 特异性基因的表达并探讨其临床意义,发现某些基因的高表达与NSCLC 患者的预后存在密切关系[2-3]。
EpCAM 又称为肿瘤相关钙信号转导蛋白1(TACSTD1),是由TACSTD1 基因编码的Ⅰ型跨膜蛋白。EpCAM 几乎表达于所有上皮组织,在上皮来源的肿瘤细胞中呈高表达,但在肝细胞、结缔组织、造血系统来源的细胞、脑组织和血管内皮细胞中不表达或低表达[4]。它通过参与细胞的黏附、迁移、增殖、分化等从而促成肿瘤的发生及转移。Yanamoto等[5]研究显示,EpCAM 高表达的肿瘤细胞增殖活性高,侵袭性强,下调其表达可显著抑制肿瘤细胞的增殖活性及侵袭性。Gastl 等[6]在研究乳腺癌组织中EpCAM 表达与患者生存率之间的关系时发现,36%乳腺癌肿瘤组织中EpCAM 呈高表达,且该高表达与患者肿瘤分期和组织学类型相关,而与激素受体状态、年龄、肿瘤大小和淋巴结阳性无明显相关性。Karanikiotis 等[7]应用RT-PCR 技术检测EpCAM 在结直肠癌患者的外周血和骨髓中的表达,结果显示,26 份外周血(96%)和19 份骨髓样本(73%)中有EpCAM 表达,表明EpCAM 在结直肠癌患者的外周血中呈高表达。虽然在众多恶性肿瘤中发现Ep-CAM 呈高表达,但尚未能确定其表达程度与患者临床转归之间的关系。
黏蛋白(MUC)是广泛分布于正常机体各种黏膜表面的高分子量蛋白,其中MUC1 是一种Ⅰ型跨膜蛋白,它可降低肿瘤细胞间的黏附力,从而增强肿瘤细胞与血管内皮细胞的黏附,使其易于穿过血管壁,进而促进肿瘤细胞的转移[8]。MUC1 对肿瘤细胞的黏附作用具有双向调节功能。MUC1 在正常肺、支气管组织和NSCLC 患者的癌组织中均有表达,但在正常人体外周血中无表达或低表达。因此,如果在NSCLC 患者外周血中检测到MUC1 mRNA呈较高表达,则提示有循环肿瘤细胞存在。蔡祖勋等[9]研究显示,NSCLC 组织中MUCI mRNA 的阳性表达率与患者的预后呈负相关。根据MUC1 的生物学功能及其与肿瘤的关系,郑顺利等[10]指出,检测外周血中MUCI mRNA 的表达水平是一项衡量肺癌患者有无癌转移的有价值的指标,可为临床医师制订治疗方案和评估患者预后提供重要的参考依据。
本研究采用qRT-PCR 技术检测外周血中mRNA 的表达,结果显示,NSCLC 患者EpCAM mRNA和MUC1 mRNA 表达水平及其阳性表达率均明显高于肺部良性疾病患者。检测外周血中EpCAM mRNA 和MUC1 mRNA 诊断NSCLC,特异性(95.3%和100.0%)和阳性预测值(95.6%和100.0%)均较敏感性(48.9%和53.3%)高。NSCLC 患者外周血中EpCAM mRNA 或MUC1 mRNA 呈高表达,提示有存活的癌细胞存在,具有较高的转移倾向。因此,检测两者mRNA 表达对NSCLC 患者外周血微转移的诊断有一定的临床价值。本研究在对NSCLC 患者临床病理学特征与外周血EpCAM mRNA 和MUC1 mRNA 阳性表达率的相关性进行分析时发现,两者阳性表达率与患者年龄、性别、病理类型无关;与肿瘤TNM 分期显著相关,随肿瘤TNM 分期增高,mRNA 阳性表达率明显增加,提示NSCLC 患者分期越晚,肺癌细胞脱落至血循环的可能性越大。
本研究中,部分患者TNM 分期尚处于早期(Ⅰ-Ⅱ期),其外周血中EpCAM mRNA 或MUC1 mRNA 呈阳性表达,提示这部分经手术根治性切除的患者可能已有血源性微转移存在。事实上,临床上确实有一些经手术根治性切除的Ⅰ-Ⅱ期NSCLC患者在术后5年内出现转移复发,说明通过常规影像学检查确定的部分早期(Ⅰ-Ⅱ期)NSCLC 患者已经不是真正意义上的早期。因此,根据血液中Ep-CAM mRNA 或MUC1 mRNA 等肿瘤特异性基因表达的检测结果再重新分期,进而调整或改变治疗策略,对于临床已行TNM 分期的NSCLC 患者而言,具有重要的临床意义。例如,对于早期发现的有微转移和远处转移倾向的高危患者,在肿瘤负荷较低的前提下,增加新辅助化疗或及时给予辅助化疗,有可能降低远处转移的风险[11]。
肿瘤微转移检测的临床价值需要大样本量的前瞻性随机对照和长期随访研究来论证。由于时间关系,本研究未能评价NSCLC 患者外周血中EpCAM mRNA 和MUC1 mRNA 表达与其预后的相关性(NSCLC 患者仍在随访中)。
另外,本研究中1例肺部良性疾病患者EpCAM mRNA 呈阳性表达(阳性率4. 7%),其原因可能:①血细胞中EpCAM 假基因的扩增;②RNA 提取过程中的DNA 污染;③局部炎症侵袭小血管,使其通透性升高或破裂,上皮细胞逸入循环等。
综上所述,我们的研究结果结合文献报道表明,检测外周血中EpCAM mRNA 和MUC1 mRNA 的表达,对于诊断NSCLC,尤其诊断肿瘤微转移可能具有重要的临床价值。
[1]Glinsky VV,Glinsky GV,Glinskii OV,et al. Intravascular metastatic cancer cell homotypic aggregation at the sites of primary attachment to the endothelium[J].Cancer Res,2003,63(13):3805-3811.
[2]Matsunaga H,Hangai N,Aso Y,et al. Application ofdifferentialdisplay to identify genes for lung cancerdetection in peripheral blood[J]. Int J Caner,2008,100(5):592-599.
[3]Osaki T,Oyama T,Gu CD,et al. Prognostic impact of micrometastatic tumor cells in the lymph nodes and bone marrow of patients with completely resected stage Ⅰnon-small-cell lung cancer[J]. J Clin Oncol,2010,20(13):2930-2936.
[4]KhanMS,Tsigani T,Rashid M,et al. Circulating tumor cells and EpCAM expression in neuroendocrine tumors[J]. Clin Cancer Res,2011,17(2):337-345.
[5]Yanamoto S,Kawasaki G,Yoshitomi I,et al. Clinic pathologic significance of EpCAM expression in squamous cell carcinoma of the tongue and its possibility as a potential target for tongue cancer gene therapy[J]. Oral Oncol,2007,43(9):869-877.
[6]Gastl G,Spizzo G,Obrist P,et al. Ep-CAM over expression in breast cancer as a predictor of survival[J].Lancet,2010,356(9246):1981-1982.
[7]Karanikiotis C,Skiadsa I,Karina M,et al. A novel chromatographic method for Ep-CAM mRNAdetection in peripheral blood and bone marrow of patients with metastatic colorectal cancer[J]. Anticancer Res,2005,25(1A):319-323.
[8]Thirkill L,Gao T,Stout M,et al. MUC1 is involved in trophoblast transendothelial migration[J].Biochim Biophys Acta,2007,1773(6):1007-1014.
[9]蔡祖勋,梁庆正,张学完,等. 非小细胞肺癌组织中p53 和MUC1 的表达及其意义[J]. 肿瘤防治杂志,2004,11(7):694-696.
[10]郑顺利,杨庆生,马小红. 非小细胞肺癌患者纵隔淋巴结和外周血中MUC1 基因的检测及意义[J].第三军医大学学报,2006,28(24):2472-2474.
[11]Ono T,Minamiya Y,Ito M,et al. Sentinel node mapping and micrometastasis in patients with clinical stage IA non-small cell lung cancer[J]. Interact Cardiovasc Thorac Surg,2009,9(4):659-661.

