Aβ诱导大鼠行为学障碍中内质网Aβ结合蛋白的表达及二苯乙烯苷的影响
罗红波, 石向群, 李 芸, 郭建魁, 张志强, 尹 榕
阿尔茨海默病(Alzheimer’s disease,AD)是一种神经系统变性疾病,其主要的病理学特征之一是脑组织中出现大量老年斑[1]。β-淀粉样蛋白(Amyloidβ-peptide,Aβ)是老年斑的主要成分,Aβ的神经毒性是AD形成和发展的关键因素,其诱发的神经元变性和凋亡与AD患者认知功能、行为学障碍密切相关;Aβ的神经毒性可造成内质网功能障碍,未折叠蛋白或者错误折叠的蛋白堆积于内质网,使蛋白质无法与输送机制耦联,从而引发疾病[2]。
AD患者的学习记忆及工作能力的逐渐丧失给家庭及社会带来沉重的负担,但目前其治疗尚无十分有效方法与药物。研究显示何首乌的主要有效成分之一(2,3,5,4-四羟基二苯乙烯-2-0-β-D 葡萄糖苷;2,3,5,4-tetrahydroxy-stilbene-2-glycoside,二苯乙烯苷,TSG)能减少β-淀粉样肽诱导的老年斑沉积,改善痴呆模型大鼠学习记忆能力,降低淀粉样前体蛋白的表达水平[3]。本实验通过建立AD动物模型,研究在Aβ1-42诱导大鼠学习记忆障碍发生发展中海马神经元内质网Aβ结合蛋白(endoplasmic re-ticulum amyloid-β peptide-binding protein,ERAB)表达水平的变化及其在介导内质网未折叠蛋白通路中的作用,同时揭示何首乌提取物二苯乙烯苷治疗AD的主要作用机制及药物靶点。
1 材料和方法
1.1 材料
1.1.1 实验动物分组 选用健康4月龄Wistar大鼠80只(中南大学实验动物中心提供),雌雄各半,体重250~350g。将选择好的动物应用随机数字表进行分组,分为对照组、假手术组、模型组、TSG组各20只。
1.1.2 主要试剂和药 ERAB一抗购于Stressgen公司;Aβ1-42购于Santa Cruz公司;二苯乙烯苷为从何首乌中提取分离的干粉,含量为68%(湖南中医药研究所提供),实验时用水溶解为100mg/kg的浓缩液。
1.2 方法
1.2.1 大鼠模型的建立、取材及干预 水合氯醛按2.5ml/kg腹腔麻醉,立体定向仪下固定头部,参考大鼠图谱,确定前囟后3.0mm、中线旁2.5mm为海马所在部位,钻破颅骨,微量注射器进针约2.9 mm,左右两侧各缓慢均匀注入Aβ1-42各5μg,术后缝合皮肤。假手术组:注射液为等量生理盐水,灌胃液为生理盐水;模型组:注射液为Aβ1-42,灌胃液为生理盐水;二苯乙烯苷(TSG)组:注射液为Aβ1-42,灌胃液为二苯乙烯苷悬液。各组于制模21d取材,以上各组动物于造模前3d开始给药,每天灌胃一次,动物灌胃量按5ml/kg计算。
1.2.2 行为学检测 (1)Morris水迷宫定位航行实验(place navigation test,PNT)每天 8:00~11:00之间对每只大鼠进行训练,不选平台所在象限作为入水点,按顺时针方向把大鼠面向池壁放入水中,检测大鼠隐匿平台潜伏期。如果在规定的最长时间120s内未到达平台,则由实验者将其引至平台,逃避潜伏期记为120s,大鼠在平台休息20s后进行下一次测试。观察并记录动物找到并爬上平台的潜伏期、游泳路程及游泳轨迹。3d训练结束后将大鼠按组别进行造模。于制模后21d进行PNT。(2)Morris水迷宫空间探索试验(spatial probe test,SPT)各组大鼠最后一次PNT后撤除平台,将大鼠从最后一次入水点面向池壁放入水中,使大鼠在水迷宫中连续游泳,记录大鼠120s内穿越原平台平面的次数。
1.2.3 免疫组织化学法 采用SABC法。切片加3%H2O2,孵育10min,10%山羊血清封闭,孵育10min,滴加兔抗鼠ERAB抗体,4℃冰箱过夜,滴加适量生物素标记羊抗兔二抗工作液,37℃孵育20min,滴加适量的辣根酶标记的链霉卵白素工作液,37℃孵育15min。DAB显色剂显色,苏木精复染,脱水,透明,封片。显微镜下观察,细胞浆中出现棕黄色颗粒者为ERAB阳性细胞。阴性对照取PBS代替一抗,免疫反应阴性,说明一抗的特异性较强。
1.2.4 免疫印迹法(Western blot) 密度梯度离心法提取内质网蛋白,将海马组织转移到匀浆器中,加裂解液匀浆,离心(2400r/min,10min),取上清,继续离心(转速12000r/min,15min),取上清,再离心(15000r/min,30min),加入裂解液和蛋白酶抑制剂,用BCA蛋白测定试剂盒测定蛋白质浓度;样品与等体积的上样缓冲液混匀,煮沸变性,用10%SDS-PAGE分离,转移蛋白至硝酸纤维素膜,5%脱脂奶粉封闭,与一抗孵育,加入辣根过氧化物酶标记二抗孵育,ECL试剂盒进行化学发光检测,JS-300凝胶图像仪扫描分析处理
1.3 统计学分析 数据用SPSS12.0软件处理。计量资料用以均数±标准差(χ±s)表示,两组间比较用t检验,多组独立样本比较用方差分析。
2 结果
2.1 Morris水迷宫检测 与对照组相比,模型组和TSG组大鼠造模后21d的Morris水迷宫测试游泳潜伏期及路程均增加(P<0.01),穿越平台次数下降明显(P>0.05),差别随时间的延长而加大,以21d差别最明显(P<0.01);与模型组比较,TSG组21d的潜伏期缩短(P<0.05),游泳路程缩短(P<0.05),穿越平台次数增加(P <0.05),差异具有统计学意义。假手术组与对照组比较,差异无统计学意义(P>0.05),排除手术因素干扰(见表1)。
2.2 海马CA1区ERAB蛋白免疫阳性细胞半定量分析 光镜下ERAB阳性反应物位于神经元胞浆内,呈棕黄色颗粒状。结果显示模型组大鼠海马CA1区ERAB阳性神经元数目明显多于对照组和TSG组,差异具有显著性(P<0.05)。与对照相比,TSG组可见较多胞浆呈棕黄色颗粒状的阳性细胞,阳性细胞数明显减少,有显著差异性(P<0.05)。平均灰度值与ERAB阳性细胞数成反比。与对照组比较,模型组大鼠可见ERAB表达的阳性神经元多,平均灰度值明显减少,有显著差异性(P<0.01)。与模型组比较,TSG组ERAB阳性反应产物减少,其平均灰度值增加,差异有统计学意义(P<0.05)(见表2、见图1~图3)。
2.3 内质网Aβ结合蛋白的表达 将产物采用蛋白质印迹方法分析,与对照组比较,可见模型组的ERAB蛋白的表达21d升高,蛋白表达为对照组的109.6%,与模型组比较,TSG组在21d时ERAB蛋白表达减少,统计学比较有显著性差异(t=16.4317,P=0.00 <0.05);假手术组与对照组比较无显著性差异(t=1.3587,P=0.2041 >0.05),排除手术因素干扰(见表3)。χ±s)

表1 各组大鼠Morris水迷宫行为学比较(χ±s)

表2 海马CA1区ERAB免疫阳性细胞计数比较(χ±s)

表3 ERAB的蛋白相对表达(ERAB/β-actin)(
3 讨论
老年斑是AD的主要组织病理变化,而Aβ是老年斑的主要成分,因此,Aβ的神经毒性是AD形成和发展的关键因素。Aβ由39~43个氨基酸组成,来源于淀粉样前体蛋白(amyloid precursor protein,APP),如果各种危险因素导致APP的异常剪切,Aβ的空间构象发生改变,就会导致Aβ异常聚集而产生神经毒性作用[4]。
Aβ的构象折叠主要是在细胞的内质网中完成。内质网是蛋白质合成、加工和转运的主要场所,在真核细胞的生长发育中起着关键作用。内质网腔内有大量的“分子伴侣”,辅助和监控蛋白质的正确折叠并装配成天然构象。在某些刺激因素下,内质网的功能受到影响,造成大量未折叠或错误折叠的蛋白质堆积,由此引起一系列“分子伴侣”表达上调,以帮助蛋白进一步正确折叠、装配,使受损细胞在应激情况下存活,这个应答过程称为内质网应激。ERAB是一个细胞内与Aβ结合的蛋白,是内质网发现的一种羟基类固醇脱氢酶,由262个氨基酸组成[5]。在肝脏和心脏具有最高转录活性,正常脑神经元中呈低水平表达,但在AD脑中特别是在Aβ沉积的临近部位表达量明显增加[6]。当在AD的神经损伤时,ERAB过度表达,Aβ可与其结合,形成具有神经毒性作用的ERAB-Aβ复合物[7]。由于ERAB缺少信号蛋白和转膜序列,因此Aβ1-42与ERAB结合后可导致复合物再分布,从内质网转位至浆膜。研究表明体外抗ERAB抗体可减轻神经元氧化功能减退和细胞凋亡[8]。同样的,当由于各种因素造成内质网应激的发生的时候,由于未折叠或者错误折叠的Aβ堆积,ERAB就可以与之结合,并产生一定的神经毒性作用,ERAB的表达基本与Aβ的生成量成正比关系,因此我们的实验也从一个侧面来反映出模型大鼠的海马神经元中有内质网应激的形成,在这个形成过程中有包括Aβ等蛋白的大量错误折叠,从而导致ERAB的表达发生变化。因此,Aβ1-42神经毒性诱发神经元内质网功能障碍,从而加剧内质网种蛋白错误折叠的几率,使细胞内Aβ的异常剪切增多并积聚,ERAB的表达增多,并于Aβ形成的复合物,这种具有神经毒性的复合物加重了细胞的损伤,并可能诱导凋亡和自嗜发生。

图1 对照组×400倍

图2 模型组×400倍
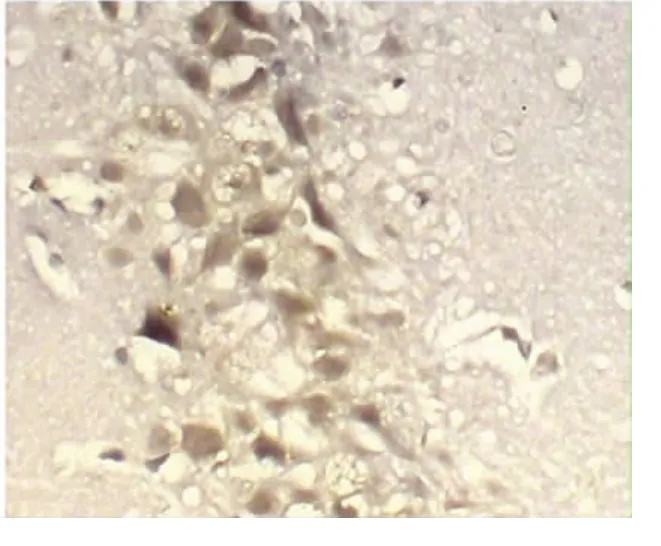
图3 TSG组×400倍
本实验中,ERAB免疫反应阳性细胞数及蛋白表达在模型组均较对照组增加。由于ERAB抗体仅与 AβC 端(Aβ1-40和 Aβ1-42)反应,而不与 Aβ1-39和APP全长结合,故该实验结果可反映出异常折叠的Aβ表达。Aβ是APP分子经BACE和γ-分泌酶共同酶切的产物,ERAB免疫反应阳性神经元在模型组明显增加,此结果与AD患者脑中ERAB表达和活性增高的有关报道一致。以此推断AD脑内存在的ERAB产生过多,可能与脑老化过程有关。我们的实验结果说明Aβ及ERAB表达水平在AD脑病动物海马神经元中明显增加,因此,ERAB增加可能是AD海马神经元退变的机制之一。
我们前期对何首乌提取物TSG的研究表明,TSG能改善AD模型大鼠学习记忆能力,缓解内质网应激的程度,减少自嗜和凋亡[7~11]。因此,本研究进一步揭示TSG治疗AD的主要作用机制及药物靶点。Morris水迷宫实验中,PNT主要考察大鼠的空间分辨学习能力,SPT主要测量大鼠的工作记忆能力,通过本实验可以看出,在Aβ毒性作用下,模型大鼠的学习记忆、空间定向、工作记忆能力明显下降,表现为Y电迷宫躲避所需的电刺激次数增加,Morris水迷宫测试中潜伏期延长,游泳路程增加及穿越平台次数减少;说明Aβ对大鼠的学习记忆、空间记忆及工作记忆能力有明显的损害效应;经TSG干预后,大鼠潜伏期缩短,游泳路程缩短,穿越平台次数增加,说明TSG可改善模型大鼠空间定向、工作学习能力,具有脑保护作用。Western的结果显示,经TSG干预后,ERAB的表达明显降低,结合前期研究说明TSG可通过降低过度的内质网应激程度,减少内质网中错误折叠的Aβ,从而逆转模型鼠海马神经元中ERAB蛋白的异常上调,提示内质网中的Aβ的产生过程是可以调节的,具有神经保护作用的TSG可通过内质网途径,减少ERAB、Aβ及其复合物的生成,从而起到改善AD鼠行为学障碍的脑保护作用。
[1]Querfurth HW,LaFerla FM.Alzheimer’s disease[J].N Engl J Med,2010,362(4):329-344.
[2]Tomiyama T.Involvement of beta-amyloid in the etiology of Alzheimer’s disease[J].Brain Nerve,2010,62(7):691-699.
[3]LUO HB,YANG JS,SHI XQ et al.Tetrahydroxy stilbene glucoside reduces the cognitive impairment and overexpression of amyloid precursor protein induced by Al exposure[J].Neurosci Bull,2009,25(6):391-396.
[4]孙 欣,杨 宇,吴 江.β淀粉样蛋白在阿尔茨海默病中所致的细胞内毒性作用[J].中风与神经疾病杂志,2011,28(3):277-279.
[5]Kumar S,Debomoy.ERAB Contains a putative noncleavable signal peptide[J].Biochemical and Biophysical Research Communications,1998,249(2):546-549.
[6]Maria EM,Tzipe G,Rodrigo M,et al.Identification of amyloid-beta binding protein fragments by screening of a human brain cDNA Library[J].Neuroscience Letters,2006,397(1):79-82.
[7]Yan SD,Fu J,Soto C,et al.An intracellular protein that binds amyloid-βpeptide and mediates neurotoxicity in Alzheimer’s disease[J].Nature,1997,389:689-694.
[8]Sheng SL,Zhao YM,Zhao ZW,et al.β-amyloid and its binding protein in the hippocampus of diabetismice:effect of APP177 peptide[J].Neuroreport,2001,34(12):3317-3320.
[9]罗红波,杨金升,石向群,等.Aβ诱导内质网应激性凋亡通路的启动及二苯乙烯苷的影响[J].东南大学学报,2011,30(6):855-860.
[10]罗红波,石向群,杨金升,等.Aβ诱导海马神经元自噬通路启动及二苯乙烯苷的干预影响[J].中华神经科杂志,2012,45(2):96-101.
[11]罗红波,杨金升,石向群,等.Aβ诱导内质网应激中GRP78的表达变化及二苯乙烯苷的影响[J].中华老年心脑血管病杂志,2012,14(3):315-318.

