脑活素对周围神经损伤修复的实验研究
柴子佳, 陈 浩, 范雪丽, 江新梅
周围神经损伤(PNI)是神经内科常见病的主要临床表现及相关临床伴随症状。中枢神经系统(CNS)与周围靶器官的联系需要通过周围神经系统,其传递的主要内容是感觉和运动信号。周围神经损伤发生率较高,损伤修复时间较长,很多情况下会造成远端器官不可逆的组织萎缩及功能废用,这不仅导致患者运动功能缺失及感觉异常,同时也会造成心理上的痛苦。因此,PNI很大程度上影响患者的生活质量,同时在社会经济学上影响深远[1]。积极寻找一种可促进周围神经修复的方法迫在眉睫。
Wei ZH[2]等人通过大量数据总结出脑活素对治疗痴呆和卒中后遗症有很好的疗效,甚至对轻至中度的认知障碍患者具有增强记忆的作用。近年来对于脑活素治疗周围神经病的研究日益火热,付睿等人[3]使用脑活素治疗急性特发性面神经麻痹已在临床上取得很好的治疗效果,尤其在对于House-Brackmann分级Ⅴ~Ⅵ级重症患者使用施普善的总有效率可达82.4%;Sherifa[4]应用脑活素对 6种传统治疗方法不能解决的周围神经损伤进行治疗,均取得了很好疗效。本文将以鼠坐骨神经损伤模型判定脑活素对周围神经损伤的修复作用。
1 材料和方法
1.1 材料
1.1.1 主要试药 施普善 奥地利艾威特药品有限公司10ml:2152mg;甲钴胺:日本卫材株式会制造 1ml:0.5mg。
1.1.2 动物及分组 雌性Wistar成年大鼠,体重180~200g,实验动物均由吉林大学实验动物中心提供。动物随机分为5组,分别为生理盐水空白对照组(A组)、甲钴胺阳性药物对照组(B组)、脑活素低剂量组(C组)、脑活素中剂量组(D组)及脑活素高剂量组(E组),每组10只。A组每天给予2ml生理盐水腹腔注射,余4组根据体表面积计算公式,按照人类用量换算相应大鼠药物剂量;B组每天给予甲钴胺0.21ml/kg(约为成人500μg/d)配成2ml腹腔注射;C组每天给予施普善低剂量1.04ml/kg(约为成人10ml/d)配成2ml腹腔注射;D组每天给予施普善中剂量组3.12ml/kg(约为成人30ml/d)配成2ml腹腔注射;E组每天给予施普善高剂量组5.2ml/kg(约为成人50ml/d)配成2ml腹腔注射。用药为一个疗程,共计10d。
1.2 方法
1.2.1 制备模型方法 实验动物以10%水合氯醛(0.1ml/kg)作腹腔注射麻醉。以俯卧位固定于鼠板上,右侧臀部备皮处理后,用碘伏在备皮处进行消毒,共3次。无菌条件下作右臀部斜切口,于臀肌间隙钝性分离显露右侧坐骨神经,距梨状肌下缘0.5cm处使用14cm止血钳钳夹坐骨神经,宽度约为1.5mm,单次钳夹 10s,间隔 5s,共钳夹 3 次,用 4-0慕丝手术缝线在钳夹处旁边的肌肉缝线标记,之后立即以4-0慕斯手术缝线,缝合切口。
1.2.2 一般状态 分别于术后24h及取材前观察各组大鼠的毛色、状态及整体活动情况。
1.2.3 坐骨神经功能指数(SFI)评分 自制大鼠足行走箱,通道长90cm,宽15cm,高20cm。箱底放置连续记录纸(15cm宽)。受试鼠双后足蘸炭素墨水,放入行走箱入口,鼠在向远端爬行过程中每侧留4~5个足印,选实验侧足(E)和正常侧足(N)足印,测量以下3个变量。(1)足印长度 (print length,PL),指足印最长距离,即足跟到足尖的距离;(2)足趾宽度 (toe spread,TS),即第一趾到第五趾连线的距离;(3)中间足趾距离(inter toe distance,IT),即第二趾到第四趾连线的距离。将上述3个变量代入Bain公式计算SFI,以SFI=0为正常值,-100为神经完全断离指标。SFI=-38.3*(EPL-NPL)/NPL+109.5*(ETS-NTS)/NTS+13.3*(EIT-NIT)/NIT-8.8 于制备模型24h 后及取材前两次测量记录
1.2.4 斜坡实验 自制长60cm,宽30cm,高60cm玻璃水槽,内置可匀速改变斜坡,表面为磨砂胶板,将一个疗程后实验大鼠放置在胶板中央,匀速改变胶板坡度,待实验侧后肢下滑长度达于5cm时,记录胶板倾斜角度,共实验3次取平均值。
1.2.5 小腿三头肌湿重 紧贴骨面取出两侧小腿三头肌,剔除表面结缔组织,滤纸吸干表面血液后,即刻在电子分析天平上称重,并和自身健侧小腿三头肌湿重比较。
1.2.6 坐骨神经取材方法 实验动物以10%水合氯醛(0.1ml/kg)作腹腔注射麻醉。以俯卧位固定于鼠板上,右侧臀部进行备皮处理,完成备皮后,用碘伏在备皮处进行消毒,共3次。无菌条件下沿原切口切开,钝性分离股间肌后显露坐骨神经,于慕丝线标记处及其远端10mm进行取材,要使用锋利组织剪刀剪断神经,再用剃须刀片行逆向平行切割远侧断端,近侧断端斜行切割,利于辨别,随即放入3%戊二醛中固定。
1.2.7 甲苯胺蓝神经染色 取材后的神经块可放入3%的戊二醛固定(4℃),之后加1%的锇酸进行后固定2h,常规脱水、包埋、制成病理标本。使用Leica半薄切片机切片,厚度为1μm,最后使用现用现配的甲苯胺蓝染色剂进行滴染,滴2~3滴至载玻片的神经切片上,酒精灯微加热至略干即可。
1.2.8 有髓神经纤维计数 将制备好的甲苯胺蓝染色标本使用olympus BX51显微镜及cell Sens Dimension细胞图像分析系统进行观察照相,10倍1张,20倍2张,随机不重叠40倍视野4张。使用iP-win32医学图像计量软件对有髓神经纤维进行测量,以获得数据为基础,通过图像分析和计算,得出坐骨神经直径、周长及面积变化情况,取其平均值。
1.2.9 统计学处理 所得计量数据均采用均数±标准差(χ±s)表示,统计学分析应用SPSS18.0软件,单因素方差分析进行统计学检验,其中实验组间两两比较采用Bonferroni法,与对照组比较采用Dunnett法统计。P<0.05为有统计学意义。
2 结果
2.1 一般状态 进行模型制备24h后进行观察,各组大鼠精神状态尚可,可自主进食,有趋避活动。在实验过程中,A组1只大鼠实验过程中死亡,1只手术切口感染,1只取材时麻醉致死;B组1只手术切口感染;C、D、E组无切口感染及死亡。
2.2 坐骨神经功能指数 模型制备成功后24h测量各组坐骨神经指数无差异性,表示损伤程度一致。用药一个疗程后,用药组坐骨神经功能指数恢复均好于空白对照组,其中D、E组与A组比较差异具有显著性(分别为 P<0.05,P<0.01)。用药各组间比较E组与B、C组比较差异具有显著性(P <0.05),余未见显著性(见表1)。
2.3 斜坡实验 未用药组角度小于各用药组,A 组54.28 ±1.75 与 C 组58.86 ±2.47、D 组59.00 ±4.11、E 组 61.52 ±5.53 各组差异有显著性(P <0.05、P <0.05、P <0.01)。在各用药组间对比中,E组较B 组56.62±2.47差异具有显著性(P <0.05)。
2.4 有髓神经纤维计数 用药组较未用药组的有髓纤维粗且明显,脑活素的改变随剂量增加而明显。B、C、D、E组均与A组有显著的差异(P<0.01),用药组之间对比,E组效果较好,均与B组对比结果具有差异性,尤其在平均直径和面积具有显著差异(P<0.01)(见表2)。
2.5 小腿三头肌肌肉湿重 仅E组0.454±0.11与 A 组 0.614±0.11间具有差异性(P <0.05),余4组间比较无差异性。
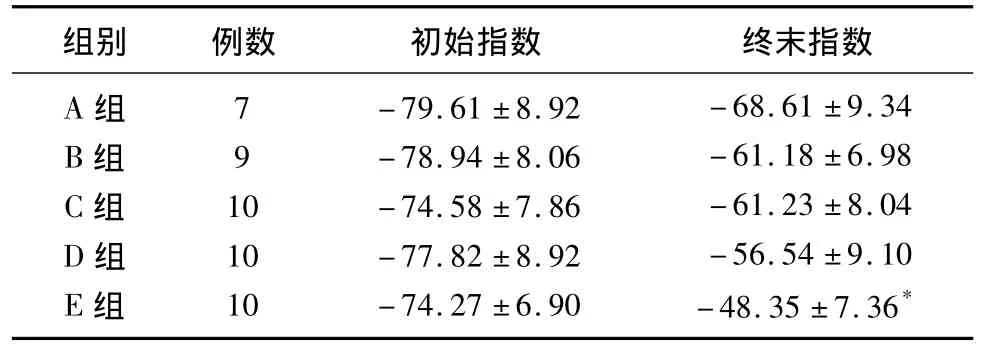
表1 各组坐骨神经指数
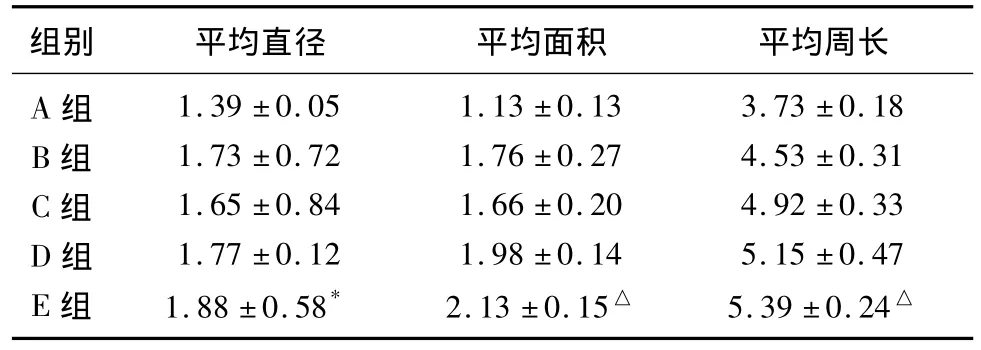
表2 各组有髓神经纤维测量
3 讨论
160 年前,Waller A[5]描述了青蛙的舌咽神经及舌下神经损伤后其横截面的形态学改变,后人便将此种改变称为瓦勒变性,并经过不断探索,总结了周围神经损坏修复途径及其机制-瓦勒变性及轴索再生。受伤的外周轴索有再生能力,但其再生的速度较慢且功能恢复较差,其中一个重要原因就是随着时间推迟周围组织的神经营养因子减少[6],所以促进再生的治疗方法主要是应用神经营养因子。最值得说明的一点是脑源性神经营养因子(BDNF)已被证明可提高神经损伤处的轴索远端再生能力[7],无论是其来源于施旺细胞还是运动神经元[8]。周围神经损伤的修复不仅与神经营养因子有关,同时还与炎症反应有关,Andrew D[9]等人提出及时的调节损伤处的炎症细胞,有助于保护周围神经再生相关细胞,从而可促进周围神经的修复。
脑活素是用生物技术标准化的酶学降解法对纯化的猪脑蛋白进行提取加工的一种肽制剂。脑活素具有BDNF的大多数作用。经过对比研究表明脑活素对于减少神经变性及促进神经损伤后的轴索再生作用要优于BDNF[10]。长期的研究发现一些短肽及神经营养素活性物类似于睫状神经营养因子(CNTF),胶质增生神经营养因子(GDNF),和胰岛素样生长因子-1和-2(IGF-1和IGF-2)存在于脑活素中,这些均参与了神经营养的作用[11]。在最新的研究中,Kiren Ubhi等人通过hAPP转基因小鼠实验中已经证明了脑活素参与了NGF前体蛋白转化成NGF的过程并保持两者的平衡。同时脑活素具有一些额外的抗氧化及抗炎功能,这也许对周围神经的修复起到另一种关键作用。
本实验研究证明脑活素对周围神经的修复作用具有量效关系,并且高剂量组明显好于甲钴胺组及脑活素低、中剂量组。此次实验为周围神经的修复找到了新的治疗方法,也为脑活素治疗周围神经提供了科学依据,但是施普善作用于周围神经的修复机制还尚不清楚,仍为值得探讨研究的方向。
[1]Taylor RS.Epidemiology of refractory neuropathic pain[J].Pain Pract,2006,6,22-26.
[2]Wei ZH,He QB,Wang H,et al.Meta-analysis:the efficacy of nootropic agent cerebrolysin in the treatment of Alzheimer’s disease[J].Neural Transm,2007,114:629-634.
[3]付 睿,戴 威,孟 然等.脑蛋白水解物治疗急性特发性面神经麻痹随机对照研究[J].Chin JNerv Ment Dis,2011,37(5):295-297.
[4]Sherifa AH.Cerebrolysin as a nerve growth factor for treatment of acquired peripheral nervous system diseases[J].Neural Regen Res,2011,6(18):1415-1420.
[5]Waller A.Experiments on the section of the glossopharyngeal and hypoglossal nerves of the frog,and observations of the alterations produced thereby in the structure of their primitive fibres[J].Philosophical Transactions of the Royal Society of London,1850,140:423-429.
[6]Gordon T.The role of neurotrophic factors in nerve regeneration[J].Neurosurg Focus,2009,26(2):E3.
[7]English AW,Meador W,Carrasco DI.Neurotrophin-4/5 is required for the early growth of regenerating axons in peripheral nerves[J].Eur J Neurosci,2005,21:2624-2634.
[8]Jennifer C.Wilhelm,Mei Xu et al.Cooperative roles of BDNF expression in neurons and schwann cells are modulated by exercise to facilitate nerve regeneration[J].J Neuroscience,2012,32(14):5002-5009.
[9]Andrew DG,Phillip GP,Matt SR.Wallerian degeneration:Gaining perspective on inflammatory events after peripheral nerve injury[J].J Neuroinflammation,2011,8:110.
[10]Haninec P,Dubovy P,Samal F,et al.Reinnervation of the rat musculocutaneous nerve stump after its direct reconnection with the C5 spinal cord segment by the nerve graft following avulsion of the ventral spinal roots:a comparison of intrathecal administration of brainderived neurotrophic factor and cerebrolysin[J].Exp Brain Res,2004,159(4):425-432.
[11]Chen H,Tung YC,Li B,et al.Trophic factors counteract elevated FGF-2-induced inhibition of adult neurogenesis[J].Neurobiol Aging,2007,28:1148-1162.

