淫羊藿苷与金雀异黄酮对大鼠峰值骨量的影响
成 魁,葛宝丰,甄 平,陈克明,马小妮,周 建,宋 鹏,马慧萍
中国人民解放军兰州军区兰州总医院 1骨科研究所 2药剂科,兰州730050
骨质疏松症是一种普遍随年龄增长而形成的骨和矿物质紊乱的疾病[1],骨质疏松症由峰值骨量和年龄增长相关的骨丢失两方面决定[2]。峰值骨量是骨成熟末期达到的最大骨量,是骨最坚硬和骨矿含量最高的时期[3],更高峰值骨量会减缓发病的概率[4]。因此,提高峰值骨量是一条预防骨质疏松的理想途径。Bhargavan等[5]报道,通过口服美迪紫檀素提高峰值骨量可达到预防骨质疏松症的目的。淫羊藿具有强筋健骨之功效,常用于治疗骨质疏松或促进骨折愈合[6]。淫羊藿苷 (icariin,ICA)是淫羊藿中含量最为丰富的黄酮苷类化合物,金雀异黄酮是豆科植物中的一种异黄酮,是近年较受关注抗骨质疏松新药[7]。ICA比金雀异黄酮 (genistein,GEN)在8位碳上多1个异戊烯基,有研究表明,ICA比GEN能更强地促进成骨细胞成骨性分化和矿化成熟[8]。本研究通过口服 ICA与GEN,探讨其对大鼠峰值骨密度和骨质量的影响,以期对ICA抗骨质疏松活性作出初步判断,并探索其中更强活性的药物。
材料和方法
材料 1月龄SD雌性大鼠36只,SPF级,体重(125±3)g,由甘肃中医学院实验动物中心提供 [合格证号:SCXK(甘)2004-0006-152];淫羊藿苷、金雀异黄酮购自陕西宝鸡辰光生物科技有限公司,纯度≥98%;抗酒石酸酸性磷酸酶试剂盒和骨钙素试剂盒为英国IDS公司产品;Technovit@9100试剂盒为Heraeus Kulzer GmbH&Co.KG公司产品;双能X射线骨密度仪 (GE公司,美国)、显微 CT(Micro-CT,μCT)(MILabs公司,荷兰)和AG-IS万能材料实验机 (岛津公司,日本)均为本实验室仪器。
分组和给药 实验大鼠随机抽样法分为3组,每组12只,一组每日灌服淫羊藿苷,称为服药组,一组每日灌服金雀异黄酮,称为阳性对照组,另一组只给予等体积蒸馏水,称作对照组。淫羊藿苷用蒸馏水配成2.5 g/L的混悬液。按每只大鼠25 mg/kg体重给药。金雀异黄酮用蒸馏水配成1 g/L的混悬液。按每只大鼠10 mg/kg体重给药。大鼠饲养于SPF级实验室,自由摄水和进食,记录每日进食量和进水量,每周称1次体重。
脏器常规病理学 动物处死后讯即剥离出心脏、肝脏、胃、肾、肾上腺和子宫,称重,计算器官指数,并将所有器官固定于10%福尔马林中,石蜡包埋,常规切片,HE染色,由高年资深病理医师进行病理学观察与评价。
骨密度的测定 每月在麻醉状态下测1次全身骨密度,第3个月测完后即处死所有动物,剥离出四肢长骨,左侧股骨用于检测骨密度。麻醉采用10%水合氯醛,剂量为3 ml/kg,腹腔注射。
血清生化指标的测定 采用心脏取血法抽取血样,4000 r/min离心10 min(转子半径为10 cm),取上层血清,-80℃保存;按试剂盒说明书制作骨钙素(osteocalcin,OC)和抗酒石酸性磷酸酶5b(anti-tartaric acid phosphatase 5b,TRACP 5b)标准曲线,OC于450 nm、TRACP 5b于405 nm处测定吸光度值,通过标准曲线计算出含量。
μCT影像分析 将右侧股骨用70%酒精固定。感兴趣区域选择在距生长板1 mm位置。分析参数包括相对骨体积率、骨小梁厚度、骨小梁数量、骨小梁分离度和模型系数,并采集成像图片。
骨形态计量分析 将右侧胫骨固定于70%酒精中。严格按照technovit@9100试剂盒操作说明书依次进行脱水、脱塑、浸渍、渗透和包埋,聚合2 d后切片,磨片,用VG法染色,观察骨骺线下1~4 mm距离区域。
生物力学分析 将左侧股骨用浸透0.9%生理盐水的纱布包裹后保存于-20℃。在实验24 h前取出,于室温下自然解冻。3点弯曲实验的跨距为17 mm,速度为10 mm/min。记录载荷变形曲线,得到包括最大载荷、屈服强度和弹性模量等指标。
统计学处理 采用SPSS 16.0统计软件完成,所有检测数据均用均数±标准差表示,不同组间差异采用单因素方差分析 (One-way ANOVA),组间两两比较用LSD检验法 (方差齐)。P<0.05为差异具有统计学意义。
结 果
进食量、进水量和体重 3组大鼠的每日进食量和进水量差异无统计学意义 (P>0.05),体重虽然有随时间增长而增加的趋势,但差异无统计学意义 (P>0.05)(图1)。
脏器常规病理学 3组心脏、肝脏、胃、肾、肾上腺和子宫的器官指数差异无统计学意义 (P>0.05);且常规病理学观察无异常改变。
骨密度 3组大鼠的全身骨密度在实验开始时、服药后1个月和服药后2个月差异均无统计学意义,但服药后3个月差异具有统计学意义 (P<0.05)。股骨骨密度与全身骨密度变化趋势一致 (表1)。
血清OC和TRACP 5b含量 ICA组大鼠血清OC、PINP水平显著高于对照组 (P<0.05,P<0.01);而血清TRACP 5b、CTX-I水平显著低于对照组 (P<0.05,P<0.01)(表2)。
μCT影像 ICA组相对骨体积率、骨小梁数和骨小梁厚度明显高于对照组组 (P<0.05),但骨小梁分离度和模型系数明显低于对照组组 (P<0.05),GEN模型系数较对照组显著降低,ICA组与GEN组差异无统计学意义 (P>0.05)(表3、图2)。
骨形态计量分析 胫骨骨形态计量分析显示,ICA组骨小梁数和骨小梁厚度显著高于对照组与GEN组 (P<0.05),但骨小梁分离度显著低于对照组与GEN组 (P<0.05)(图3)。
图1 大鼠体重的变化Fig 1 The body weight of rats during experiment
表1 不同时间大鼠全身骨密度和股骨骨密度检测结果 (n=12,±s,g/cm3)Table 1 Total and femur bone mineral density of rats at different time points(n=12,x-± s,g/cm3)
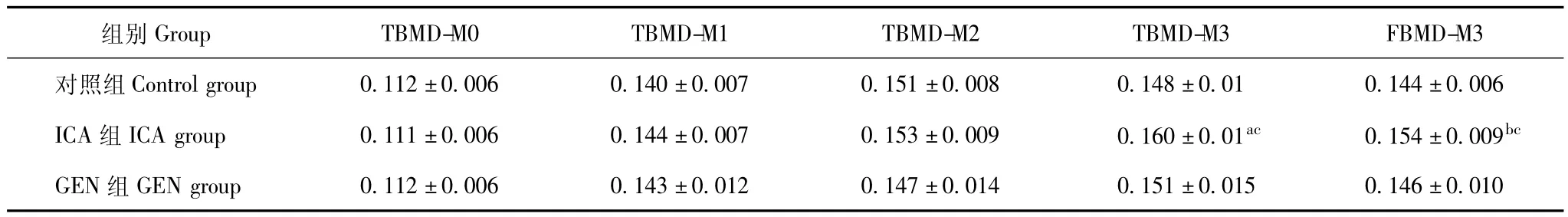
表1 不同时间大鼠全身骨密度和股骨骨密度检测结果 (n=12,±s,g/cm3)Table 1 Total and femur bone mineral density of rats at different time points(n=12,x-± s,g/cm3)
TBMD-M0:开始服药前全身骨密度;TBMD-M1:服药1个月后全身骨密度;TBMD-M2:服药2个月后全身骨密度;TBMD-M3:服药3个月后全身骨密度;FBMD-M3:服药3个月后股骨骨密度;与对照组比较,aP<0.05,bP<0.01;与GEN组比较,cP<0.05TBMD-M0:basal total bone mineral density;TBMD-M1:total bone mineral density after experiment 1 month;TBMD-M2:total bone mineral density after experiment 2 month;TBMD-M3:total bone mineral density after experiment 3 month;FBMD-M3:femur bone mineral density after experiment 3 month;aP <0.05,bP<0.01 compared with control group;cP<0.05 compared with GEN group
组别Group TBMD-M0 TBMD-M1 TBMD-M2 TBMD-M3 FBMD-M3对照组Control group 0.112±0.006 0.140±0.007 0.151 14 0.151±0.015 0.146±0.010±0.008 0.148±0.01 0.144±0.006 ICA组ICA group 0.111±0.006 0.144±0.007 0.153±0.009 0.160±0.01ac 0.154±0.009bc GEN组GEN group 0.112±0.006 0.143±0.012 0.147±0.0
表2 大鼠血清OC和TRACP 5b的含量 (n=12,±s)Table 2 Serum OC and TRACP 5b of rats(n=12,±s)
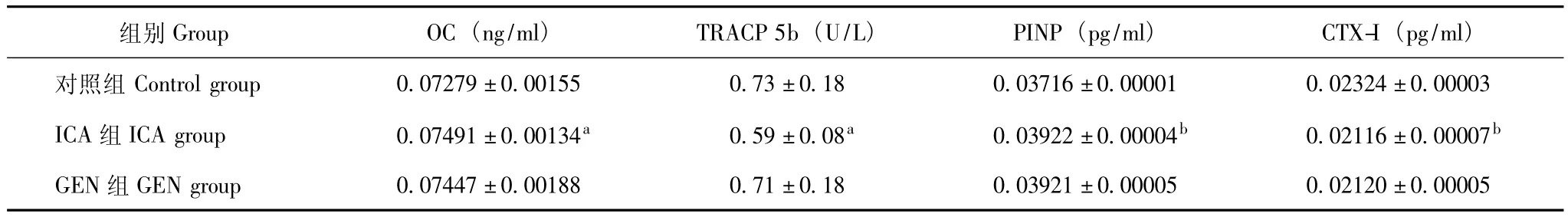
表2 大鼠血清OC和TRACP 5b的含量 (n=12,±s)Table 2 Serum OC and TRACP 5b of rats(n=12,±s)
OC:骨钙素;TRACP 5b:抗酒石酸性磷酸酶5b;PINP:Ⅰ型前胶原氨基端前肽;CTX-Ⅰ:Ⅰ型胶原C末端肽;与对照组比较,aP<0.05,bP<0.01 OC:osteocalcin;TRACP 5b:anti-tartaric acid phosphatase 5b;PINP:N-terminal propeptide of typeⅠ procollagen;CTX-Ⅰ:C-terminal propeptide of typeⅠcollagen;aP <0.05,bP <0.01 compared with control group
组别Group OC(ng/ml)TRACP 5b(U/L)PINP(pg/ml)CTX-I(pg/ml)对照组 Control group 0.07279±0.00155 0.73±0.18 0.0±0.00005 0.02120±0.00005 3716±0.00001 0.02324±0.00003 ICA组ICA group 0.07491±0.00134a 0.59±0.08a 0.03922±0.00004b 0.02116±0.00007b GEN组GEN group 0.07447±0.00188 0.71±0.18 0.03921
表3 大鼠股骨显微CT分析结果 (n=5,±s)Table 3 Femurs of rats as analyzed by micro-CT(n=5,±s)
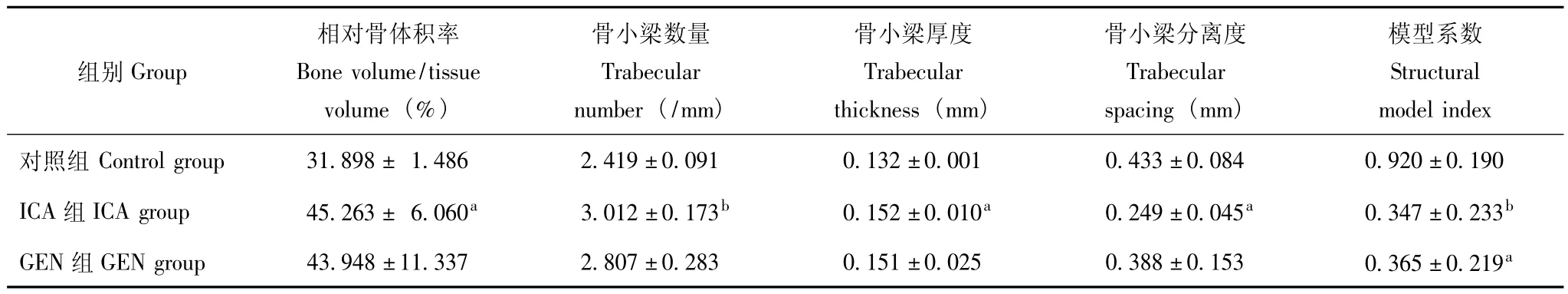
表3 大鼠股骨显微CT分析结果 (n=5,±s)Table 3 Femurs of rats as analyzed by micro-CT(n=5,±s)
与对照组组比较,aP<0.05,bP<0.01aP <0.05,bP <0.01 compared with control group
组别Group模型系数Structural model index对照组 Control group 31.898± 1.486 2.419±0.091 0.13相对骨体积率Bone volume/tissue volume(%)骨小梁数量Trabecular number(/mm)骨小梁厚度Trabecular thickness(mm)骨小梁分离度Trabecular spacing(mm)2±0.001 0.433±0.084 0.920±0.190 ICA组ICA group 45.263± 6.060a 3.012±0.173b 0.152±0.010a 0.249±0.045a 0.347±0.233b GEN组GEN group 43.948±11.337 2.807±0.283 0.151±0.025 0.388±0.153 0.365±0.219a

图2 大鼠股骨显微CT影像Fig 2 Three-dimensional reconstruction of the femur micro-CT
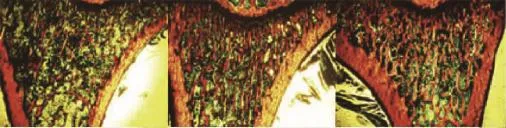
图3 大鼠股骨骨形态图片 (×40)Fig 3 Bone histomorphometry in rat(×40)
骨生物力学 股骨三点弯曲实验显示,ICA组的最大载荷和弹性模量显著高于对照组 (P<0.01),GEN组的最大载荷显著高于对照组 (P<0.05),ICA组与GEN组的屈服强度均显著高于对照组(P<0.05)(表4)。
表4 大鼠骨生物力学结果 (n=12,±s)Table 4 Biomechanics of the femurs of rats(n=12,±s)
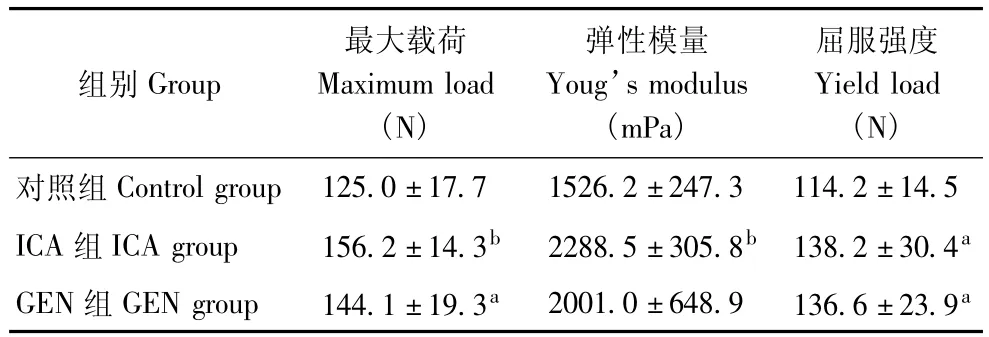
表4 大鼠骨生物力学结果 (n=12,±s)Table 4 Biomechanics of the femurs of rats(n=12,±s)
与对照组比较,aP<0.05,bP<0.01aP <0.05,bP <0.01 compared with control group
组别Group最大载荷Maximum load(N)弹性模量Youg’s modulus(mPa)屈服强度Yield load(N)对照组Control group 125.0±17.7 1526.2±247.3 114.2±14.5 ICA组ICA group 156.2±14.3b 2288.5±305.8b 138.2±30.4a GEN组GEN group 144.1±19.3a 2001.0±648.9 136.6±23.9a
讨 论
峰值骨量与骨质疏松密切相关,高峰值骨量人群患骨质疏松症的概率相对较低峰值骨量者低,所以获得高水平的峰值骨量是潜在预防骨质疏松的方法。近年众多学者采用刚断乳后1个月龄雌性大鼠作为实验动物,通过研究峰值骨量探寻解决骨质疏松的途径。
GEN是一种较为公认的治疗骨质疏松症的药物,本研究参考选择该药物浓度10 mg/kg体重[9],并换算成同样摩尔浓度的ICA,即25 mg/kg剂量,在给药的分子量一致的前提下,对比研究两种药物的药效。在口服ICA与GEN 3个月后,大鼠饮食无变化,未产生毒副作用。与对照组和GEN组相比,ICA显著提高了全身骨密度与股骨骨密度,而服药3个月的时间与大鼠骨重建周期需3个月是一致的[10],表明ICA影响骨密度的能力强于GEN。骨质量主要与骨组织微结构有关,而μCT可以准确并直观反映骨微结构和形态[11]。本研究μCT检测显示,ICA能提高骨小梁的网状结构交联度,从而使大鼠骨质紧密,明显改善骨微结构,而GEN出现提高的趋势,但差异无统计学意义。骨生物力学参数可较直接地反映骨的抗骨折能力,代表骨硬度。口服ICA与GEN后均显著提高了大鼠的生物力学性能,即抗骨折的能力,GEN组生物力学能力的提高可能是骨组织微结构的改善,但ICA提高骨生物力学能力的值均高于GEN。通过提高体内骨形成水平和抑制骨吸收水平,可以提高骨量。血清骨钙素、Ⅰ型前胶原氨基端前肽是成骨细胞分泌的酶,是骨形成的特异性指标,抗酒石酸性磷酸酶5b、Ⅰ型胶原C末端肽是破骨细胞分泌的酶,是骨吸收的特异性指标。在血清骨钙素、抗酒石酸性磷酸酶5b、Ⅰ型前胶原氨基端前肽和Ⅰ型胶原C末端肽的检测中显示,ICA组大鼠体内骨形成的水平提高,同时骨吸收的水平下降,而GEN未提高骨形成抑制骨吸收,这可能是ICA组大鼠骨密度高于GEN的主要原因。
口服淫羊藿苷与金雀异黄酮3个月后对比研究显示,淫羊藿苷提高骨密度的能力强于金雀异黄酮,而且对骨硬度的提高能力具有同样的表现。其原因是淫羊藿苷提高骨形成抑制骨吸收的能力强于金雀异黄酮,而且金雀异黄酮对骨组织微结构的改建弱于淫羊藿苷,导致骨质量与骨强度的差异;淫羊藿苷结构带有的8-异戊烯基可能也是造成淫羊藿苷具有更强活性的原因。但8-异戊烯基基团与骨质疏松的关系尚待进一步深究。
[1]Okano T.Effects of essential trace elements on bone turnoverin relation to the osteoporosis[J].Jpn J Clin Med,1996,54(1):148.
[2]安珍,程静,王文志,等.峰值骨量与骨质疏松症 [J].现代康复,2001,5(2):152-154.
[3]Mardon J,Mathey J,Kati-Coulibaly S,et al.Influence of lifelong soy isoflavones consumption on bone mass in the rat[J].Exp Biol Med,2008,233(2):229-237.
[4]Kaludjerovic J,Ward WE.Neonatal exposure to daidzein,genistein,or the combination modulates bone development in female CD-1 mice [J].J Nutr,2009,139(3):467-473.
[5]Bhargavan B,Singh D,Gautam AK,et al.Medicarpin,a legume phytoalexin,stimulates osteoblast differentiation and promotes peak bone mass achievement in rats:evidence for estrogen receptor β-mediated osteogenic action of medicarpin[J].J Nutr Biochem,2012,23(1):27-38.
[6]董远芳.淫羊藿等中药治疗骨质疏松症的临床观察 [J].中药材,2004,27(8):620-622.
[7]Setchell KD,Lydeking-Olsen E.Dietary phytoestrogens and their effect on bone:evidence from in vitro and in vivo,human observational,and dietary intervention studies[J].Am J Clin Nutr,2003,78(3):593S-609S.
[8]Ma HP,Ming LG,Ge BF,et al.Icariin is more potent than genistein in promoting osteoblast differentiation and mineralization in vitro [J].J Cell Biochem,2011,112(3):916-923.
[9]Elmarakby AA,Ibrahim AS,Faulkner J,et al.Tyrosine kinase inhibitor,genistein,reduces renal inflammation and injury in streptozotocin-induced diabetic mice[J].Vasc Pharmacol,2011,55(5):149-156.
[10]Martin TJ,Seeman E.Bone remodelling:its local regulation and the emergence of bone fragility[J].Res Clin Endcrinol Metab,2008,22(5):701-722.
[11]Liu ZG,Zhang R,Li C,et al.The osteoprotective effect of Radix Dipsaci extract in ovariectomized rats[J].J Ethnopharmacology,2009,123(1):74-81.

