2型糖尿病患者脑部皮层下白质及胼胝体体积定量分析
陈志晔,李金锋,孙 杰,马 林
中国人民解放军总医院放射科,北京100853
糖尿病是一种常见的代谢性疾病,通常导致进行性的终末器官损害,对于神经系统通常导致认知功能的下降[1],前期基于体素的脑形态学 (voxel-based morphometry,VBM)研究显示2型糖尿病患者可以表现为右侧颞叶灰质及白质的萎缩[2],进一步证实了2型糖尿病患者脑部损伤的存在。2型糖尿病患者通常会伴发慢性高血糖,导致脑内微血管的损害,在常规影像学上可表现为脑白质缺血灶的产生。本研究对2型糖尿病患者各脑区皮层下白质的体积以及胼胝体的体积进行研究,并对胰岛素治疗后的体积变化进行评估。
对象和方法
对象 从我院糖尿病门诊共招募序贯2型糖尿病患者25例,其中16例符合入组标准,年龄47~70岁,平均(61.2±8.0)岁;病程7~30年,平均 (13.2±5.6)年。其中6例患有高血压,病程为2~30年,平均 (5.7±9.4)年。
入组标准:(1)空腹血糖大于7.0 mmol/L;(2)口服葡萄糖耐量试验2 h血糖大于11.1 mmol/L;(3)既往诊断过2型糖尿病。
基线排除标准:(1)既往接受过胰岛素治疗;(2)既往患有痴呆; (3)大血管并发症 (脑梗死或脑软化灶);(4)颅脑外伤;(5)中枢神经系统炎性病变;(6)近期服用过精神活性药物或激素。
脑萎缩判定标准采用10级度量法:主要依据脑室的大小及脑沟的宽度分为10级,0级为正常,9级为明显萎缩[3]。0级和1级患者入组,其他脑萎缩级别的患者被排除。
脑白质损伤判定标准采用10级度量法:0级为正常,1级为几乎看不到脑白质病变,9级为融合性白质病变[3]。0级和1级患者入组,其他级别患者被排除。
16例2型糖尿病患者中11例接受胰岛素 (混合重组赖脯鱼精蛋白锌人胰岛素,Lilly France S.A.S)治疗1年。初始胰岛素剂量为0.4~0.6 IU/(kg·d)(早饭前50%,晚饭前50%)。根据餐前血糖调整胰岛素剂量,初始4周每周监测两次血糖,随后的8周内每2周监测1次血糖。如果餐前血糖低于4.4 mmol/L,胰岛素总剂量减去2 IU;如果餐前血糖位于4.4~6.1 mmol/L,维持胰岛素总剂量不变;如果餐前血糖位于6.2~7.8 mmol/L,胰岛素总剂量增加2 IU;如果餐前血糖位于7.9~10 mmol/L,胰岛素总剂量增加4 IU;如果餐前血糖大于10 mmol/L,胰岛素总剂量增加6 IU。在随后的9个月内,胰岛素总剂量保持不变,必要时监测血糖。
所有糖尿病患者均为右利手,接受体重指数 (body mass index,BMI)、空腹血糖 (fasting blood glucose,FBG)、糖化血红蛋白(glycosylated haemoglobin,HbA1c)、总胆固醇 (total cholesterol,TC)、三酰甘油、尿蛋白(urine protein,UP)、肌酐清除率 (creatinine clearance rate,Ccr)和简明精神量表 (mini-mental status examination,MMSE)评估[4]。
从患者家属及社会招募16名健康志愿者,年龄52~73岁,平均 (59.6±7.0)岁,性别绝对匹配。排除标准同上,所有志愿者无高血压病史。
所有受试者均为右利手,并进行MMSE除外痴呆。所有受试者均签署知情同意书。
数据采集 磁共振成像数据采用3.0 T超导磁共振 机 (GE Medical System,Milwaukee,Wisconsin,USA)和8通道头颅相控阵列表面线圈进行采集,梯度场40 mT/m,梯度切换率150 mT/(m·s)。横轴位液体衰减翻转恢复 (fluid attenuated inversion recovery,FLAIR)序列扫描,平行于前联合-后联合线,参数为重复时间/回波时间/反转时间=9602/108/2400 ms,层厚=5 mm,间隔=1 mm,层数=22,视野=24 cm×24 cm,矩阵=320×224,采集次数=1.0。结构像扫描采用三维 (3D)快速扰相梯度回波采集全脑结构像,包含头皮,参数为:重复时间/回波时间/反转时间 =6.3/2.8/450 ms,层厚 =1.0 mm,间隔 =0 mm,层数=118,视野=24 cm×24 cm,矩阵=256×256,层面内分辨率 0.9375×0.9375,采集次数 =1.0。所有受试者均采用相同的扫描序列。扫描均由1名操作熟练的放射科医生扫描。扫描前用海绵垫固定受试者头部,并告知受试者扫描过程中保持头部静止。

图像分析 将原始资料传输至PACS系统,对常规影像进行观察,除外脑内有明确梗死、脑白质损伤、肿瘤等影响脑结构测量的受试者。3D结构像利用freesurfer软件 (4.3.0版本)进行自动测量[5],运行环境为Linux 2.6.15-2.5。对自动测量后的数据进行查对,如去头皮、灰质及白质分割、膨胀及分割后的组织进行检查,并对分割错误的点进行修补之后重新进行计算。分割后的皮层下白质及胼胝体见图1、2。

图1 皮层下白质分割图,双侧颜色相同的脑区为同一类型脑区Fig 1 The segment of subcortical white matter and the bilateral region with same color was the identical brain region

图2 胼胝体分割图,从左至右依次为胼胝体后部、中后部、中央部、中前部及前部Fig 2 The segment of corpus callosum and the posterior,postmedian,central,median anterior and anterior part of corpus callosum are shown from left to right
统计学处理 统计分析软件采用SPSS 19.0。一般资料采用描述性统计,结果用¯±s表示。年龄、MMSE、灰质体积 (gray matter volume,GMV)、白质体积 (white mater volume,WMV)和脑实质体积 (brain parenchyma volume,BPV)采用t检验,P<0.05为差异具有统计学意义。BMI由于方差不齐采用Welch检验。16例2型糖尿病患者与16例健康对照皮层下白质体积及胼胝体体积采用协方差分析,年龄及BMI为协变量,P<0.05为差异具有统计学意义,如果交互作用P>0.05则排除。11例随访患者皮层下白质体积及胼胝体体积采用配对t检验,P<0.05为差异具有统计学意义。
结 果
临床特征 16例2型糖尿病患者平均病程 (13.2±5.6)年,平均HbA1c(8.4±1.7)mmol/L;与16名正常对照相比,性别绝对匹配,年龄、BMI及MMSE两组差异无统计学意义 (P>0.05)。11例2型糖尿病患者仅接受胰岛素治疗1年,包括男性3例、女性8例,年龄47~75岁,平均年龄 (61.2±8.3)岁,病程7~30年,平均病程 (13.9±6.5)年 (基线水平)。11例患者中3例有高血压病史,病程2~30年,平均4.7年。在基线水平及随访水平,两组年龄、BMI、MMSE分数、病程、FBG、HbA1c、总胆固醇、尿蛋白、Ccr差异无统计学意义 (P>0.05),随访水平三酰甘油含量较基线水平明显降低 (P<0.05)(表1)。
全脑皮层下白质体积 2型糖尿病患者双侧皮层下白质体积 [左侧:(205.19±26.11)ml;右侧:(205.27±26.04)ml)]及总皮层下白质体积 (410.47±52.00)ml较对照组双侧皮层下白质体积[左侧:(224.76±20.46)ml;右侧:(227.89 ±20.20)ml]及皮层下白质总体积 (452.66±40.42)ml呈降低趋势(P>0.05)。经胰岛素治疗1年后,双侧皮层下白质体积及皮层下白质总体积两组差异无统计学意义(P>0.05)(表2)。
额叶皮层下白质体积 2型糖尿病患者双侧额中回尾侧 [左侧:(5.47±0.72)ml;右侧:(4.89±0.85)ml]及额叶岛盖部 [左侧:(2.98±0.55)ml;右侧:(2.68±0.35)ml]皮层下白质体积较对照组额中回尾侧 [左侧:(6.34±0.80)ml;右侧:(5.71±0.85)ml]及额叶岛盖部 [左侧:(3.56±0.73)ml;右侧:(3.27±0.58)ml)]显著减小,其他脑区 (外侧额叶眶回、内侧额叶眶回、中央旁回、额叶眶部、额叶三角部、中央前回、额中回吻侧、额上回及额极)皮层下白质体积两组差异无统计学意义 (P>0.05)。对11例接受胰岛素治疗1年的2型糖尿病患者测量额叶皮层下白质,结果显示左侧内侧额叶眶回及右侧额中回吻侧皮层下白质体积较对照组增加 (P<0.05),而双侧中央旁回及右侧额上回皮层下白质体积较对照组减少 (P<0.05)(表3)。
表1 2型糖尿病患者基线及随访水平临床特征 (±s)Table 1 The clinical characteristics of type 2 diabetes mellitus at baseline and follow-up levels(±s)

表1 2型糖尿病患者基线及随访水平临床特征 (±s)Table 1 The clinical characteristics of type 2 diabetes mellitus at baseline and follow-up levels(±s)
与基线相比,aP=0.003aP=0.003 compared with baseline
时间Time 例数 (女性/男性)No.(Female/Male)年龄 (岁)Age(year)体重指数Body mass index(kg/mm2)简明精神量表Mini-mental status examination病程 (年)Duration(year)空腹血糖Fasting blood glucose(mmol/L)基线Baseline 11(8/3)61.2±8.3 25.4±4.1 25.5±1.7 13.9±6.5 9.9±2.4随访Follow-up 11(8/3)62.2±8.3 24.7±3.5 23.4±5.0 14.9±6.5 7.4±2.2肌酐清除率Creatinine clearance rate(ml/min)基线Baseline 8.3±1.9 5.55±1.13 2.51±1.44 1.455±时间Time糖化血红蛋白Glycosylated haemoglobin(mmol/L)总胆固醇Total cholesterol(mmol/L)三酰甘油Triglyceride(mmol/L)尿蛋白Urine protein(mg/dl)1.369±2.332 108.38±31.18
表2 2型糖尿病患者基线及随访水平皮层下白质体积比较 (±s,ml)Table 2 The total volumes of subcorticla white matter in patients with type 2 diabets mellitus at baseline and follow-up levels(x-± s,ml)

表2 2型糖尿病患者基线及随访水平皮层下白质体积比较 (±s,ml)Table 2 The total volumes of subcorticla white matter in patients with type 2 diabets mellitus at baseline and follow-up levels(x-± s,ml)
*为协方差分析,年龄及体重指数为协变量*analysis of covariance,age and body mass index as concomitant variables
?
表3 2型糖尿病患者额叶基线及随访水平皮层下白质体积比较 (±s,ml)Table 3 Comparison of subcortical white matter volume of frontal lobe in the patients with type 2 diabetes mellitus between baseline and follow-up levels(±s,ml)

表3 2型糖尿病患者额叶基线及随访水平皮层下白质体积比较 (±s,ml)Table 3 Comparison of subcortical white matter volume of frontal lobe in the patients with type 2 diabetes mellitus between baseline and follow-up levels(±s,ml)
ROI-02:额中回尾侧;ROI-10:外侧额叶眶回;ROI-12:内侧额叶眶回;ROI-15:中央旁回;ROI-16:额叶岛盖部;ROI-17:额叶眶部;ROI-18:额叶三角部;ROI-22:中央前回;ROI-25:额中回吻侧;ROI-26:额上回;ROI-30:额极ROI-02:caudal middle frontal gyrus;ROI-10:lateral orbitofrontal gyrus;ROI-12:medial orbitofrontal gyrus;ROI-15:paracentral gyrus;ROI-16:pars opercularis;ROI-17:pars orbitalis;ROI-18:pars triangularis;ROI-22:precentral gyrus;ROI-25:rostral middle frontal gyrus;ROI-26:superior frontal gyrus;ROI-30:frontal pole
左侧(Left hemisphere)右侧(Right hemisphere)解剖学区域Anatomic region t值P值t值P值Pvalue ROI-02 5.52±0.83 5.52±0.97 -0.01 0.99 5.03±0.06 0.42±0.25 -1.34 0.21.76 4.73±0.89 2.28 0.05 ROI-10 5.78±0.96 5.58±0.85 1.28 0.23 5.81±0.71 5.60±0.79 1.41 0.19 ROI-12 3.52±0.90 3.98±0.66 -2.59 0.03 3.19±0.33 3.58±0.96 -1.63 0.13 ROI-15 3.54±0.50 3.16±0.55 2.44 0.04 4.28±0.73 3.83±0.78 2.81 0.02 ROI-16 3.06±0.59 3.12±0.98 -1.19 0.26 2.79±0.36 2.70±0.33 1.96 0.08 ROI-17 0.83±0.21 0.82±0.23 0.26 0.80 1.06±0.19 1.02±0.19 1.59 0.14 ROI-18 2.64±0.44 2.69±0.45 -1.27 0.23 3.11±0.52 3.19±0.54 -0.73 0.48 ROI-22 11.65±1.52 11.29±2.08 1.03 0.33 11.94±1.66 11.55±2.08 1.53 0.16 ROI-25 11.21±1.90 11.49±1.88 -1.03 0.33 11.19±1.98 11.50±1.92 -2.44 0.04 ROI-26 15.38±1.76 15.63±2.06 -1.25 0.24 15.39±1.77 14.93±1.78 2.95 0.02 ROI-30 0.25±0.07 0.25±0.06 -0.47 0.65 0.32±0基线Baseline随访Follow-up t value Pvalue基线Baseline随访Follow-up t value
顶叶各脑区皮层下白质体积 2型糖尿病患者右侧顶下回皮层下白质体积 (8.98±1.15)ml显著小于对照组 (10.94±1.39)ml(P<0.05),其他脑区(中央后回、顶上回及缘上回)皮层下白质体积两组差异无统计学意义 (P>0.05)(表4)。胰岛素治疗1年后复查显示右侧顶下回皮层下白质体积显著增加(P<0.05),其他顶叶皮层下白质体积胰岛素治疗前后差异无统计学意义 (P>0.05)(表5)。
枕叶各脑区皮层下白质体积 2型糖尿病患者枕叶各脑区 (楔叶、枕外侧回、舌回、距状回及楔前叶)皮层下白质体积与对照组差异无统计学意义 (P>0.05)(表6)。随访水平2型糖尿病患者右侧舌回皮层下白质体积较基线水平显著增加,而右侧楔前叶皮层下白质体积较基线水平显著减低 (P<0.05)(表7)。
表4 2型糖尿病患者与对照组顶叶各脑区皮层下白质体积比较 (±s,ml)Table 4 Comparison of subcortical white matter volume of parietal lobe between patients with type 2 diabetes mellitus and normal controls(x-± s,ml)

表4 2型糖尿病患者与对照组顶叶各脑区皮层下白质体积比较 (±s,ml)Table 4 Comparison of subcortical white matter volume of parietal lobe between patients with type 2 diabetes mellitus and normal controls(x-± s,ml)
ROI-06:顶下回;ROI-20:中央后回;ROI-27:顶上回;ROI-29:缘上回;T2DM:2型糖尿病;NC:正常对照ROI-06:inferior parietal gyrus;ROI-20:postcentral gyrus;ROI-27:superior parietal gyrus;ROI-29:supramarginal gyrus;T2DM:type 2 diabetes mellitus;NC:normal control
左侧(Left hemisphere)右侧(Right hemisphere)解剖学区域Anatomic region P值P值Pvalue ROI-06 8.48±1.35 9.52±0.86 1.45 0.24 8.98±1.T2DM NC F值F value Pvalue T2DM NC F值F value 93 8.23±1.23 0.97 0.33 15 10.94±1.39 9.16 0.01 ROI-20 6.33±0.76 6.80±0.94 1.22 0.28 6.15±0.83 6.92±0.87 3.94 0.06 ROI-27 10.48±1.11 11.52±1.34 2.14 0.16 9.86±0.87 10.58±1.15 2.54 0.12 ROI-29 7.43±1.03 8.28±1.06 1.76 0.20 7.54±0.
表5 2型糖尿病患者基线与随访水平顶叶皮层下白质体积比较 (±s,ml)Table 5 Comparison of subcortical white matter volume of parietal lobe in the patients with type 2 diabetes mellitus between baseline and follow-up levels(±s,ml)

表5 2型糖尿病患者基线与随访水平顶叶皮层下白质体积比较 (±s,ml)Table 5 Comparison of subcortical white matter volume of parietal lobe in the patients with type 2 diabetes mellitus between baseline and follow-up levels(±s,ml)
左侧(Left hemisphere)右侧(Right hemisphere)解剖学区域Anatomic region t值P值t值P值Pvalue ROI-06 8.63±1.51 8.75±2.01 -0.38 0.72 9.18±1基线Baseline随访Follow-up t value Pvalue基线Baseline随访Follow-up t value.28 10.28±1.97 -2.55 0.03 ROI-20 6.52±0.80 6.48±0.90 0.40 0.70 6.34±0.77 6.44±0.79 -1.31 0.22 ROI-27 10.61±1.12 10.79±1.57 -0.56 0.59 10.05±0.85 10.35±1.65 -1.03 0.33 ROI-29 7.66±0.92 7.70±0.89 -0.15 0.88 7.72±0.83 7.72±1.04 0.02 0.99
表6 2型糖尿病患者与对照组枕叶各脑区皮层下白质体积比较 (±s,ml)Table 6 Comparison of subcortical white matter volume of occipital lobe between patients with type 2 diabetes mellitus and normal controls(x-± s,ml)

表6 2型糖尿病患者与对照组枕叶各脑区皮层下白质体积比较 (±s,ml)Table 6 Comparison of subcortical white matter volume of occipital lobe between patients with type 2 diabetes mellitus and normal controls(x-± s,ml)
ROI-03:楔叶;ROI-09:枕外侧回;ROI-11:舌回;ROI-19:距状旁回;ROI-23:楔前叶ROI-03:cuneus;ROI-09:latera loccipital gyrus;ROI-11:lingual gyrus;ROI-19:pericalcarine gyrus;ROI-23:precuneus
左侧(Left hemisphere)右侧(Right hemisphere)解剖学区域Anatomic region P值P值Pvalue ROI-03 2.03±0.47 2.19±0.42 0.22 0.64 2.06±0.T2DM NC F值F value Pvalue T2DM NC F值F value 01 9.39±1.22 1.12 0.30 48 2.48±0.46 2.89 0.10 ROI-09 7.83±1.28 8.30±1.42 0.50 0.49 7.86±1.45 8.27±1.18 0.09 0.77 ROI-11 4.86±0.94 5.32±1.18 0.02 0.88 5.14±1.06 5.76±1.22 0.46 0.50 ROI-19 2.75±0.82 2.98±0.57 0.29 0.59 3.00±0.85 3.39±0.69 0.28 0.60 ROI-23 7.86±0.93 8.76±1.28 3.15 0.09 8.78±1.
表7 2型糖尿病患者基线及随访水平枕叶皮层下白质体积比较 (±s,ml)Table 7 Comparison of subcortical white matter volume of occipital lobe in patients with type 2 diabetes mellitus between baseline and follow-up levels(±s,ml)

表7 2型糖尿病患者基线及随访水平枕叶皮层下白质体积比较 (±s,ml)Table 7 Comparison of subcortical white matter volume of occipital lobe in patients with type 2 diabetes mellitus between baseline and follow-up levels(±s,ml)
左侧(Left hemisphere)右侧(Right hemisphere)解剖学区域Anatomic region t值P值t值P值Pvalue ROI-03 2.16±0.49 2.00±0.58 1.04 0.32 2.17±0.基线Baseline随访Follow-up t value Pvalue基线Baseline随访Follow-up t value 53 2.14±0.55 0.17 0.87 ROI-09 8.18±1.07 7.80±0.94 1.54 0.16 8.26±1.49 7.85±1.25 1.48 0.17 ROI-11 4.94±1.04 5.08±0.76 -0.78 0.45 5.35±1.15 5.77±1.19 -2.55 0.03 ROI-19 2.84±0.86 2.81±0.64 0.16 0.88 3.05±0.88 3.19±0.69 -0.83 0.42 ROI-23 8.04±0.95 7.93±0.92 0.67 0.52 9.08±0.88 8.86±0.87 3.79 0.00
颞叶各脑区皮层下白质体积 2型糖尿病患者右侧颞下回、颞中回及左侧颞横回皮层下白质较对照组显著减小 (P<0.05),其他脑区 (梭状回、颞上回及颞极)皮层下白质体积两组差异无统计学意义 (P>0.05)(表8)。随访水平2型糖尿病患者右侧颞下回、颞中回及左侧颞横回皮层下白质体积较基线水平显著增高 (P<0.05),其他颞叶脑区 (梭状回、颞上回及颞极)皮层下白质体积基线与随访水平差异无统计学意义 (P>0.05)(表9)。
边缘系统及岛叶皮层下白质体积 2型糖尿病患者边缘系统 (前扣带回吻侧、前扣带回尾侧、扣带回狭部、后扣带回、内嗅皮层、海马旁回)及岛叶皮层下白质体积两组差异无统计学意义 (P>0.05)(表10)。随访水平左侧内嗅皮层及右侧岛叶皮层下白质体积较基线水平显著增加 (P<0.05),其他脑区差异无统计学意义 (P>0.05)(表11)。
表8 2型糖尿病患者与对照组颞叶各脑区皮层下白质体积比较 (±s,ml)Table 8 Comparison of subcortical white matter volume of temporal lobe between patients with type 2 diabetes mellitus and normal controls(x-± s,ml)

表8 2型糖尿病患者与对照组颞叶各脑区皮层下白质体积比较 (±s,ml)Table 8 Comparison of subcortical white matter volume of temporal lobe between patients with type 2 diabetes mellitus and normal controls(x-± s,ml)
ROI-05:梭状回;ROI-07:颞下回;ROI-13:颞中回;ROI-28:颞上回;ROI-31:颞极;ROI-32:颞横回ROI-05:fusiform gyrus;ROI-07:inferior temporal gyrus;ROI-13:middle temporal gyrus;ROI-28:superior temporal gyrus;ROI-31:temporal pole;ROI-32:transverse temporal gyrus
左侧(Left hemisphere)右侧(Right hemisphere)解剖学区域Anatomic region P值P值Pvalue ROI-05 5.53±0.75 5.95±0.79 0.47 0.50 5.03±0.T2DM NC F值F value Pvalue T2DM NC F值F value 11 0.63±0.16 1.31 0.26 97 5.93±1.00 1.66 0.21 ROI-07 5.06±0.94 5.52±0.78 0.41 0.53 4.09±0.60 5.01±0.52 8.94 0.01 ROI-13 4.23±0.95 4.50±0.54 0.11 0.74 4.68±0.75 5.49±0.79 4.10 0.05 ROI-28 6.41±0.90 7.02±0.82 1.99 0.17 5.89±0.83 6.44±0.78 3.13 0.09 ROI-31 0.63±0.09 0.62±0.10 0.87 0.36 0.62±0.19 0.68±0.25 0.16 0.69 ROI-32 0.76±0.13 0.92±0.16 9.38 0.01 0.60±0.
表9 2型糖尿病患者基线与随访水平颞叶皮层下白质体积比较 (±s,ml)Table 9 Comparison of subcortical white matter volume of temporal lobe in the patients with type 2 diabetes mellitus between baseline and follow-up levels(±s,ml)

表9 2型糖尿病患者基线与随访水平颞叶皮层下白质体积比较 (±s,ml)Table 9 Comparison of subcortical white matter volume of temporal lobe in the patients with type 2 diabetes mellitus between baseline and follow-up levels(±s,ml)
左侧(Left hemisphere)右侧(Right hemisphere)解剖学区域Anatomic region t值P值t值P值Pvalue ROI-05 5.63±0.77 5.78±0.97 -0.78 0.45 5.20±1基线Baseline随访Follow-up t value Pvalue基线Baseline随访Follwo-up t value.11 5.71±1.42 -2.40 0.04 ROI-07 5.22±0.92 5.53±1.36 -1.20 0.26 4.16±0.57 4.79±1.08 -2.75 0.02 ROI-13 4.38±1.00 4.74±1.48 -2.06 0.07 4.88±0.80 5.21±1.08 -2.10 0.06 ROI-28 6.61±0.84 6.72±1.11 -0.89 0.39 6.04±0.83 6.08±0.91 -0.36 0.73 ROI-31 0.63±0.08 0.72±0.17 -2.47 0.03 0.65±0.21 0.65±0.15 -0.00 1.00 ROI-32 0.78±0.13 0.74±0.14 1.16 0.28 0.60±0.10 0.59±0.14 0.26 0.80
表10 2型糖尿病患者与对照边缘系统及岛叶皮层下白质体积比较 (±s,ml)Table 10 Comparison of subcortical white matter volume of limbic system between patients with type 2 diabetes mellitus and normal controls(x-± s,ml)
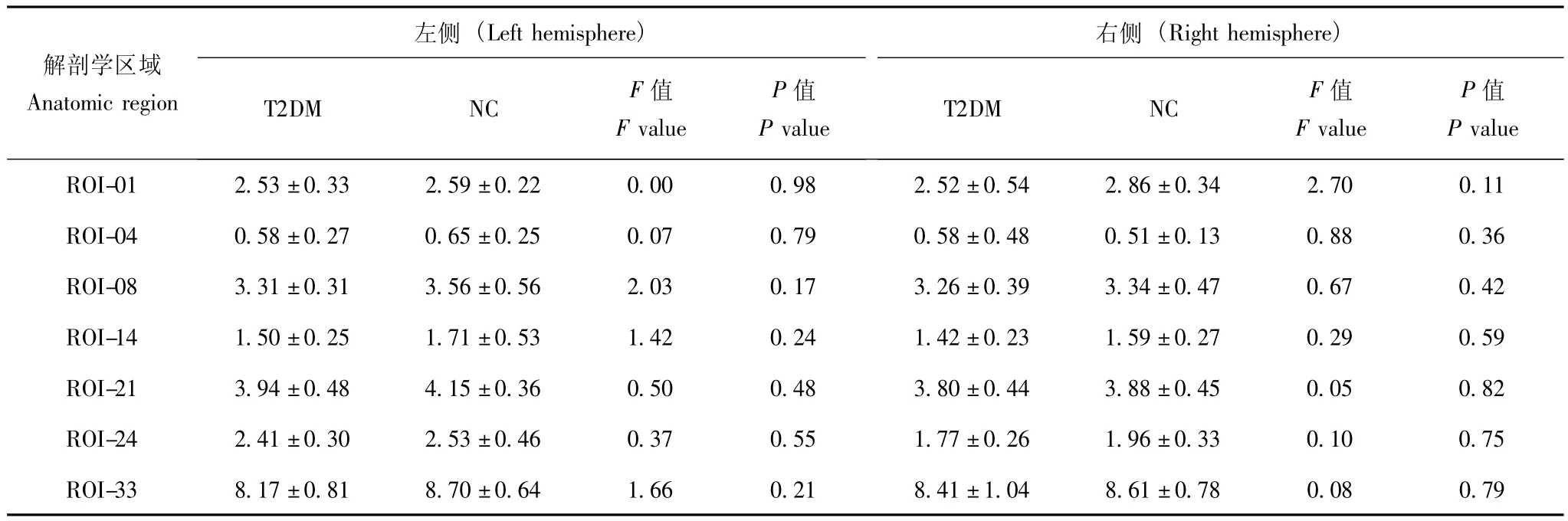
表10 2型糖尿病患者与对照边缘系统及岛叶皮层下白质体积比较 (±s,ml)Table 10 Comparison of subcortical white matter volume of limbic system between patients with type 2 diabetes mellitus and normal controls(x-± s,ml)
ROI-01:前扣带回尾侧;ROI-04:内嗅皮层;ROI-08:扣带回狭部;ROI-14:海马旁回;ROI-21:后扣带回;ROI-24:前扣带回吻侧;ROI-33:岛叶ROI-01:caudal anterior cingulate gyrus;ROI-04:entorhinal cortex;ROI-08:isthmus cingulate gyrus;ROI-14:parahippocampal gyrus;ROI-21:posterior cingulate gyrus;ROI-24:rostral anterior cingulate gyrus;ROI-33:insular lobe
左侧(Left hemisphere)右侧(Right hemisphere)解剖学区域Anatomic region P值P值Pvalue ROI-01 2.53±0.33 2.59±0.22 0.00 0.98 2.52±0.T2DM NC F值F value Pvalue T2DM NC F值F value 04 8.61±0.78 0.08 0.79 54 2.86±0.34 2.70 0.11 ROI-04 0.58±0.27 0.65±0.25 0.07 0.79 0.58±0.48 0.51±0.13 0.88 0.36 ROI-08 3.31±0.31 3.56±0.56 2.03 0.17 3.26±0.39 3.34±0.47 0.67 0.42 ROI-14 1.50±0.25 1.71±0.53 1.42 0.24 1.42±0.23 1.59±0.27 0.29 0.59 ROI-21 3.94±0.48 4.15±0.36 0.50 0.48 3.80±0.44 3.88±0.45 0.05 0.82 ROI-24 2.41±0.30 2.53±0.46 0.37 0.55 1.77±0.26 1.96±0.33 0.10 0.75 ROI-33 8.17±0.81 8.70±0.64 1.66 0.21 8.41±1.
胼胝体体积 2型糖尿病患者胼胝体各部 (后部、中后部、中央部、中前部、前部)及胼胝体总体积与对照组相比呈下降趋势,但差异无统计学意义 (P>0.05)(表12)。胰岛素治疗1年后,2型糖尿病患者胼胝体各部及总体均小于治疗前水平,但仅中后部体积差异具有统计学意义 (P<0.05)(表13)。
讨 论
糖尿病是一种常见的以慢性高血糖为特征的代谢性疾病,可导致进行性的终末器官损害,包括心血管系统、肾脏、眼及周围和中枢神经系统。对于糖尿病的中枢神经系统损害,通常表现为认知功能的下降[1]。纵向研究结果表明2型糖尿病患者与一般人群相比有较大发展为认知功能损害的风险[6]。
脑影像学及影像分析技术的发展为探索糖尿病脑的变化提供了契机。基于传统的磁共振影像,2型糖尿病患者的某些脑区可以看到脑萎缩改变,在T2-FLAIR上可以观察到明显脑白质病变 (呈高信号)[7]。一个系统综述[8]采用分级 (rating scales)[9]的方法研究表面2型糖尿病患者与脑萎缩之间有一定的相关性。一个基于人群的队列研究表明2型糖尿病患者会出现脑室的增大[10],另外也有研究表明2型糖尿病患者会出现颞叶的萎缩[11]。但是对于无明显脑萎缩的2型糖尿病患者,采用分级的方法很难观察到脑部细微结构的变化。
表11 2型糖尿病患者基线与随访水平边缘系统及岛叶皮层下白质体积比较 (±s,ml)Table 11 Comparison of subcortical white matter volume of limbic system in the patients with type 2 diabetes mellitus between baseline and follow-up levels(±s,ml)

表11 2型糖尿病患者基线与随访水平边缘系统及岛叶皮层下白质体积比较 (±s,ml)Table 11 Comparison of subcortical white matter volume of limbic system in the patients with type 2 diabetes mellitus between baseline and follow-up levels(±s,ml)
左侧(Left hemisphere)右侧(Right hemisphere)解剖学区域Anatomic region t值P值t值P值Pvalue ROI-01 2.57±0.28 2.57±0.51 -0.01 1.00 2.61±0基线Baseline随访Follow-up t value Pvalue基线Baseline随访Follow-up t value.63 2.60±0.58 0.19 0.86 ROI-04 0.57±0.28 0.69±0.23 -2.33 0.04 0.62±0.56 0.60±0.19 0.15 0.88 ROI-08 3.30±0.31 3.25±0.32 0.81 0.44 3.30±0.41 3.16±0.45 1.57 0.15 ROI-14 1.48±0.27 1.59±0.26 -1.77 0.11 1.48±0.25 1.52±0.28 -0.85 0.42 ROI-21 4.13±0.38 4.08±0.34 0.73 0.48 3.91±0.39 3.93±0.47 -0.21 0.84 ROI-24 2.55±0.25 2.30±0.49 1.75 0.11 1.78±0.25 1.88±0.28 -1.55 0.15 ROI-33 8.43±0.66 8.75±1.32 -0.97 0.36 8.70±1.03 9.39±1.46 -2.41 0.04
表12 2型糖尿病患者与对照胼胝体体积比较 (±s,ml)Table 12 Comparison of corpus callosum volume between patients with type 2 diabetes mellitus and normal controls(x-± s,ml)

表12 2型糖尿病患者与对照胼胝体体积比较 (±s,ml)Table 12 Comparison of corpus callosum volume between patients with type 2 diabetes mellitus and normal controls(x-± s,ml)
CC:胼胝体CC:corpus callosum
总体积Total volume T2DM 0.92±0.11 0.41±0.10 0.45±0.11 0.43±0.13组别Group 后部CC Posterior CC中后部CC Middle posterior CC中央部CC Central CC中前部CC Middle anterior CC前部CC Anterior CC 0.79±0.09 3.00±0.42 NC 0.98±0.13 0.45±0.07 0.50±0.11 0.47±0.13 0.88±0.14 3.28±0.36 F值F value 0.24 0.25 0.44 0.45 0.08 0.12 value 1.44 1.37 0.61 0.59 3.30 2.65 P值P
表13 2型糖尿病患者基线与随访水平胼胝体体积比较 (±s,ml)Table 13 Comparison of corpus callosum volume in the patients with type 2 diabetes mellitus between baseline and follow-up levels(x-± s,ml)

表13 2型糖尿病患者基线与随访水平胼胝体体积比较 (±s,ml)Table 13 Comparison of corpus callosum volume in the patients with type 2 diabetes mellitus between baseline and follow-up levels(x-± s,ml)
总体积Total volume基线Baseline 0.93±0.13 0.45±0.09 0.49±0.11 0.45时间Time 后部CC Posterior CC中后部CC Middle posterior CC中央部CC Central CC中前部CC Middle anterior CC前部CC Anterior CC±0.15 0.79±0.09 3.11±0.45随访 Follow-up 0.90±0.19 0.41±0.09 0.45±0.17 0.42±0.13 0.73±0.18 2.91±0.67 t值t value 1.03 2.56 1.11 0.97 1.29 1.55 P值P value 0.33 0.03 0.29 0.35 0.23 0.15
有研究采用基于体素的VBM对2型糖尿病患者及正常对照进行了脑形态学的初步分析,结果表明2型糖尿病患者主要表现为右侧颞叶灰质及白质的萎缩[2]。对于灰质的进一步详细分析,笔者采用基于表面的皮层厚度分析的方法进行评估,而对于脑白质的萎缩的评估,VBM仅仅是从体素水平进行全脑范围的评估,其基本原理是对分割后的脑白质进行平滑,然后采用广义线性模型进行统计学分析,最后生成统计参数图,实际上一种统计分析的理念,其阳性激活簇代表体积一致性减低的脑区,具有敏感、客观、可重复性强等优点。VBM的高敏感性对于其阳性病变的检出及脑白质损伤的早期筛查具有一定的优势,但是随着敏感性的提高带来的弊端就是假阳性的提高。因此,本研究采用先进的皮层划分及自动分割技术[5],将脑部白质划分为33个脑区,并计算各脑区皮层下白质体积,从宏观上观察各个脑区的体积变化以及胰岛素治疗1年后的皮层下脑白质体积的变化。
对2型糖尿病患者双侧大脑皮层下白质总体积及全脑皮层下白质总体积进行分析显示2型糖尿病患者的皮层下白质体积呈减低趋势,两组之间差异无统计学意义。经胰岛素治疗1年后,基线与随访水平,大脑皮层下白质总体积两组之间差异无统计学意义。因此,从全脑角度分析2型糖尿病患者与正常对照之间,以及胰岛素治疗前后皮层下白质体积的变化可能存在一定的混淆因素,所以对各个脑区皮层下白质体积的分析是必要的。
对于33个脑区皮层下白质体积的分析,主要划分为6个部分进行,分别包括额叶、顶叶、枕叶、颞叶及边缘系统和岛叶。对于额叶区,2型糖尿病患者主要表现为双侧额中回尾侧、额叶岛盖部的体积减小,这与VBM的结果在一定程度上是不符合的,主要原因是两者采用的分割方法及对结果的分析方法有关。前期VBM采用DARTEL(the diffeomorphic anatomical registration through exponentiated lie algebra)方法进行配准及分割,对于阳性区域的检出,主要是采用基于体素的统计学方法进行统计。而本研究采用的是对脑结构像进行强度配准 (intensity normalization),拓扑校正[12]、皮层划分[13]、Voronoi diagram 重建及各脑区皮层下白质标记,并对皮层下低信号区域 (T1WI低信号)进行校正[14],同时以颅腔总体积[15]作为协变量对各个脑区皮层下白质体积进行校正,最终得到各个脑区皮层下白质体积。对于计算出来的各个脑区的皮层下白质体积采用协方差的方法进行分析,年龄及BMI作为协变量,相对于VBM的基于体素的统计,这里是从宏观上进行分析。因此,皮层下白质体积的分析是对VBM分析的有益补充,两者可以相互结合进行分析及评价。
同时,本研究对11例接受胰岛素治疗的患者进行皮层下白质体积的分析,结果提示左侧内侧额叶眶回及右侧额中回吻侧皮层下白质体积较对照组增加,而双侧中央旁回及右侧额上回皮层下白质体积较对照组减少,表明不同的脑区对于胰岛素的作用是不同的,额叶局部皮层下白质既有膨胀区域,又有萎缩区域,这种选择性皮层下膨胀或萎缩 (或负性膨胀)是否和胰岛素的受体分布有关尚有待于进一步的研究证实。前期纵向VBM分析提示双侧大脑白质无体积减小区域,体积增加脑区主要为左侧中央前回皮层下白质及右侧角回皮层下白质,这两种结果的不一致性可能与前者是体素水平分析,后者是脑区水平分析有关。因此,对于VBM的结果及皮层下白质体积的测量结果要谨慎分析和解释。
顶叶皮层下白质区域共分为顶上回、顶下回、中央后回及缘上回4个脑区,横向分析证实仅右侧顶下回皮层下白质体积较正常对照显著减小,纵向分析证实仅右侧顶下回皮层下白质体积显著增加。顶下回皮层下白质体积的横向及纵向变化表明2型糖尿病患者顶叶局部脑白质的萎缩具有一定的特异性,胰岛素可以对局部的脑萎缩具有一定的恢复效应,但是这种膨胀效应尚有待于大样本长期的追踪,本研究仅是胰岛素治疗1年后的表现。
双侧枕叶皮层下白质体积分析提示2型糖尿病患者与正常对照组比较差异无统计学意义,提示枕叶不是2型糖尿病患者脑部白质受损的特异性脑区。但胰岛素治疗后右侧舌回皮层下白质体积增加,右侧楔前叶皮层下白质体积减小,对于局部皮层下白质体积的增加可能与局部血流量灌注增加有关,而局部脑白质体积的减小的解释尚有待于进一步的研究,也许这种减小是一过性的,也许这种局部皮层下白质体积的减小可以看做是一种短暂的负性膨胀,本研究仅是发现了这一现象,具体机制尚有待于进一步的研究证实。
前期的VBM研究结果证实右侧颞叶灰质及白质体积萎缩是2型糖尿病患者脑部损害相对较为特异的一种表现[2]。本研究也证实右侧颞下回、颞中回及左侧颞横回皮层下白质体积较对照组显著减小,这在一定程度上与前期研究结果相符。同时,胰岛素治疗的纵向研究证实右侧颞下回、颞中回及左侧颞横回皮层下白质体积随访较基线水平显著增加。因此,可以认为胰岛素对于2型糖尿病脑部损害的恢复具有一定的作用[16-18],右侧颞叶可以作为2型糖尿病脑部损害的评估及治疗疗效判定的一个相对特异的脑区。
横向皮层下白质体积分析提示2型糖尿病患者边缘系统及岛叶皮层下白质体积与正常对照差异无统计学意义,但胰岛素治疗后左侧内嗅皮层及右侧岛叶皮层下白质体积显著增加。此研究结果表明边缘系统及岛叶皮层下白质并非2型糖尿病脑部损害的特异性作用靶点,但胰岛素对左侧内嗅皮层及右侧岛叶的膨胀作用,除了可能与改善局部血流灌注有关外,可能与改善2型糖尿病患者脑部食物奖赏系统[19]有一定的关系,但尚有待于进一步的研究证实。
胼胝体是大脑主要的连合纤维,位于大脑纵裂池底,由前向后依次分为嘴部、膝部、干部和压部,其纤维束主要起自大脑皮层第三层的大锥体神经元细胞[20-21],向两半球内部前、后、左、右辐射,广泛联系额、顶、枕及颞叶。因此,皮层的萎缩可导致胼胝体的萎缩。前期研究显示2型糖尿病患者与正常对照相比皮层多个脑区存在体积减小、大脑皮层厚度变薄,因此,研究2型糖尿病患者的胼胝体体积是必要的。本研究根据图2将胼胝体分为后部、中后部、中央部、中前部及前部进行体积测量。横向研究显示,胼胝体各部及总体积均呈减低趋势,分析可能与2型糖尿病患者脑部皮层萎缩有一定关系,本研究入组患者均无认知功能障碍,胼胝体的轻度萎缩可能与2型糖尿病患者的脑部损害程度有一定的关系,在未来的研究中,需要进一步加大样本量,研究继发不同认知功能损害的2型糖尿病患者的胼胝体受累情况。胼胝体的体积变化是否可以作为2型糖尿病患者认知功能损害的特异性部位尚有待于进一步的研究。
纵向研究显示胰岛素治疗1年后胼胝体后部、中央部、中前部、前部及总体积呈增加趋势,中央部体积显著减小,表明胰岛素对胼胝体的损害并不具有一定的保护作用,这种胼胝体体积减小的模式也许与胼胝体上胰岛素作用的靶点相对较少有一定的关系,但需长期的、大样本的病例观察。
本研究为2型糖尿病患者活体皮层下白质体积研究,其局限性主要包括:(1)缺少病理学的证据;(2)样本量相对较少; (3)胰岛素治疗观察时间为1年,需要进一步增加追踪时间;(4)本组入组病例均为无继发认知功能损害的糖尿病患者,未来需要对伴有认知功能障碍的糖尿病患者进行进一步研究。
综上,2型糖尿病患者脑部损害可表现为脑部多个脑区的皮层下白质体积的减少,胰岛素治疗对于白质体积的恢复具有一定的帮助。
[1]Cukierman T,Gerstein HC,Williamson JD.Cognitive decline and dementia in diabetes-systematic overview of prospective observational studies [J].Diabetologia,2005,48(12):2460-2469.
[2]Chen Z,Li L,Sun J,et al.Mapping the brain in type Ⅱdiabetes:voxel-based morphometry using DARTEL [J].Eur J Radiol,2012,81(8):1870-1876.
[3]Manolio TA,Kronmal RA,Burke GL,et al.Magnetic resonance abnormalities and cardiovascular disease in older adults.The Cardiovascular Health Study [J].Stroke,1994,25(2):318-327.
[4]Galea M,Woodward M.Mini-mental state examination(MMSE)[J].Aust J Physiother,2005,51(3):198.
[5]Salat DH,Greve DN,Pacheco JL,et al.Regional white matter volume differences in nondemented aging and Alzheimer’s disease[J].Neuroimage,2009,44(4):1247-1258.
[6]Allen KV,Frier BM,Strachan MW.The relationship between type 2 diabetes and cognitive dysfunction:longitudinal studies and their methodological limitations [J].Eur J Pharmacol,2004,490(1-3):169-175.
[7]Manschot SM,Brands AM,van der Grond J,et al.Brain magnetic resonance imaging correlates of impaired cognition in patients with type 2 diabetes [J].Diabetes,2006,55(4):1106-1113.
[8]van Harten B,de Leeuw FE,Weinstein HC,et al.Brain imaging in patients with diabetes:a systematic review [J].Diabetes Care,2006,29(11):2539-2548.
[9]Scheltens P,Pasquier F,Weerts JG,et al.Qualitative assessment of cerebral atrophy on MRI:inter-and intra-observer reproducibility in dementia and normal aging [J].Eur Neurol,1997,37(2):95-99.
[10]Knopman DS,Mosley TH,Catellier DJ,et al.Cardiovascular risk factors and cerebral atrophy in a middle-aged cohort[J].Neurology,2005,65(6):876-881.
[11]Gold SM,Dziobek I,Sweat V,et al.Hippocampal damage and memory impairments as possible early brain complications of type 2 diabetes[J].Diabetologia,2007,50(4):711-719.
[12]Fischl B,Liu A,Dale A,et al.Automated manifold surgery:constructing geometrically accurate andtopologically correct models of the human cerebral cortex [J].IEEE Trans Med Imaging,2001,20(1):70-80.
[13]Desikan RS,Segonne F,Fischl B,et al.An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest[J].Neuroimage,2006,31(3):968-980.
[14]Fischl B,Salat DH,Busa E,et al.Whole brain segmentation:automated labeling of neuroanatomical structures in the human brain [J].Neuron,2002,33(3):341-355.
[15]Buckner RL,Head D,Parker J,et al.A unified approach for morphometric and functional data analysis in young,old,and demented adults using automated atlas-based head size normalization:reliability and validation against manual measurement of total intracranial volume [J].Neuroimage,2004,23(2):724-738.
[16]Zhao W,Chen H,Xu H,et al.Brain insulin receptors and spatial memory.Correlated changes in gene expression,tyrosine phosphorylation,and signaling molecules in the hippocampus of water maze trained rats[J].J Biol Chem,1999,274(49):34893-34902.
[17]Zhao WQ,Alkon DL.Role of insulin and insulin receptor in learning and memory [J].Mol Cell Endocrinol,2001,177(1-2):125-134.
[18]Dou JT,Chen M,Dufour F,et al.Insulin receptor signaling in long-term memory consolidation following spatial learning[J].Learn Mem,2005,12(6):646-655.
[19]Appelhans BM,Whited MC,Schneider KL,et al.Time to abandon the notion of personal choice in dietary counseling for obesity? [J].J Am Diet Assoc,2011,111(8):1130-1136.
[20]Glickstein M,Whitteridge D.Degeneration of layerⅢpyramidal cells in area 18 following destruction of callosal input[J].Brain Res,1976,104(1):148-151.
[21]Jacobson S,Trojanowski JQ.Prefrontal granular cortex of the rhesus monkey.Ⅱ.Interhemispheric cortical afferents[J].Brain Res,1977,132(2):235-246.

