在肿瘤细胞模型中联合应用磷脂酰肌醇3激酶/蛋白酶B通路抑制剂BEZ235和细胞外调解蛋白激酶/丝裂原活化蛋白激酶通路抑制剂U0126的效果
陈欣欣,张 舒,石玉镯
1中国医学科学院 北京协和医学院 基础学院生理系,北京100005
2中国医学科学院 北京协和医学院 北京协和医院皮肤科,北京100730
磷酸酶和张力蛋白同源物 (phosphatase and tensin homolog,PTEN)是重要的肿瘤抑制因子,在多种肿瘤中均有较高比例的PTEN缺失或突变,在侵袭性强及预后较差的肿瘤中尤为多见[1]。PTEN可以拮抗磷脂酰肌醇3激酶 (phosphatidyl inositol 3-kinase,PI3K)的作用,因而其失活可引起膜受体酪氨酸激酶 (receptor tyrosine kinase,RTK)/PI3K/蛋白酶 B(protein kinase B,PKB or AKT)/雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)通路的活化,从而使细胞生长和增殖失控而导致肿瘤[2]。但是,应用mTOR通路抑制剂在临床上对肿瘤的治疗效果并不十分理想。因为mTOR通路抑制剂对在抑制mTOR的同时解除mTOR对RTK/PI3K/AKT的负反馈抑制作用从而活化了 AKT[3]。此外,有报道 mTOR抑制剂会削弱mTOR对细胞外调解蛋白激酶 (extracellular regulated protein kinase,ERK)/丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK)信号通路的抑制作用[4]。ERK/MAPK 通路和 RTK/PI3K/AKT/mTOR通路一样,均是典型的受体酪氨酸激酶调节通路,与肿瘤的发生发展密切相关[5-6]。因此,联合抑制两条通路的靶向治疗具有较好的前景[4,7-8]。BEZ235 及U0126分别为PI3K/AKT通路及ERK通路的抑制剂,其中BEZ235不同于其他PI3K/AKT通路抑制剂,可以同时抑制 PI3K及 mTOR两个靶点[9]。本研究以PTEN缺失的小鼠胚胎成纤维 (mouse embryonic fibroblast,MEF)细胞系作为研究模型,探讨联合使用两种药物抑制PTEN基因纯合缺失 (PTEN-/-)细胞增殖的效果。
材料和方法
材料 PTEN纯合缺失的小鼠胚胎成纤维母细胞(PTEN-/-MEF细胞)由美国布里格姆妇女医院Kwiatkowski教授实验室经由PTEN-/-小鼠的胚胎细胞中建立,已成系[3,10]。抗体:ERK(Santa Cruz 公司)、pERK(Cell Signaling公司)、pAKT(Cell Signaling公司)、AKT(Santa Cruz公司)、β-Actin(Santa Cruz公司)、pS6(Cell Signaling公司)、S6(Cell Signaling公司)、二抗 (抗兔)(Santa Cruz公司)。药品:NVP-BEZ235(Selleck公司)、U0126(Cell Signaling公司)。
药品配制 NVP-BEZ235:溶解于100%二甲基亚砜中,制备成1 mmol/L的浓度,储备于-20℃;U0126:溶解于100% 二甲基亚砜中,制备成10 mmol/L的浓度,储备于-20℃。
MTT法测定细胞的半数抑制浓度 (half maximal inhibitory concentration,IC50)和药物相互作用 取对数生长期PTEN-/-MEF细胞传至96孔板,每孔2500个细胞。孵育6 h,待细胞贴壁后,换液,按照不同的药物浓度加药。孵育培养48 h,换新鲜的培养基(血清浓度5%),并加入5 g/L MTT液20 μl,继续培养。4 h后弃上清,加入二甲基亚砜200 μl,摇床上轻轻振荡10 min,待甲臜沉淀完全溶解后,酶标仪检测波长490nm处的光密度 (optical density,OD)值。细胞存活率=样品组OD值/对照组OD值×100%。
MTT法检测细胞的增殖曲线 取对数生长期PTEN-/-MEF细胞传至96孔板,每孔2500个细胞。孵育6 h,待细胞贴壁后,换液,加药。孵育培养一定的时间 (0、24、48、72 h)后,换新鲜的培养基(血清浓度5%),并加入5 g/L MTT液20 μl,继续培养4 h。弃上清,加入二甲基亚砜200 μl,摇床上轻轻振荡,待甲臜沉淀完全溶解后,酶标仪检测OD 490。分别得到4个时间点 (0、24、48、72 h)的对照组、BEZ235组、U0126组、BEZ235+U0126组的OD值,以对照组0 h时间点的OD值为100点,其他组的各个时间点的OD值都与之相比得到相应的数值,以此绘制细胞增殖曲线。
联合作用指数 (combination index,CI)值计算Chou-Talalay公式 (CI等于1表明两药之间以相加的方式相互作用,CI小于1表明两药之间以协同的方式相互作用,CI大于1表明两药之间以拮抗的方式相互作用)为:CI=CA,X/ICX,A+CB,X/ICX,B(CA,X和CB,X分别是联合用药达到X%的药效时,药物A和药物B的浓度;ICX,A和ICX,B分别是单独用药达到相同的药效时,药物A和药物B的浓度[11])。
Western blot检测药物在细胞中的作用 1×105个PTEN-/-MEF细胞接种于6孔板中,6 h细胞贴壁后,加入一定浓度的BEZ235或 (和)U0126,混匀,孵育24 h后收样,得到细胞总蛋白裂解液,经SDSPAGE胶电泳,转膜,一抗、二抗孵育后,曝光、显影,得到实验结果。
统计学处理 两组数据间差异用Graphpad Prism软件进行t检验,P<0.05为差异具有统计学意义。
结 果
BEZ235及 U0126加入 PTEN-/-MEF细胞后对RTK/PI3K/AKT/mTOR通路及ERK/MAPK通路活性的效果 首先在PTEN-/-MEF细胞中对BEZ235及U0126对RTK/PI3K/AKT/mTOR及ERK/MAPK通路的抑制作用进行验证。AKT及核糖体40S小亚基S6分别位于通路中PI3K及mTOR的下游,其磷酸化形式pAKT、pS6可分别用于标识两蛋白的活化情况,而pERK则可代表ERK/MAPK通路的活化情况。单独加入100 μmol/L U0126时,pERK的水平显著下降,pS6水平亦有降低;单独加入100 nmol/L BEZ235时,pAKT及pS6显著降低,pERK水平也略有降低。联合应用BEZ235与 U0126,pAKT及 pS6受抑制效果与单用BEZ235基本相同,pERK受抑制水平略强于单独使用U0126。Western blot结果显示两药联合与使用单药效果差异无统计学意义 (图1)。
BEZ235及U0126在PTEN-/-MEF细胞中IC50的测定结果 为研究BEZ235和U0126的作用效果,在PTEN-/-MEF细胞中应用MTT的方法,通过不同剂量的药物浓度作用,定量BEZ235及U0126的IC50。BEZ235及U0126均可抑制细胞的增殖,分别在6.257 nmol/L及22.85 μmol/L达到半数抑制效果,即在PTEN-/-MEF细胞中,BEZ235和U0126的IC50分别为6.257 nmol/L 及22.85 μmol/L(图2)。BEZ235 的浓度在60 nmol/L及以上时,对细胞的抑制作用趋于平稳。
体外细胞培养中联合应用BEZ235和U0126的效果 通过对药物相互作用矩阵实验的分析显示,当加入不同浓度 (0、10及 100 μmol/L)的 U0126后,BEZ235的IC50曲线逐渐上移 (数据处理时只算入待计药物的单独药效)(图3);从BEZ235曲线上读取其IC50值,显示在U0126的干预下,BEZ235的IC50值逐渐变大。为明确上述结果,进一步估算BEZ235和U0126相互作用的CI值。在不同的药物浓度下,BEZ235和U0126相互作用的 CI值均大于1。
单独使用BEZ235与联合应用BEZ235和U0126对抑制细胞增殖效果的比较 为进一步确定联合BEZ235和U0126用药对细胞增殖的影响,设计了不同浓度下两药联合的细胞增殖实验,应用MTT的方法,观察细胞增殖曲线。结果显示:加入不同浓度的BEZ 235和/或U0126时,BEZ235和U0126均抑制PTEN-/-MEF细胞的增殖,但两药物联合作用效果不及单独使用BEZ235(P<0.01)(图4)。
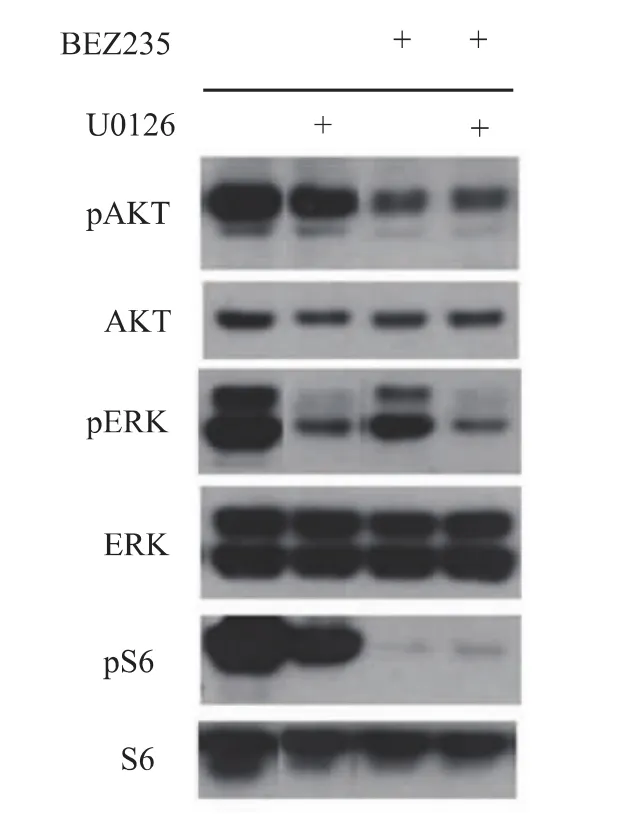
图1 单独和联合使用BEZ235、U0126对膜受体酪氨酸激酶/磷脂酰肌醇3激酶/蛋白酶B/雷帕霉素靶蛋白通路及细胞外调解蛋白激酶/丝裂原活化蛋白激酶通路的抑制作用Fig 1 The inhibitory effect of single and combinational usage BEZ235 and U1026 on receptor tyrosine kinase/phosphatidyl inositol-3-kinase/protein kinase B/mammalian target of rapamycin and extracellular regulated protein kinases/mitogen-activated protein kinases pathways
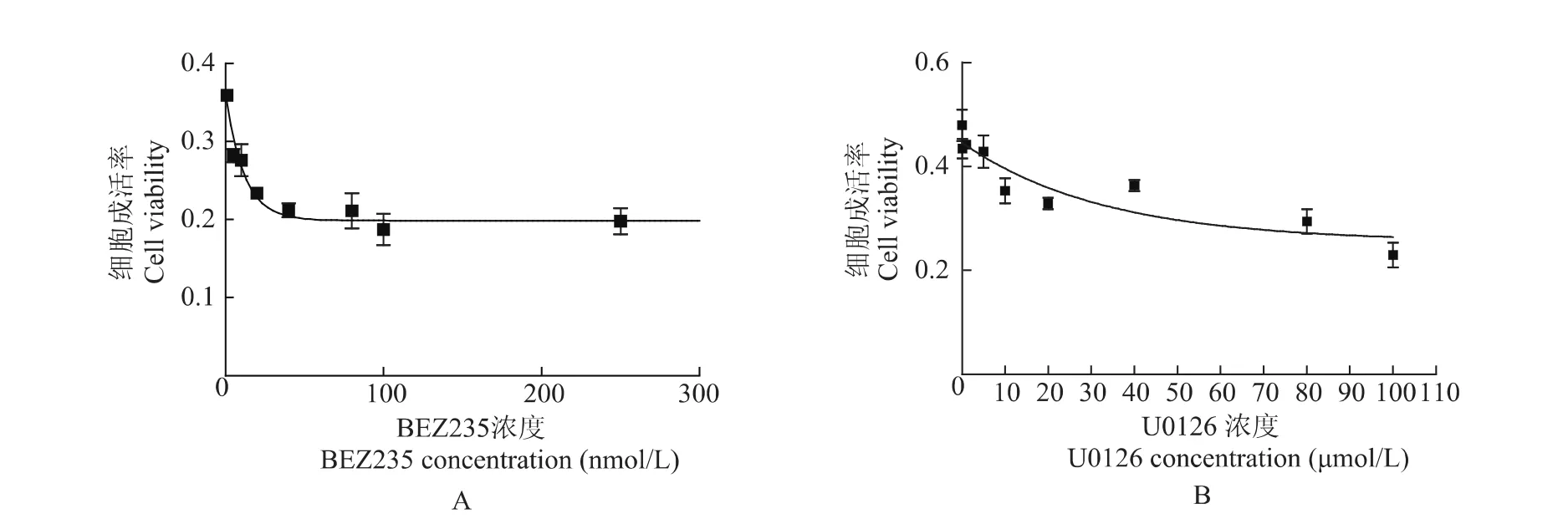
图2 PTEN缺失的小鼠胚胎成纤维细胞生存率随BEZ235(A)及U0126(B)药物浓度变化曲线Fig 2 The survival curves of PTEN null mouse embryonic fibroblast cells in response to the BEZ235(A)and U0126(B)treatment
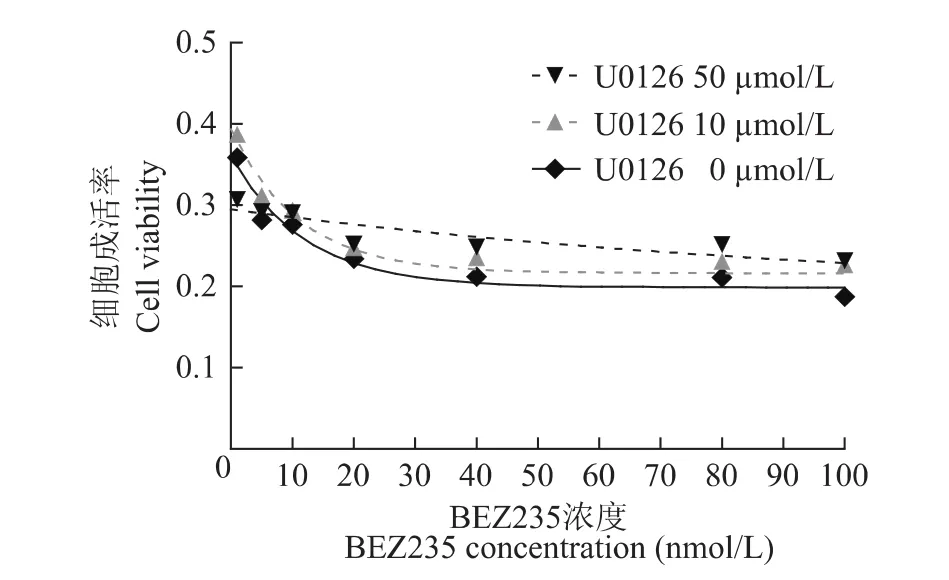
图3 不同浓度的U0126作用下,PTEN缺失的小鼠胚胎成纤维细胞生存率随BEZ235药物浓度变化曲线Fig 3 The survival curves of PTEN knock out MEF cells in response to the BEZ235 treatment at the presence of different concentrations of U0126
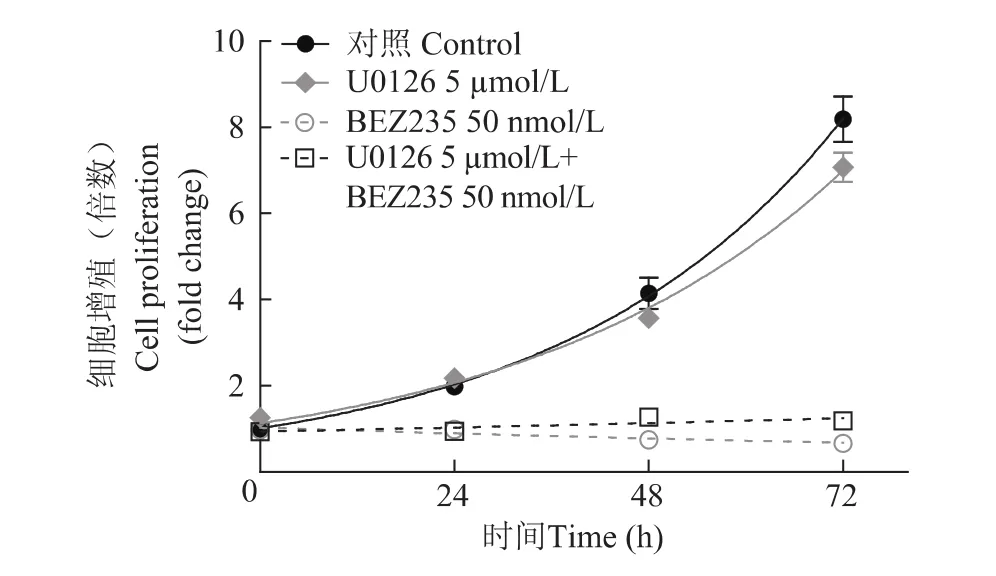
图4 PTEN缺失的小鼠胚胎成纤维细胞在单独或联合使用BEZ235和U0126处理后的增殖曲线Fig 4 The growth curves of PTEN null MEF cells under the single or combination treatment of BEZ235 and U0126
讨 论
肿瘤的发生是一个多步骤多阶段的过程,其中包括多个基因位点的突变和多个细胞信号通路的参与。因此针对某一细胞信号通路和肿瘤致病因子的肿瘤治疗策略可能被其他的信号通路的活化和肿瘤位点的突变所抵抗。这些理论基础及实验结果为联合抑制RTK/PI3K/AKT/mTOR信号通路及ERK/MAPK信号通路治疗肿瘤提供了依据。临床前期的实验中也已证明联合抑制mTOR通路及ERK/MAPK信号通路在PTEN缺失的前列腺肿瘤和细胞系中,协同抑制效果显著[4]。
为消除mTOR抑制后反馈性的ERK/MAPK信号通路活化,本研究应用ERK激酶促分裂原活化蛋白激酶激酶 (mitogen-activated protein kinase kinase,MEK)1/2的抑制剂U0126;而为消除mTOR抑制后反馈性的AKT活化,选择PI3K、mTOR双重抑制剂BEZ235,希望达到同时有效抑制两条通路的效果,从而更好地抑制肿瘤细胞增殖。
通过Western blot方法本研究检测了两种药物的抑制效果 (图1),结果表明,单独加入U0126时,pERK的水平显著下降,pS6水平亦降低,表明U0126在抑制MEK1/2的同时抑制了mTOR水平,提示ERK通路可以上调mTOR。这与文献[12]中的结果相吻合。而单独加入BEZ235时,pAKT及pS6显著降低,表明对PI3K及mTOR抑制有效。BEZ235同时抑制了pERK水平,因PI3K在ERK通路上游,抑制PI3K后,ERK通路活性降低,本研究的结果较好地验证了两药的作用效果。但Western blot结果提示,两药联合效果并未显著优于使用单药。
研究表明mTOR抑制剂Rapamycin和MEK抑制剂PD98059以相加方式抑制体外mTOR活化细胞的增殖[8]。笔者认为在PTEN-/-MEF细胞及PTEN突变的肿瘤中,BEZ235通过双重阻断RTK/PI3K/AKT/mTOR通路,和U0126联合作用可能达到更好的效果,呈协同方式作用。因此,本研究设计了通过两药物在不同的浓度梯度条件下相互作用的矩阵式实验,结果表明联合应用BEZ235和U0126后,在体外细胞培养中两者呈拮抗作用。考虑可能有以下原因:PTEN-/-MEF细胞中PTEN基因缺失,可能使得ERK/MAPK通路对抑制剂作用不敏感。Tang等[13]研究显示,PTEN缺失的Ishikawa细胞 (子宫内膜癌细胞系)与重新转染了PTEN基因的Ishikawa细胞 (PTEN-IK细胞)相比,表皮生长因子刺激后细胞增殖作用不显著。使用Wortmannin(PI3K抑制剂)或U0126抑制细胞增殖的效果不及PTEN-IK细胞。提示在PTEN缺失的情况下,细胞对PI3K通路及ERK通路抑制剂敏感性降低。本研究U0126的IC50值为22.85 μmol/L,远大于文献[14]中报道的 IC50值,也是 PTEN-/-细胞对 U0126不敏感的证据之一。而 BEZ235的IC50值与文献[15]报道相符,表明PTEN-/-细胞对BEZ235抑制敏感。联合用药对细胞增殖抑制效果不如单用BEZ235,表明与U0126联合使用时,可能由于通路间复杂的相互作用,使PTEN-/-细胞对BEZ235的敏感性同时降低。此外,两药化学结构中可能存在产生拮抗作用的位点,使两药共同作用时产生拮抗作用。这种情况下,更换ERK/MAPK抑制剂的种类后与BEZ235联合应用可能会达到更好的治疗效果。
综上,本研究在PTEN-/-MEF细胞系中联合应用PI3K、mTOR抑制剂BEZ235和ERK/MAPK通路抑制剂U0126时,两药作用方式呈拮抗作用,效果不及单独使用BEZ235。因此,笔者建议在 PTEN-/-细胞系中或PTEN突变的肿瘤中避免联合使用BEZ235与U0126,BEZ235单药即具有较好的抑制细胞增殖作用,可作为抗肿瘤治疗的有效药物。更换ERK/MAPK抑制剂与BEZ235联合应用可能会达到更好的治疗效果。
[1]Vivanco I,Sawyers CL.The phosphatidylinositol 3-kinase AKT pathway in human cancer[J].Nat Rev Cancer,2002,2(7):489-501.
[2]Knobbe CB,Lapin V,Suzuki A,et al.The roles of PTEN in development,physiology and tumorigenesis in mouse models:a tissue-by-tissue survey [J].Oncogene,2008,27(41):5398-5415.
[3]Zhang H,Bajraszewski N,Wu E,et al.PDGFRs are critical for PI3K/Akt activation and negatively regulated by mTOR[J].J Clin Invest,2007,117(3):730-738.
[4]Carracedo A,Baselga J,Pandolfi PP.Deconstructing feedback-signaling networks to improve anticancer therapy with mTORC1 inhibitors[J].Cell Cycle,2008,7(24):3805-3809.
[5]McCubrey JA,Steelman LS,Chappell WH,et al.Roles of the Raf/MEK/ERK pathway in cell growth,malignant transformation and drug resistance [J].Biochim Biophys Acta,2007,1773(8):1263-1284.
[6]McCubrey JA,Steelman LS,Franklin RA,et al.Targeting the RAF/MEK/ERK,PI3K/AKT and p53 pathways in hematopoietic drug resistance [J].Adv Enzyme Regul,2007,47:64-103.
[7]Chang JY,Sehgal SN,Bansbach CC.FK506 and rapamycin:novel pharmacological probes of the immune response[J].Trends Pharmacol Sci,1991,12(6):218-223.
[8]Mi R,Ma J,Zhang D,et al.Efficacy of combined inhibition of mTOR and ERK/MAPK pathways in treating a tuberous sclerosis complex cell model[J].J Genet Genomics,2009,36(6):355-361.
[9]Maira SM,Stauffer F,Brueggen J,et al.Identification and characterization of NVP-BEZ235,a new orally available dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor with potent in vivo antitumor activity [J].Mol Cancer Ther,2008,7(7):1851-1863.
[10]Ma J,Meng Y,Kwiatkowski DJ,et al.Mammalian target of rapamycin regulates murine and human cell differentiation through STAT3/p63/Jagged/Notch cascade [J].J Clin Invest,2010,120(1):103-114.
[11]Zhao L,Wientjes MG,Au JL.Evaluation of combination chemotherapy:integration of nonlinear regression,curve shift,isobologram,and combination index analyses[J].Clin Cancer Res,2004,10(23):7994-8004.
[12]Ma L,Chen Z,Erdjument-Bromage H,et al.Phosphorylation and functional inactivation of TSC2 by Erk implications for tuberous sclerosis and cancer pathogenesis [J].Cell,2005,121(2):179-193.
[13]Tang LL,Yokoyama Y,Wan X,et al.PTEN sensitizes epidermal growth factor-mediated proliferation in endometrial carcinoma cells[J].Oncol Rep,2006,15(4):855-859.
[14]Davies SP,Reddy H,Caivano M,et al.Specificity and mechanism of action of some commonly used protein kinase inhibitors[J].Biochem J,2000,351(Pt 1):95-105.
[15]Schnell CR,Stauffer F,Allegrinip R,et al.Effects of the dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor NVP-BEZ235 on the tumor vasculature:implications for clinical imaging [J].Cancer Res,2008,68(16):6598-6607.

