植物血凝素-ECM830细胞融合法融合黑色素瘤细胞
米蕊芳,刘福生,金贵善
1首都医科大学附属北京天坛医院北京市神经外科研究所脑肿瘤研究中心,北京100050
2中国医学科学院 北京协和医学院 基础医学研究所病理学系,北京100005
瘤细胞中常见多倍体及瘤巨细胞的现象,并且与疾病的预后呈负相关,如乳腺癌[1]和黑色素瘤[2]等,其中的原因之一是细胞融合所引起的[3]。细胞融合也是细胞学及肿瘤领域的重要研究手段。在肿瘤恶性度研究方面,多种肿瘤细胞包括黑色素瘤细胞与正常的成纤维细胞融合后会出现瘤细胞恶性度降低的现象[4];在肿瘤器官特异性转移研究方面,特异性转移到肺脏的瘤细胞以及特异性转移到骨组织的瘤细胞融合后会特异转移到肺组织和骨组织等[5]。聚乙二醇化学融合方法是传统的细胞融合方法,但对于肿瘤细胞融合,其融合效率低,且并不适用于所有的肿瘤细胞融合。细胞电融合技术是近年发展的细胞融合技术,BTX ECM830电融合/电转仪是实验室常见仪器,多用于细胞转化,也可用于细胞融合,但融合效率较差。细胞融合的前提是两细胞膜的紧密接触。植物血凝素 (phytohemagglutinin,PHA)是一种有丝分裂原,可以起到细胞凝聚的作用,使得两细胞膜紧密接触。本研究以黑色素瘤细胞为模型,结合PHA的细胞凝聚作用以及ECM830电融合作用,提高细胞融合效率,得到黑色素瘤溶瘤细胞,并进一步探讨融合细胞相应特征。
材料和方法
细胞培养 小鼠黑色素瘤细胞B16-F10、黑色素融合细胞B16/B16均培养于含5%胎牛血清并加青链霉素双抗的DMEM培养液中。培养温箱环境为5%CO2、37℃。
细胞标记 分别用绿色荧光病毒pLL3.7和红色荧光病毒pLL3.7-dsRED感染标记B10-F10细胞 (感染过程中病毒数与细胞数之比,即感染复数=1)。pLL3.7质粒以及相应的包装质粒 pMDL,pREV和pVSVG购买于Addgene公司。pLL3.7-dsRED载体的构建是将PCR所得的dsRED片段取代pLL3.7中的GFP片段而完成的。慢病毒用239T细胞包装产生,其包装和感染过程严格按参考文献 [6]方法进行。
ECM830化学细胞融合法 B16-F10-GFP(1×107)和B16-F10-RFP(1×107)混合离心后,用200 μl电击液重悬,加入到电击杯中,ECM830电融合仪 (美国BTX公司)250V,30 μs电击3次,静置5 min后将细胞植入到培养皿中培养。
PHA-ECM830细胞融合法 混合B16-F10-GFP(1×107)细胞和B16-F10-RFP(1×107)细胞,DMEM液洗两次,加入500 μl 50 mg/L的PHA(Sigma-Aldrich公司)液,37℃孵育30 min。孵育后的混合细胞900 r/min离心5 min。将离心后的上清液完全弃去,加入200 μl电击液,用手顿挫振荡开细胞,并移入到电击杯中。ECM830电融合仪250V、30 μs电击3次。静置5 min后将细胞植入到培养皿中培养。
荧光激活细胞分选 单色和双色荧光标记的细胞通过BDFACSAria流式分选仪 (BD公司)分选。分选后的细胞用含20% 胎牛血清和含两倍双抗的DMEM液收集。收集后立即培养于正常培养液中。
DNA含量测定 应用碘化亚啶染色法测定DNA含量。将细胞按约80%的密度接种于60 mm培养皿中,次日收集细胞,PBS洗2次,75%乙醇固定过夜。将固定后的细胞PBS洗两次,1 g/L核糖核酸酶 (Sigma-Aldrich公司)37℃消化30 min,0.5 g/L碘化亚啶 (Sigma-Aldrich公司)避光染色40 min,流式检测DNA含量。
体外细胞增殖实验 3×105细胞接种于60 mm培养皿中,每2天更换培养液,每天计数细胞数。
皮下成瘤实验 胰酶消化细胞,PBS洗两次,用PBS液将细胞悬起 (5×105/ml),5×104个细胞皮下注射到C57BL/6小鼠 (北京维通利华实验动物有限公司)腋下,用游标卡尺每5天测量1次肿瘤体积。
统计学处理 所有数据均用均数±标准差表示,P值用Excel软件中的T检验计算。P<0.05为差异具有统计学意义。
结 果
荧光标记黑色素瘤融合细胞 B16-F10黑色素瘤细胞增殖速度快,恶性度高。将黑色素瘤细胞进行荧光标记,并通过流式分选,得到了分别带有绿色 (图1A)和红色荧光 (图1B)标记的黑色素瘤细胞亚克隆。
PHA-ECM830细胞融合法融合黑色素瘤细胞 首先用ECM830直接进行黑色素瘤细胞融合,融合后的细胞种植于平皿中24 h后观察可见:1个视野下很难见到黑色素瘤融合细胞,1个平皿中只有几个黑色素瘤融合细胞,细胞融合效率低 (不到0.50%)。在此基础上,在进行ECM830电融合前加入PHA,使得两细胞膜紧密接触,荧光显微镜下可见到绿色荧光和红色荧光黑色素瘤细胞的细胞膜紧密接触 (图2A)。融合后取少许细胞展片,可见到带有双色荧光标记的黑色素瘤融合细胞 (既带有绿色荧光又带有红色荧光,叠加后呈现黄色)(图2B)。
流式分选黑色素瘤融合细胞 融合细胞48 h后流式分析显示带有双色荧光标记的融合细胞所占的比例为7.18%,细胞融合效率较ECM830电融合法 (融合效率小于0.50%)提高约15倍。流式分选出带有双色荧光标记的融合细胞,经细胞培养后得到黑色素瘤融合细胞 (图3)。
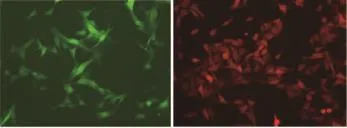
图1 绿色 (A)及红色 (B)荧光蛋白标记黑色素瘤细胞 (×200)Fig 1 Labeled melanoma cells with GFP(A)and RFP(B)(×200)
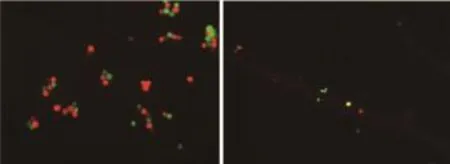
图2 黑色素瘤细胞经PHA作用后电融合生成黑色素瘤融合细胞Fig 2 Melanoma fusion cells were obtained through the electrofusion method after treated with PHA
黑色素瘤融合细胞DNA含量的变化 DNA含量分析显示,流式分选后的黑色素瘤融合细胞其DNA含量发生了翻倍的变化,由多二倍体转化为多四倍体(图4)。
黑色素瘤融合细胞增殖速度的变化 在细胞培养中,发现黑色素瘤融合细胞的传代间隔时间明显延长。进一步体外增殖实验表明融合细胞的增殖速度较融合前的黑色素瘤细胞明显减慢 (图5A)。皮下成瘤实验表明黑色素瘤融合细胞的皮下肿瘤生长速度减慢(图5B)。

图3 流式分析及分选黑色素瘤融合细胞Fig 3 Melanoma fusion cells were analyzed and selected through fluorescence activated cell sorting

图4 黑色素瘤融合细胞及黑色素瘤细胞的DNA含量Fig 4 DNA content of the melanoma fusion cells and melanoma cells

图5 黑色素瘤融合细胞的体外增殖曲线及体内生长曲线Fig 5 The melanoma fusion cells’proliferation curve in vitro and their growth curve in vivo
讨 论
细胞融合在生物发育、组织修复和更新生成中均发挥重要作用,如精子细胞与卵子细胞融合形成受精卵、破骨细胞融合形成巨细胞、滋养细胞融合形成胎盘等[7]。细胞融合的异常和失调会导致疾病的发生,最常见的就是肿瘤。另一方面,细胞融合作为全基因组的有效研究手段在近年被广泛应用,特别是在肿瘤研究中针对肿瘤细胞的转移机制,就有巨噬细胞-肿瘤细胞融合理论等[8]。细胞融合及细胞融合技术是肿瘤的重要特征及研究方式。
细胞融合方法包括聚乙二醇化学融合法、ECM830电融合及ECM2001电融合技术。聚乙二醇化学融合法及ECM830电融合法均存在融合效率低的问题;而ECM2001电融合仪,虽然融合效率高,但对实验室仪器以及实验室平台均有较高要求,限制了它的广泛应用。本研究结合PHA可使两个肿瘤细胞紧密接触的特征,在PHA作用的基础上进行电击融合,从而大大提高细胞融合效率。ECM830是BTX公司较早推出的产品,在实验室广泛存在;PHA具有凝集各种细胞的作用,作用范围广,因而PHA-ECM830细胞融合方法是一种应用广泛且高效率的细胞融合方法。
本研究显示黑色素瘤融合细胞的增殖速度减慢。增殖速度是肿瘤细胞恶性度的重要特征。有报道表明,肿瘤细胞尤其是黑色素瘤细胞与正常细胞如成纤维细胞融合后会出现增殖速度降低的现象[9],其可能的原因是正常细胞中的抑癌基因,如p53等发挥的作用。黑色素瘤融合细胞增殖速度减慢的具体机制尚待进一步研究。
[1]Abdalla F,Boder J,Markus R,et al.Correlation of nuclear morphometry of breast cancer in histological sections with clinicopathological features and prognosis [J].Anticancer Res,2009,29(5):1771-1776.
[2]Mossbacher U,Knollmayer S,Binder M,et al.Increased nuclear volume inmetastasizing‘thick’melanomas[J].J Invest Dermatol,1996,106(3):437-440.
[3]Lu X,Kang Y.Cell fusion as a hidden force in tumor progression [J].Cancer Res,2009,69(22):8536-8539.
[4]Harris H.The anslysis of malignancy by cell fusion:the position in 1988 [J].Cancer Res,1988,48(12):3302-3306.
[5]Lu X,Kang Y.Efficient acquisition of dual metastasis organotropism to bone and lung through stable spontaneous fusion between MDA-MB-231 variants [J].Proc Natl Acad Sci USA,2009,106(23):9385-9390.
[6]Tiscornia G,Singer O,Verma IM.Production and purification of lentiviral vectors [J].Nat Protoc,2006,1(1):241-245.
[7]Chen EH,Olson EN.Unveiling the mechanisms of cell-cell fusion [J].Science,2005,308(5720):369-373.
[8]Pawelek JM,Chakraborty AK.Fusion of tumour cells with bone marrow-derived cells:aunifying explanation for metastasis[J].Nat Rev Cancer,2008,8(5):377-386.
[9]Harris H.The analysis of malignancy by cell fusion:theposition in 1988 [J].Cancer Res,1988,48:3302-3306.

