慢性华支睾吸虫感染对脂多糖刺激巨噬细胞反应的影响*
徐 嘉, 徐 雪, 王中华, 胡旭初, 詹 蔚, 叶 子, 詹 红, 熊 艳△
(中山大学1附属第一医院急诊科,2附属第一医院黄埔院区神经三科,3中山医学院寄生虫教研室,广东广州510080)
巨噬细胞是参加机体针对感染和炎症的天然免疫应答的重要细胞,主要参与吞噬病原体、免疫调理和组织损伤的病理生理过程。这些作用被认为是经典活化型巨噬细胞(classical activated macrophage,M1)的主要功能。但近年来,一种新的巨噬细胞亚类越来越受到重视,其活化条件和功能状态与经典活化型巨噬细胞大不相同,被称为替代活化型巨噬细胞(alternatively activated macrophage,M2),主要参与抑制炎症、免疫耐受和损伤修复的病理生理过程。慢性华支睾吸虫(Clonorchis sinensis,Cs)感染可导致宿主机体免疫应答向Th2方向偏移,产生抑制炎症反应的细胞因子、效应分子和T细胞亚型等,慢性华支睾吸虫感染的宿主机体对可能同时存在的急性炎症反应表现出抑制免疫应答,减轻组织损伤的效应,但其中的具体机制尚不明确。本研究通过建立慢性华支睾吸虫感染大鼠模型,检测血清促炎和抗炎因子水平以评价其免疫状态,并观察不同状态下腹腔巨噬细胞的表型分化以及对炎症刺激因子的反应,探讨Cs感染对其它感染性疾病的影响及可能的机制。
材料和方法
1 动物及分组
清洁级雄性SD大鼠(160~180 g)40只,购自中山大学北校区实验动物中心,其中正常对照组10只,慢性华支睾吸虫感染组10只,进行第一部分实验。余20只同样分组,用于获取腹腔巨噬细胞进行第二部分实验。感染华支睾吸虫囊蚴的麦穗鱼取自中山医学院寄生虫实验室建造的生态池。
2 主要试剂和仪器
高糖型 DMEM、RPMI-1640、DPBS和不含 Ca2+、Mg2+的HBSS均购自Gibco;胰酶和脂多糖(lipopolysaccharide,LPS)购于Sigma;大鼠肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)、干扰素 γ(interferon γ,IFN-γ)、白细胞介素 4(interleukin 4,IL-4)和 IL-10的ELISA检测试剂盒购于Bender MedSystems;抗大鼠PE-Cy5F4/80和大鼠PE-CD16/32抗体购于eBioscience;大鼠FITC-CD206抗体购于Santa Cruz;氯化钠、氯化钾等为国产分析纯;消化液由中山医学院寄生虫教研室保存;微量移液器购于Gilson;15 mL离心管、50 mL培养瓶和96孔培养板购于Corning;测试仪器包括Bio-Rad公司的MODEL 550型酶标仪;北京医用离心机厂生产的台式离心机;BD公司的FACSCalibur流式细胞仪。
3 方法
3.1 建立慢性华支睾吸虫感染模型
3.1.1 华支睾吸虫囊蚴的收集 (1)麦穗鱼肉50 g,用绞肉机绞碎;(2)碎鱼肉放入2 000 mL的大烧杯中,加入自来水少量,搅匀,再加自来水至满,充分搅匀,静置15 min,倒去上液,余下一半体积的液体;(3)把消化液加入烧杯中,搅匀,放入37℃温箱中消化,每隔20~30 min搅拌1次,约经4~12 h,即可消化完全;(4)将消化好的鱼肉从温箱中取出,静置15 min,倒去上液,余下的用80目筛网过滤,把残渣过滤掉;(5)滤液中加入生理盐水,静置30 min,倒去上液,如此反复,直至上液澄清为止,换到小平皿中,沉淀在解剖镜下挑取活囊蚴。
3.1.2 囊蚴攻击感染SD大鼠致华支睾吸虫慢性感染模型 具体操作如下:对华支睾吸虫感染组大鼠进行囊蚴感染,采用灌胃针经口灌胃,每只SD大鼠50个囊蚴,感染后第20 d开始每天收集粪便查虫卵,确定最早排虫卵时间,感染后第70 d收集大鼠粪便检出虫卵证实感染模型建造成功。
3.2 腹腔巨噬细胞的收集 取细胞前SD大鼠禁食不禁水24 h;SD大鼠乙醚麻醉后,断头处死。将动物仰卧放置,剪去腹壁皮毛,用70%乙醇消毒;沿正中线剪开腹壁,将5~10 mL冲洗液注入腹腔,用吸管反复冲洗腹膜腔;将腹膜腔的细胞悬液吸入离心管,室温离心(1 000 r·min-1,10 min,2 次);用培养液混悬沉淀细胞,将细胞加入培养瓶,37℃、5%CO2培养2 h;吸去培养液,用不含Ca2+和Mg2+的HBSS清洗2次,除去漂浮的细胞,得到附着于培养瓶底壁的巨噬细胞。
3.3 腹腔巨噬细胞体外实验分组及处理 按照腹腔巨噬细胞的大鼠来源,分为3组:对照组(control group)、正常大鼠巨噬细胞组(normal group)和华支睾吸虫感染大鼠巨噬细胞(Cs infestation group)组。采用酶消化法取出贴壁的巨噬细胞,室温离心(1 000 r·min-1,10 min),用无色 RPMI-1640 完全培养液混悬沉淀细胞,将细胞调整至2×109/L,接种于96孔板继续培养,1 d后培养基换为无色RPMI-1640不完全培养液。其中正常巨噬细胞组和肝吸虫感染巨噬细胞组加入LPS(10 μg/L)刺激孵育,对照组加入无色RPMI-1640培养,每组每个时点做3个平行孔。在刺激后的0、2、12、24 h收集各组各孔细胞培养上清液,-80℃保存。
3.4 流式细胞术检测细胞膜蛋白表达 采用酶消化法取得贴壁的腹腔巨噬细胞,调整细胞至每管5×105细胞,PBS 洗1 次,100 μL PBS 重悬,向巨噬细胞中加入抗大鼠PE-Cy5F4/80抗体,向经诱导刺激后的巨噬细胞中加入小鼠FITC-CD206抗体和小鼠PECD16/32抗体,避光室温孵育30 min,PBS洗3遍,再用PBS 200 μL重悬后用BD FACSCalibur流式细胞仪检测。
3.5 细胞因子的检测 采用ELISA法检测各组大鼠血清的 IL-4、IL-10、TNF-α 和 IFN-γ 浓度,以及各组各时点巨噬细胞培养上清液TNF-α浓度,操作严格按照试剂盒说明书进行。
4 统计学处理
实验数据采用SPSS 16.0软件处理,数据以均数±标准差(mean±SD)表示,两组计量资料比较采用t检验,两组以上计量资料比较用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 正常大鼠与慢性华支睾吸虫感染大鼠血清细胞因子的比较
慢性Cs感染组较正常对照组血清IL-4、IL-10、TNF-α 和IFN-γ均明显升高(P <0.05),其中IL-4和IL-10的升高更加显著,见表1。

表1 正常对照组和慢性Cs感染组大鼠血清细胞因子浓度的比较Table 1.Comparison of serum levels of IL-4,IL-10,TNF-α and IFN-γ in rats from normal group and chronic Cs infestation group(ng/L.Mean± SD.n=10)
2 正常对照组与慢性华支睾吸虫感染组的腹腔巨噬细胞分化情况
流式细胞仪检测结果显示正常对照组大鼠的腹腔巨噬细胞向M1型巨噬细胞分化的比例为92.11%,见图1A,而慢性华支睾吸虫感染组大鼠的腹腔巨噬细胞向M2型巨噬细胞分化的比例为93.84%,见图1B。

Figure 1.The differentiation proportion of different types of peritoneal macrophages from normal group(A)and chronic Cs infestation group(B).图1 正常对照组与慢性肝吸虫感染组腹腔不同类型巨噬细胞的分化情况
3 空白对照组、正常对照组和慢性Cs感染组大鼠腹腔巨噬细胞培养上清液TNF-α和IL-10浓度的比较
在未受LPS刺激时,空白对照组、正常对照组和慢性Cs感染组大鼠巨噬细胞培养上清液中TNF-α和IL-10的浓度均较低,基础值比较无显著差异(P >0.05);给予LPS(10 μg/L)刺激后的2、12 和24 h,正常对照组和慢性Cs感染组腹腔巨噬细胞培养上清液TNF-α和IL-10浓度均呈时间依赖性升高,其中正常对照组腹腔巨噬细胞培养上清液TNF-α浓度上升更显著(P<0.05),而慢性Cs感染组腹腔巨噬细胞培养上清液IL-10的浓度上升更加显著(P<0.05),见表2。
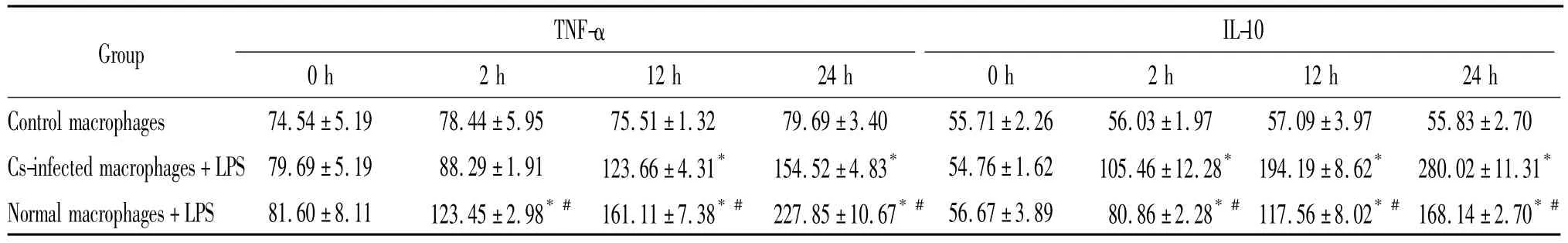
表2 各组大鼠不同时点腹腔巨噬细胞体外培养上清液TNF-α和IL-10水平的比较Table 2.The levels of TNF-α and IL-10 in the culture supernatants of peritoneal macrophages at different time points in the three groups(ng/L.Mean ±SD.n=10)
讨 论
Cs又称为肝吸虫,是感染人类引起华支睾吸虫病的病原体,其感染在世界范围内流行,且具有慢性化和长时程的特点[1]。与其它蠕虫感染一样,华支睾吸虫感染会引起宿主的免疫反应,而蠕虫感染与宿主免疫应答的关系一直是病原生物学领域研究的热点,主要集中于探讨宿主免疫应答在Cs致病机制中的作用[2]。Cs感染可诱导宿主机体获得性免疫向Th2方向极化,产生大量的Th2应答的细胞因子,如IL-4、IL-5 和 IL-13 等[3],这些细胞因子可以打击感染的蠕虫,但同时蠕虫可以通过诱导产生抗炎因子IL-10和转化生长因子 β(transfer growth factor β,TGF-β)逃避宿主机体的免疫攻击,在宿主体内长期生存,这就是Cs感染呈慢性过程的主要机制[4]。除此之外,关于蠕虫感染引起的宿主免疫应答的极化对其它疾病影响的研究越来越受到学者们的关注,已有研究显示,慢性蠕虫感染对感染性疾病,如细菌、病毒等具有保护效应[5],但具体的机制尚不明确。
巨噬细胞是机体免疫应答,尤其是在对抗病原体感染机体的天然免疫应答过程中的重要细胞之一,巨噬细胞在不同的刺激条件下发生不同的功能变化,参与感染、炎症等多种病理生理过程[6]。根据巨噬细胞活化状态和发挥作用的不同,分为经典活化型巨噬细胞(M1型)和替代活化型巨噬细胞(M2型)[7],它们在体内和体外均具有较强的可塑性,在不同条件下向不同方向极化[8]。其中,在Th2型细胞因子的作用下,如IL-4或IL-13等,巨噬细胞向M2型分化,与M1型巨噬细胞吞噬病原体、激发炎症反应和组织损伤的作用不同,M2型巨噬细胞主要发挥减轻炎症反应、组织修复和血管生成的生物学作用[9],以往血吸虫感染的研究显示M2巨噬细胞主要通过表达精氨酸酶1(Arg-1)和抵抗素样分子 α(RELMα)等发挥对炎症的抑制作用[10-11]。巨噬细胞缺乏表达Arg-1的小鼠不能抑制血吸虫虫卵诱导的炎症[11]。因此,M2巨噬细胞的免疫抑制效应可能并不完全依赖Th2细胞因子机制,有研究表明其抗炎和免疫调节机制也不依赖于IL-10[12],具体机制需进一步研究。
我们在以往的研究中,通过囊蚴灌胃建立了慢性Cs感染大鼠的模型,并通过改变灌胃囊蚴的数量、频次以及感染时间的摸索,确定最佳的建模条件,检测大鼠血清的抗体以 IgE和 IgG1亚类为主[13]。本实验中,慢性Cs感染大鼠血清的IL-4和IL-10等抑炎因子明显升高,为诱导腹腔巨噬细胞向M2表型分化提供了免疫环境,流式细胞学检测腹腔巨噬细胞表面标志物证实慢性Cs感染后腹腔巨噬细胞向M2型极化,而在自然状态下正常对照的大鼠腹腔巨噬细胞仍以经典的M1型为主。体外以脂多糖刺激并培养不同类型的腹腔巨噬细胞,以观察不同巨噬细胞对LPS这种革兰阴性细菌感染致脓毒症的最重要致病因子的炎症应答,检测细胞培养上清液TNF-α的浓度,结果显示,LPS刺激后 M1和M2型巨噬细胞均可对LPS刺激反应,培养上清液TNF-α和IL-10浓度随时间进行性升高,从LPS刺激2 h开始各时点测得M2型巨噬细胞培养上清液的TNF-α水平较M1巨噬细胞明显降低,相反的,另一种抑炎因子IL-10的水平随时间进展明显升高,这反映出M2巨噬细胞对炎症刺激的耐受。在我们关注的脓毒症研究中,以往免疫调节治疗的研究往往局限于某些药物或免疫系统的某个环节[14],本研究初步结果显示在慢性Cs感染导致的机体Th2免疫应答环境下,发生了参与炎症反应关键的巨噬细胞和细胞因子的改变,这可能为临床严重感染所致脓毒症的疾病诊治提供了新的思路和理论基础,相关的实验研究已经深入展开。
[1] Rim HJ.Clonorchiasis:an update[J].J Helminthol,2005,79(3):269-281.
[2] 高 翔,刘 平,李懿宏,等.华支睾吸虫感染患者血清Th1/Th2细胞因子水平检测及意义[J].国际免疫学杂志,2006,29(1):55-57.
[3] Maizels RM,Yazdanbakhsh M.Immune regulation by helminth parasites:cellular and molecular mechanisms[J].Nat Rev Immunol,2003,3(9):733-744.
[4] Taylor A,Verhagen J,Blaser K,et al.Mechanisms of immune suppression by interleukin-10 and transforming growth factor-β:the role of T regulatory cells[J].Immunology,2006,117(4):433-442.
[5] Van Riet E,Hartgers FC,Yazadanbakhsh M.Chronic helminth infections induce immunomodulation:consequences and mechanisms[J].Immunobiology,2007,212(6):475-490.
[6] 吴晓倩,宜 金,何丽珊.ox-LDL对巨噬细胞内皮脂肪酶表达的影响[J].中国病理生理杂志,2012,28(7):1172-1175.
[7] Mantovani A,Sica A,Locati M.Macrophage polarization comes of age[J].Immunity,2005,23(4):344-346.
[8] Gordon S.Macrophage heterogeneity and tissue lipids[J].J Clin Invest,2007,117(1):89-93.
[9] Edward JP,Zhang X,Frauwirth KA,et al.Biochemical and functional characterization of three activated macrophage populations[J].J Leukoc Biol,2006,80(6):1298-1307.
[10] Pesce JT,Ramalingam TR,Mentink-Kane MM,et al.Arginase-1-expressing macrophages suppress Th2 cytokine-driven inflammation and fibrosis[J].PLoS Pathog,2009,5(4):e1000371.
[11] Nair MG,Du Y,Perrigoue JG,et al.Alternatively activated macrophage-derived RELM-α is a negative regulator of type 2 inflammation in the lung[J].J Exp Med,2009,206(4):937-952.
[12] Herbert DR,Holscher C,Mohrs M,et al.Alternative macrophage activation is essential for surviving during schistosomiasis and downmodulated T helper 1 responses and immunopathology[J].Immunity,2004,20(3):623-635.
[13] Wang X,Liang C,Chen W,et al.Experimental model in rats for study on transmission dynamics and evaluation of Clonorchis sinensis infection immunologically,morphologically,and pathologically[J].Parasitol Res,2009,106(1):15-21.
[14] 黄顺伟,管向东,陈 娟,等.乌司他丁联合胸腺肽α1改善脓毒症患者免疫功能的作用机制研究[J].中国病理生理杂志,2009,25(11):2168-2172.

