江西省烟草青枯菌生理小种及生化型鉴定
周泽科,张超群,蒋军喜*,胡长志,黄 婷
(1.江西农业大学 农学院,江西 南昌 330045;2.江西烟叶科学研究所,江西 南昌 330025)
青枯病是由茄科劳尔氏菌(Ralstonia solanacearum)引起的典型细菌性维管束病害,可侵染包括烟草在内的44个科一百多种植物[1]。该病原菌感染植株后可在维管束内大量繁殖,堵塞导管并分泌有毒物质,导致植株迅速萎蔫甚至死亡[2]。青枯病对我国长江流域及以南各烟区的烟叶生产造成严重危害。近年来,随着异常气候的频繁出现、烟草种植面积的持续扩大以及连作年限的增加,烟草青枯病在江西烟区的发病也呈逐年加重趋势,其中以石城县等老烟区病情尤为严重。
根据贾春燕[3]、陈泽鹏等[4]的报道,使用不同配比的化学农药已能对烟草青枯病起到一定的防治作用,但迄今选育抗病品种仍是防治此病最为有效的方法。为明确江西烟草青枯菌的致病性变异,为今后烟草抗性资源筛选和抗病品种选育工作的开展提供理论依据,笔者于2012年4—6月从江西省石城、瑞金、会昌、信丰、广昌、峡江等县(市)烟田感病烟株上分离获得24个致病性烟草青枯病菌菌株,选取其中6个代表性菌株,对其生理小种和生化型进行了鉴定,现将鉴定结果报道如下。
1 材料与方法
1.1 供试菌株的分离与筛选
从江西各主要种烟县(市)采集呈典型烟草青枯病症状的烟株(品种K326),切取病茎小块维管束组织,采用培养皿稀释分离法于牛肉膏蛋白胨琼脂培养基(NA)上分离青枯病菌,经16S rDNA核苷酸序列测定[5]后于2,3,5—氯化三苯基四氮唑培养基(即TTC)上纯化,筛选得到24株烟草青枯病菌菌株,菌株于4℃无菌水中保存,各菌株编号及来源地见表1。
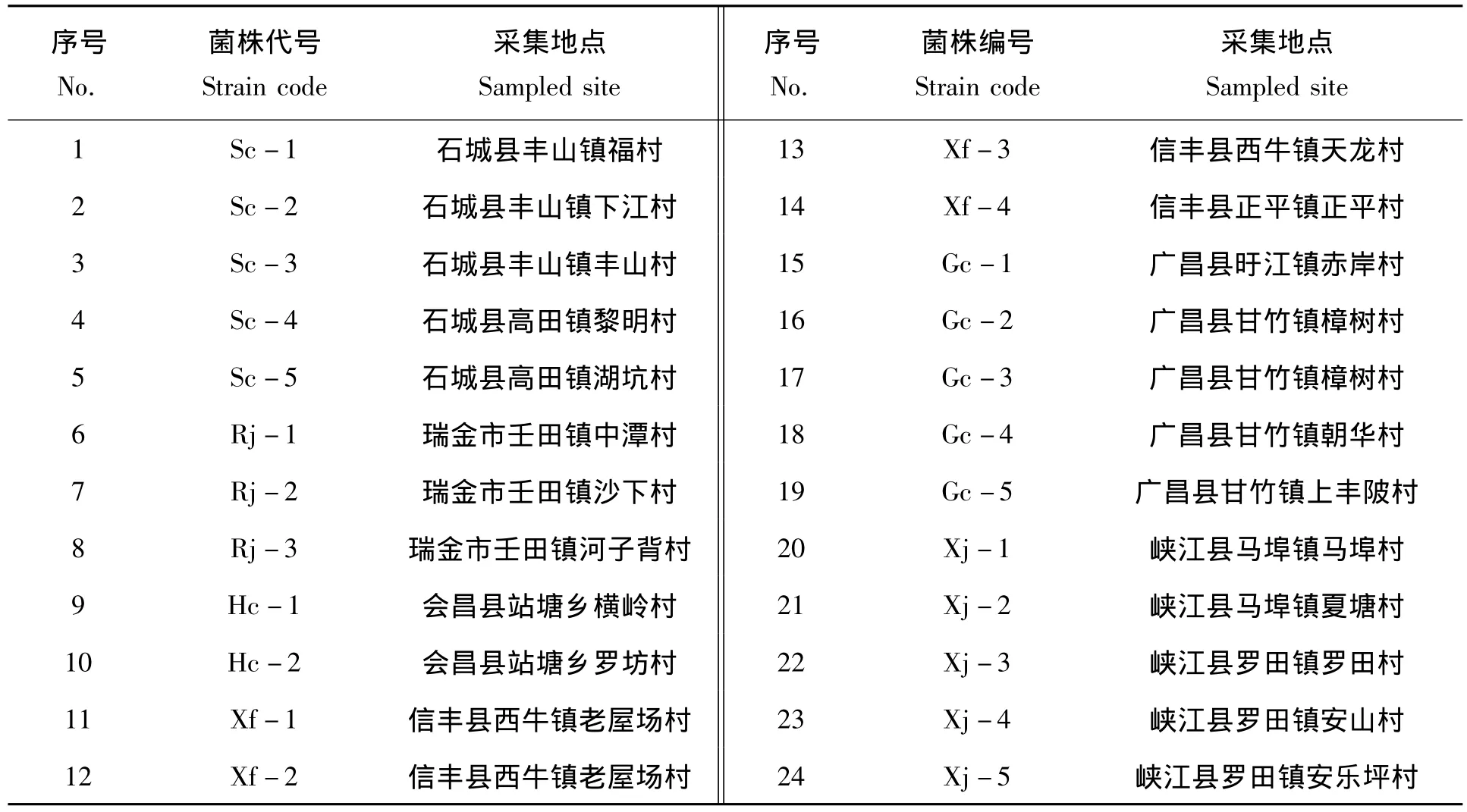
表1 供试菌株来源Tab.1 Original source of the tested strains
1.2 生理小种鉴定
1.2.1 鉴别寄主的育苗和接种 选用烟草(K326)、茄子(正兴墨茄)、番茄(合作906大果型)、花生(大粒子)和马铃薯(市售品种)作为烟草青枯病菌的鉴别寄主。将于无菌水中催芽24 h后的烟草、茄子和番茄的种子以及花生种子、马铃薯块茎分别播种于营养土(植物培养基、灭菌细土按1∶2体积比拌匀)中,25℃温室育苗至3~4叶后,将幼苗移栽于直径为12 cm的营养钵中,每钵1株,继续温室培育至5~7叶后待用。
选取6株具有代表性的烟草青枯病菌株Sc-1、Rj-1、Hc-1、Xf-1、Gc-1和 Xj-1作为供试菌株,分别于NA液体培养基中扩大培养后无菌水稀释成浓度为3×108cfu/mL的菌液,采用菌液浸根接种法[6]分别对鉴别寄主进行接种,每处理接种数量均为8株,实验设置接种清水作对照。接种完成后,将植株置于30℃温室中培养,定期浇水以保证湿度,逐日观察并记录发病情况,9 d后参照烟草病害分级及调查方法行业标准(YC/T39—1996)统计发病结果,计算出病情指数。
烟草青枯病分级标准:0级,全株无病;1级,茎部偶有褪绿斑,或在有条斑一侧有少数叶片凋萎;2级,茎部有黑色条斑,但尚未达到顶部,或病侧半数以上叶片凋萎;3级,茎部黑色条斑到达植株顶部,或病侧三分之二以上叶片调萎;4级,病株基本枯死。
1.2.2 烟叶浸润试验 将6个供试菌株各配成浓度为1×1010cfu/mL的菌液,分别进行烟叶浸润试验。选取5~7叶期K326烟株中下部叶片,用灭菌注射器将适量菌液从叶片背面注入,每叶注射20个点,每菌株注射3片叶片,以注射清水作对照,注射点用湿润脱脂棉进行保湿,注射烟株置于30℃温室中生长,分别于接种后24,36,48,60 h统计试验结果。
1.2.3 产黑色素试验 将选取的6个供试菌株分别接于L-酪氨酸平板培养基上,每个菌株接种3皿,另设3皿不接菌作为空白对照。平皿置于25℃恒温培养箱中培养,从接菌后2 d到6 d逐日观察记录各菌株的产黑色素情况。
1.3 生化型的测定
1.3.1 菌株对3种双糖和3种己醇的利用情况 将6个供试菌株分别接于乳糖、麦芽糖、纤维二糖、甘露醇、山梨醇和甜醇6种不同的试管斜面培养基上,每处理3次重复(接种3支试管),设空白培养基作对照。接种试管置于30℃恒温培养箱中培养,接种后5,7,9 d观察记录实验结果。参照Hayward[7]、何礼远[8]和林抗美等[1]的标准,对供试菌株进行生化型划分。
1.3.2 菌株对硝酸盐的产气与还原反应 采用针刺接种法将供试菌株接种于含0.1%KNO3牛肉膏蛋白胨试管平面培养基中,每个菌株接种5管,其中2管用琼脂胶密封管口,3支不封,另设5支不接菌空白培养基作对照,处理完毕将各试管置于30℃恒温箱中培养。封管试管于接菌2 d后,逐日观察记录产气情况;未封管试管分别于接菌后3,5,7 d向试管内加入格里斯氏A液和B液,记录各时间段各试管内的颜色变化反应。
2 结果与分析
2.1 供试菌株对各鉴别寄主的致病性
接种后9 d,对各鉴别寄主的病情进行分级调查,计算获得的病情指数见表2。由表2可知,供试的6个菌株对全部鉴别寄主均有强致病性,发病率均为100%,而清水对照均无发病症状。根据Buddenhagen[9]、何礼远等[10]确定的青枯菌生理小种划分标准,鉴定出6个供试菌株均为生理小种1号。
供试菌株在5种鉴别寄主上的平均病情指数从高到低依次为98.5(Xf-1)、98.0(Rj-1)、95.5(Gc-1)、95.4(Hc-1)、90.6Xj-1)和89.9(Sc-1)。Xf-1 在各供试菌株中致病性最强,不同菌株对不同鉴别寄主的致病程度存在一定差异,平均病情指数的差异为0.7~8.6。5种鉴别寄主对供试菌株均表现出高度敏感反应,平均病情指数从高到低分别为99.1(烟草)、98.8(番茄)、97.5(花生)、90.1(茄子)和87.9(马铃薯),马铃薯对供试菌株的抵抗力在5种鉴别寄主中相对最强。
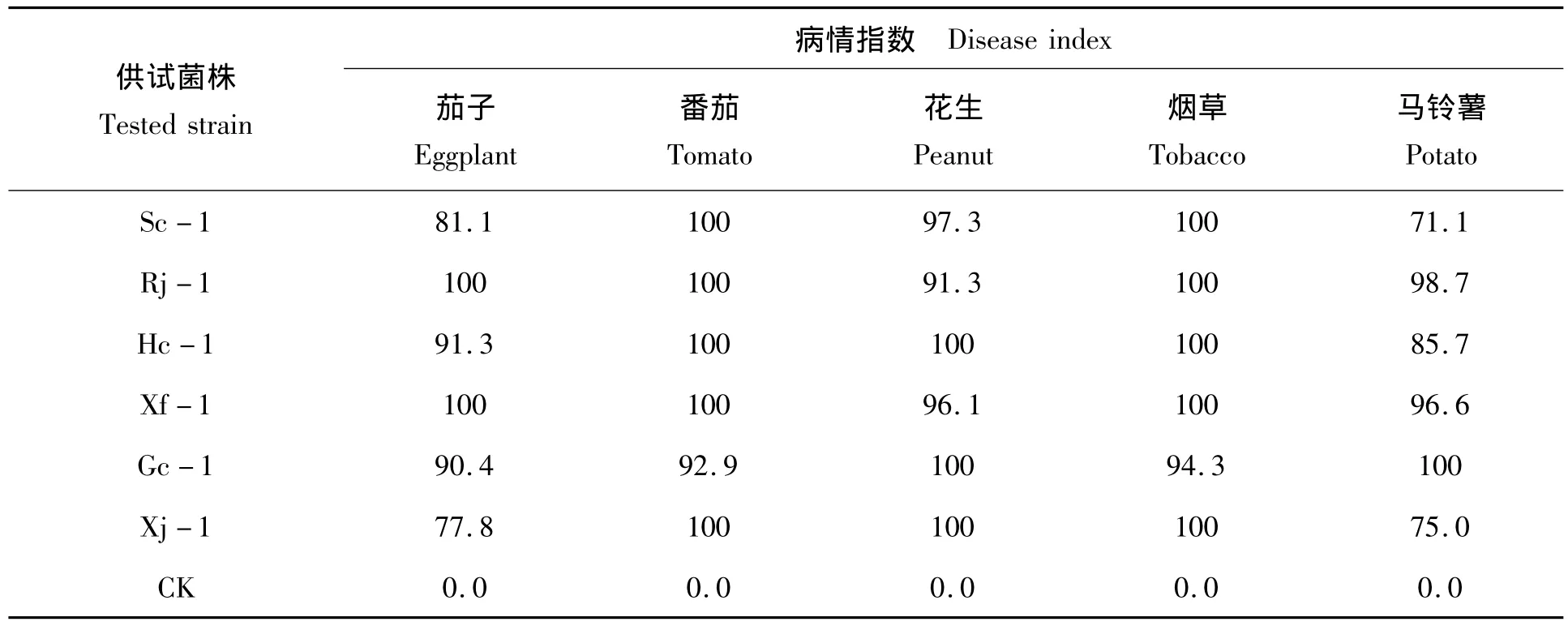
表2 烟草青枯菌接种鉴别寄主的病情指数统计Tab.2 Disease index statistics of Ralstonia solanacearum on differential hosts
2.2 烟叶浸润和产黑色素试验
6个供试菌株浸润烟草叶片24 h后,浸润点无明显颜色变化;36 h后,浸润点开始出现浅黄色斑点;48 h后浸润斑点由浅黄色渐变为浅褐色;60 h后,浸润点均呈现褐色;清水浸润叶片则无明显症状。图1为菌株的烟叶浸润试验结果。
L—酪氨酸培养基接种各供试菌株3 d后开始产生少量黑色素,随着接种时间的增加,黑色素的量逐渐增多,接种6 d后,培养基均呈现为深褐色。根据浸润和产黑色素试验结果,6个供试菌株也被鉴定为生理小种1号。

图1 烟叶浸润试验Fig.1 Infiltration test of R.solanacearum into tobacco
2.3 供试菌株的生化型测定
供试菌株生化型测定结果见表3。6个供试菌株均能利用乳糖、麦芽糖、纤维二糖、甘露醇和山梨醇而使培养基从蓝色变成黄色,但各菌株均不能利用甜醇。供试菌株接种含0.1%KNO3的牛肉膏蛋白胨培养基时,均能发生脱氮作用产生气体;加入格里斯氏A液和B液后,培养基颜色呈紫红色,表明硝酸盐发生还原反应,有亚硝酸根生成。各空白对照组份均无颜色变化。试验结果表明,供试的6个江西烟草青枯菌株为生化型Ⅲ-1(即生化型Ⅲ中的1号亚型)。
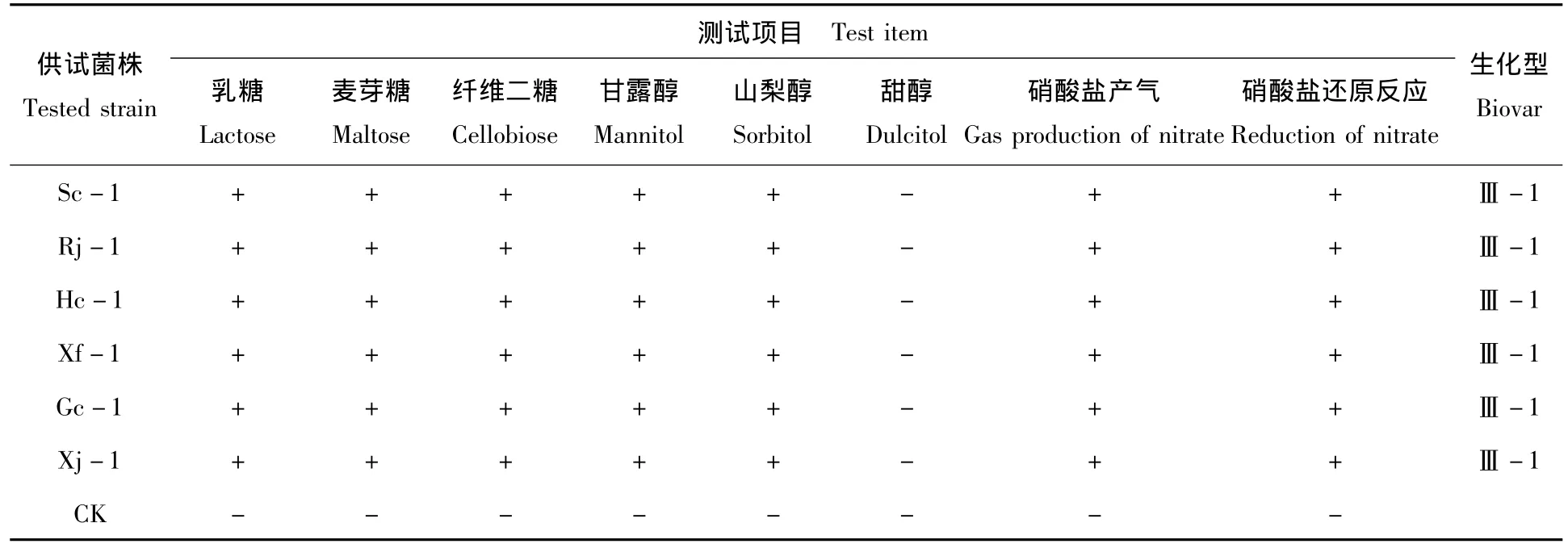
表3 供试菌株的生化型测定结果Tab.3 Biovar determination of tested strains
3 结论与讨论
本文从采自石城、瑞金、会昌、信丰、广昌和峡江等江西省主要产烟县(市)的感病烟株上共分离得到24株致病性青枯劳尔氏菌,选取其中具有代表性的6个菌株作为供试菌株,进行生理小种和生化型鉴定,结果发现:所有6个供试菌株均属于生理小种1号,而在生化型划分中均属于生化型Ⅲ-1。根据实验结果,笔者初步认为江西烟草青枯病菌致病性差异不明显,这对江西开展烟草青枯病抗性育种和抗病品种利用是一个有利的条件。
青枯劳尔氏菌的寄主范围非常广泛,涉及50多个科的200种植物,其中包括马铃薯、番茄、茄子、辣椒、甘薯、花生、烟草、香蕉、桑树、桉树、油橄榄等许多重要的粮食、蔬菜和经济作物[11]。青枯菌共分为5 个生理小种(Race 1,2,3,4,5),同时也被分为5 个生化型或生化变种(BiovarⅠ,Ⅱ,Ⅲ,Ⅳ,Ⅴ),但生理小种与生化型之间并无必然的联系[12]。除本结果外,我国山东、湖南、广西、重庆、四川等地也相继开展了烟草青枯病菌的生理小种和生化型鉴定研究,已报道的全部生理小种鉴定结果均为生理小种1[13-17],而生化型鉴定结果则不完全相同,其中,大部分菌株属于生化型Ⅲ和生化型Ⅳ,少数菌株则属于生化型Ⅱ和生化型Ⅴ[18]。由此表明,目前我国烟草青枯病菌在总体上致病性分化均不明显,但生化型存在一定的丰富性,至于生化型如何反映我国烟草青枯病菌的内在本质有待进一步研究。
[1]林抗美,朱育菁,刘波,等.福州地区植物青枯病生理分化的研究[J].中国农学通报,2005,21(12):321-324.
[2]向妙莲,冉隆贤,周斌.水杨酸处理对桉树抗青枯病诱导作用研究[J].江西农业大学学报,2006,28(6):868-871.
[3]贾春燕,郑洪波,张茹萍,等.防治烟草青枯病的药剂筛选[J].山东农业科学,2010(8):76-78.
[4]陈泽鹏,王涛,陈伟明,等.烟草抗青枯病的药剂诱导效应与抑菌增效作用[J].烟草科技,2011(1):74-76.
[5]周泽科,崔朝宇,蒋军喜,等.江西烟草青枯病菌的分子鉴定及系统发育分析[J].广东农业科学,2012(13):84-86.
[6]何自福,佘小漫,虞皓,等.空心菜青枯病病原菌的鉴定[J].植物病理学报,2008,38(2):120-125.
[7]Hayward A C.Characteristics of Pseudomonas solanacearum[J].Journal Applied Bacteriology,1964,27(2):265 -277.
[8]He L Y,Sequeira L,Kelman A.Characteristies of Pseudomonas solanacearum from China[J].Plant Disease,1983(67):1357-1367.
[9]Buddenhagen L.Biological and physiological aspects of bacterial wilt caused by Pseudomonas solanacearum[J].Annual Review of Phytopathology,1964(2):203 -230.
[10]何礼远,康耀卫.植物青枯菌(Pseudomonas solanacearum)致病机理[J].自然科学进展,1995,5(1):7 -16.
[11]刘波,朱育菁,林抗美,等.青枯雷尔氏菌在植株体内分布及其致病力的异质性研究[J].中国农业科学,2007,40(7):1559-1566.
[12]谭志琼,张荣意,李桂珍,等.红掌青枯病的症状和病原菌鉴定[J].植物病理学报,2006,36(5):392-396.
[13]郑继发,丁爱云,张建华,等.山东省烟草青枯病的发生和病原菌鉴定研究[J].山东农业大学学报,1996,27(1):17-22.
[14]邓正平,匡传富,周志成,等.湖南烟草青枯病菌生理小种测定[J].湖南农业大学学报:自然科学版,2004,30(1):47-49.
[15]黄福新,陈永惠,华静月,等.广西烟草青枯菌菌系及其主要生理特性研究[J],植物保护学报,1998,25(3):240-244.
[16]邹阳,肖崇刚.重庆地区烟草青枯病菌生理小种的初步鉴定[J].烟草科技,2008(5):60-64.
[17]刘旭,夏先全,姚革,等.四川省烟草青枯病的病原菌及发病规律研究[J].西南农业学报,2008,21(6):1587-1590.
[18]华静月,张长龄,何礼远.我国植物细菌青枯菌的生化型和其它生理差异[J].植物保护学报,1984,11(1):42-50.

