精子DNA碎片对IVF-ET结局的影响
张 帅,孟啸寅,卓胜楠,崔志英,崔险峰,张云山
(1.天津医科大学研究生院,天津 300070;2.天津市中心妇产科医院生殖医学中心,天津 300100)
近年来,不育症的发病率在世界范围内呈逐年上升趋势。我国目前的患病率约为10%~15%,其中50%是由男方因素引起的。精液常规分析是寻找男性不育原因的第一步检查,主要包括精子密度、精子数量、前向运动力和精子形态学检查等,然而这些检查只反映睾丸的生精功能,不能反映精子DNA损伤和断裂的情况。因此,上述检查指标不能作为评估男性生育力的唯一指标,况且约有15%的男性不育患者精液检查是正常的[1]。由此看来,精液常规分析已经不能作为评估男性生育力的最佳指标,而有必要探讨新的男性不育评价指标。现在随着辅助生殖技术(assisted reproductive techniques,ART)实验室检测技术的进步发展,对精子DNA 损伤和碎片化检测分析成为近几年的研究热点,可以说,它不仅作为一种对传统精液常规检测的补充,而且有利于临床医生对男性生育能力评估工作的进一步完善。
1 资料与方法
1.1 临床资料
1.1.1 研究对象 2012年3月-7月就诊于天津市中心妇产科医院生殖医学中心符合纳入标准的139例体外受精-胚胎移植助孕初筛患者。纳入标准:常规体外受精(IVF),新鲜精液标本,夫妇染色体G 显带技术检查均为正常核型,男性检查包括男性第二性征、阴茎、阴囊、精索、输精管、附睾、睾丸等均无异常。排除标准:重度少弱精子症患者。由于6例因各种临床因素取消移植,共计133例进入胚胎移植(ET)周期,平均年龄(30.1±3.9)岁,平均不育年限(5.1±2.8)年。
1.1.2 仪器和试剂 计算机辅助精子分析仪为北京清华同方(CASAS-QH-Ⅲ)产品;精子DNA 碎片检测试剂盒为深圳博锐德生物科技有限公司产品。
1.2 方法
1.2.1 精液优化分离及精液常规分析 精液标本采集时间:IVF 取卵日前最后一次排精,禁欲2~7 d,手淫法收集新鲜精液于取精杯内,立即放于37℃恒温箱内,完全液化后充分混匀;上泳法处理精液用人输卵管液(HTF)按照WHO 标准配制[2],将制备后精液均分为两份,一份按照WHO 标准行精液常规分析;采用苏木素-伊红染色;按照Kruger(1999)评分标准行精子形态学分析;另一份用配制HTF 调精子浓度[(5~10)×106/mL]用于精子DNA 碎片检测,并根据DFI 值将上述患者分为A组(DFI<17.6%)、B组(17.6%≤DFI≤30%)、C组(DFI>30%)。
1.2.2 精子染色质扩散实验(1)制片:①易熔凝胶管于80℃孵育20 min,融化后置于37℃待用(平衡5 min);②生理盐水调精子浓度(5~10)×106/mL;取稀释后标本60μL,加入熔化易熔凝胶管(37℃保温),混匀,37℃孵育待用;③制备精子悬液30μL加入载玻片包被区,盖上盖玻片,置2~8℃冰箱5 min;④小心移去盖玻片;⑤载玻片垂直浸入反应液M(0.09%的H2O2醋酸溶液)反应池内,20~28℃反应7 min;⑥将载玻片浸入反应液N(0.5% SDSTris-HCl 缓冲液)反应池内,20~28℃反应25 min;⑦载玻片水平浸入大量纯化水中5 min;⑧将载玻片依次浸入70%、90%、100%乙醇反应池,2 min;⑨自然干燥。(2)染色:载玻片以瑞氏染液(0.2%瑞氏色素、0.06%吉氏色素甲醇溶液)15~20 滴覆盖,片刻再加入瑞氏缓冲液(pH 值6.4~ 6.8,0.06 mol/L磷酸盐缓冲液)30~40 滴,以洗耳球吹打混合染液,室温15 min 后流水冲洗染片;自然干燥。(3)结果判断:在普通光学显微镜下计数500个精子,根据Fernández 标准分级:a.大光晕,晕轮≥精子头横径;b.中光晕:介于大小光晕之间;c.小光晕:晕轮≤精子头横径1/3;d.无光晕;e.退化精子。大光晕、中光晕精子为DNA 完整精子,小光晕、无光晕和退化精子为DNA 损伤精子。
1.2.3 控制性超促排卵及IVF-ET(体外受精-胚胎移植)按常规GnRH-a 长方案进行,即从前一月经周期第21 日起皮下注射GnRH-a 行降调节,达降调节标准后,同时加用促性腺激素(Gn)诱导卵泡发育,当3个主导卵泡直径≥18 mm 时,停用GnRH-a 和Gn,根据患者具体情况当晚肌注HCG 4 000~10 000 IU 不等,36 h 后在阴道B 超引导下行穿刺取卵术。取卵当日采用常规IVF 方法授精,授精后16~18 h 观察受精情况。授精42 h 和72 h 观察卵裂情况。见2个原核(PN)和第2 极体(Pb2)为正常受精,见≥3个PN 或≤1个PN为异常受精。根据改良的Dale 方法对胚胎进行评级,将胚胎分为Ⅰ、Ⅱ、Ⅲ、Ⅳ级,Ⅰ~Ⅲ级胚胎为可移植胚胎,Ⅳ级胚胎为不可移植胚胎。采卵后72 h 移植1~3个胚胎,黄体支持采用黄体酮60 mg/d 肌肉注射,剩余有发育潜能的胚胎行冷冻保存。
1.2.4 观察指标计算 精子DFI=[(小光晕精子+无光晕精子+退化精子)/500]×100%;IVF 受精率=受精胚胎数/获卵数×100%;卵裂率=2PN 卵裂数/IVF受精数×100%;优质胚胎率=优质胚胎数/2PN 卵裂数×100%;ET 后14 d 测定血清β-hcG≥25 mIU/mL确定为生化妊娠,28 d 后B 超检查宫腔内见妊娠囊确定为临床妊娠。
1.3 统计学方法 采用SPSS11.5 统计软件进行数据分析,计量数据符合近似正态分布者以±s 表示,多组间均数比较采用单因素方差分析,组间两组比较采用LSD-t 检验;偏态分布者以M(P25,P75)表示,组间比较采用Wilcoxon 秩和检验;生化妊娠数、临床妊娠数的比较采用四格表χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3 组患者一般资料和部分精液常规参数比较 共计133例患者进入ET周期,其中A组33例,B组66例,C组34例。与A组比较,B组和C组正常形态精子率、精子前向活动力[(a+b)%]均降低,A、C组间差异有统计学意义(P<0.05),A、B组间差异无统计学意义(P>0.05);与B组比较,C组正常形态精子率、精子前向活动力[(a+b)%]降低,差异有统计学意义(P<0.05)。3组患者的不育时间、禁欲天数、精液体积、精子浓度、圆形细胞数等差异无统计学意义(P>0.05)。见表1。
表1 A、B、C 3组一般资料及部分精液常规参数的比较(±s)Tab 1 Comparison of basic data and partial of conventional semen parameters in group A,B,and C(±s)
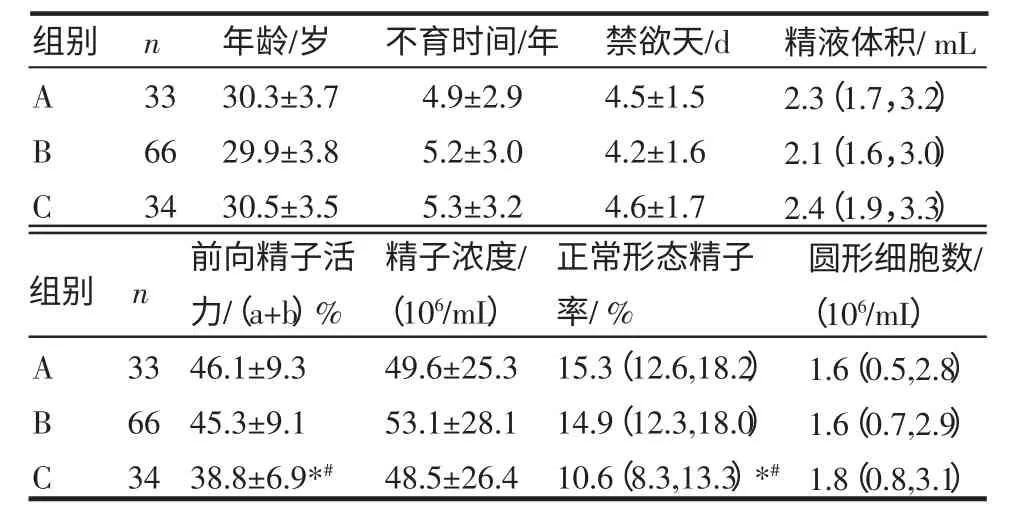
表1 A、B、C 3组一般资料及部分精液常规参数的比较(±s)Tab 1 Comparison of basic data and partial of conventional semen parameters in group A,B,and C(±s)
与A组相比*P<0.05;与B组相比#P<0.05
2.2 3 组患者IVF 受精结局的比较 与A组比较,B组和C组受精率均降低,差异有统计学意义(P<0.05);与B组比较,C组受精率降低,差异有统计学意义(P<0.05);与A组比较,B组和C组卵裂率、优质胚胎率降低,A、C组间差异有统计学意义(P<0.05),A、B组间差异无统计学意义(P>0.05);与B组比较,C组卵裂率、优质胚胎率降低,差异有统计学意义(P<0.05);A、B、C 3组间生化妊娠率、临床妊娠率差异无统计学意义(P>0.05)。见表2。
表2 A、B、C 3组受精率、卵裂率、优质胚胎率、生化妊娠率、临床妊娠率的比较(±s,%)Tab 2 Comparison of fertilization rate,cleavage rate,high quality embryos rate,biochemical pregnancy rate and clinical pregnancy rate in group A,B,and C(±s,%)

表2 A、B、C 3组受精率、卵裂率、优质胚胎率、生化妊娠率、临床妊娠率的比较(±s,%)Tab 2 Comparison of fertilization rate,cleavage rate,high quality embryos rate,biochemical pregnancy rate and clinical pregnancy rate in group A,B,and C(±s,%)
与A组相比*P<0.05;与B组相比#P<0.05
3 讨论
目前对于精子DNA 碎片化是否影响受精率、胚胎发育及临床妊娠率等尚存争议[3]。Jiang 等[4]采用吖啶橙染色法(acridine orange staining technique,AOT)对116例接受IVF 男性精子进行DFI 检测,并根据DFI 值分为DFI≤30%组和DFI>30%组,结果显示两组之间受精率、卵裂率并无明显差别。而Bungum 等[5]报道指出男性精子DFI 如果在30%以上,其获得正常妊娠的可能性将会显著降低。上述研究人员得出不同结论的原因可能是他们大都是对精浆原液(包括形态正常、异常精子和凋亡精子、圆形细胞等)行DFI 检测分析,并非对形态正常精子进行DFI 检测,如果对精液先行上泳法处理,再行DFI 检测,其检测结果则与真实DFI 水平更为接近[6]。而在2011年,Dugum 等[7]在发表于美国Journal of Andrology 的一篇综述中指出,SCD 是一种新的精子DFI 检测方法,它不仅特异度较高,而且具有操作简单、耗时短等优点,所以易于在临床上开展应用。本研究中,笔者采用SCD 法对139例接受IVF 的男性精子进行DFI 检测,133例进入ET周期(因各种临床因素取消移植6例),并根据Avendaño和Jiang 等DFI 分组标准分为A(DFI<17.6%)、B(17.6≤DFI≤30%)、C(DFI>30%)3组,通过研究各组受精率、卵裂率、优胚率和妊娠结局的差异,评价精子DFI 检测对IVF-ET 结局的影响。
本研究显示,随着DFI 的升高,A、B、C 3组精子前向活动力和正常形态精子率依次降低,且C组与A、B 两组间差异均有统计学意义。这与Abad 等[8]研究结论相一致,即他们认为弱畸形精子症患者精液中通常具有较高水平的活性氧类物质(reactive oxygen species,ROS),之所以精子DFI 与精子活力、形态表现出负相关性,可能与两者均是精液ROS 的潜在氧化攻击对象有关,即精液中ROS 达到一定浓度时,可同时引起精子DNA 和膜脂质结构的破坏。另外,国内万艳等研究认为,还可能与精子DNA 损伤导致编码Na+-K+-ATP 酶的基因发生改变、ATP酶变性,水解反应释放能量障碍有关。同时,Makhlouf 等[9]认为,精子细胞核内DFI 的含量经历一个由少到多的过程,即DFI 含量较少时,精子DNA 损伤断裂的区域主要为非蛋白编码区,此时并不会引起精子功能的明显下降,如果精子DNA 损伤的断链不能被及时修复,精浆中有害因素(如ROS)就会进一步导致精子DNA 的蛋白编码区基因受到破坏,从而导致不同程度的精子功能缺陷。Bj觟rndahl 等[10]认为,精子染色质中DFI 会导致其结构稳定性的显著降低,并可能引起IVF 受精过程中雄性原核形成受阻而导致IVF 受精率降低。另外,Kato 等[11]认为如果精子表达微管的基因受损时则会导致受精卵卵裂停滞、卵裂率降低,甚至会使胚胎碎片数量增多而影响胚胎质量。本研究显示,随着DFI值的升高,A、B、C 3组IVF 受精率、卵裂率、优质胚胎率呈逐渐下降趋势,且C组与A、B 两组间的差别均有统计学意义。这与Avendaño 等研究结论相一致,即精子DFI 与其受精能力、胚胎卵裂率、优质胚胎率之间呈负相关性。
另一方面,本研究并未得出与Avendaño 等完全一致的结论,即未显示A,B,C 3组间生化妊娠率、临床妊娠率的差异有统计学意义,这可能与本研究样本例数不够大有关。其次也可能与DFI 对精子受精能力、胚胎分裂功能的影响要远大于受精后胚胎植入及妊娠结局的后续影响等有关。应该注意的是,胚胎植入母体子宫内膜后能否正常生长发育取决于诸多因素,例如,母-胎之间的免疫耐受状态、血液营养供应、环境暴露、母体情绪应激变化等,所以笔者的研究结果没有显示出精子DFI 与生化妊娠率、临床妊娠率的相关性。
综上所述,笔者的研究显示,精子DFI 影响精子活力和IVF 结局,尤其当DFI>30%时会导致IVF受精率、卵裂率和优质胚胎率显著降低。因此,对精液常规检查正常的男性不育患者进行精子DFI 检测对指导男性不育的治疗有一定的临床意义。
[1]Agarwal A,Allamaneni S S.Sperm DNA damage assessment:a test whose time has come[J].Fertil Steril,2005,84(4):850
[2]世界卫生组织.人类精液检查与处理实验室手册[M].第5 版.北京:人民卫生出版社,2010:137-138
[3]Zini A,Sigman M.Are tests of sperm DNA damage clinically useful[J].J Andol,2008,30(3):219
[4]Jiang H,He R B,Wang C L,et al.The relationship of sperm DNA fragmentation index with the outcomes of in-vitro fertilization-embryo transfer and intra-cytoplasmic sperm injection [J].J Obstet Gynaecol,2011,1(7):636
[5]Bungum M.Sperm DNA integrity assessment:a new tool in diagnosis and treatment of fertility [OL].Obstet Gynecol Int,2012,2012,Epub 2011 Dec 1.[http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3236416/]
[6]Avendaño C,Oehninger S.DNA fragmentation in morphologically normal spermatozoa:how much should we be concerned in the ICSI era[J].J Androl,2011,32(4):356
[7]Dugum M,Sandlow J I,Brannigan R E.Sperm DNA damage evaluation techniques[J].J Androl,2011,32(3):207
[8]Abad C,Amengual M J,Gosálvez J,et al .Effects of oral antioxidant treatmentupon the dynamics of human sperm DNA fragmentation and subpopulations of sperm with highly degraded DNA[J].Andrologia,2012,[Epub ahead of print]
[9]Makhlouf A A,Niederberger C.DNA integrity tests in clinical practice:it is not a simple matter of black and white(or red and green)[J].J Androl,2006,27(3):316
[10]Bj觟rndahl L,Kvist U.Human sperm chromatin stabilization:a proposed model including zinc bridges[J].Mol Hum Reprod,2010,16(1):23
[11]Kato Y,Rideout WM 3rd,Hilton K,et al.Developmental potential of mouse primordial germ cells[J].Development,1999,126(9):1823

