依达拉奉对吸入性肺损伤大鼠肺保护作用的实验研究
肖长栓,刘 群,张建明,冯世海,赵永健,施 耘,刘娅平
(1.天津医科大学研究生院,天津300070;2.天津市第四医院烧伤科,天津300222)
吸入性损伤是呼吸道和肺组织的共同损伤。由于其发病隐匿,病情危重,同时具有热力和化学物质损害的特点,所以其治疗仍然是一个难点。吸入性损伤后,系统性炎症反应综合征(SIRS)及缺氧中毒等因素可导致其他脏器继发性损伤,最终导致多器官功能障碍综合征(MODF)发生。依达拉奉是一种强效的新型氧自由基清除剂,化学名为3-甲基-l-苯基-2-吡唑啉-5酮,研究表明,其可以清除氧自由基,在高氧肺损伤和顺铂所致的肾脏损伤中有一定效果[1-2]。但对吸入性损伤的具体治疗效果尚不清楚。本实验通过依达拉奉对烟雾吸入性损伤大鼠模型不同作用时间来研究其对自由基及炎症介质的影响,探索其对烟雾吸入性肺损伤的保护作用。
1 材料和方法
1.1 主要试剂和仪器 依达拉奉(中国药品生物制品研究所),大鼠IL-6ELISA试剂盒、TNF-α ELISA试剂盒(美国R&D公司),大鼠SOD试剂盒、MDA试剂盒、NO试剂盒、iNOS试剂盒 (南京建成公司),微量加样器(eooendorf),ELX800UV酶标检测仪(BIOTEK),光学显微镜(OLYMPUS),Centrifuge5702离心机(EPPENDORF公司),LEICA石蜡切片机。
1.2 动物分组及处理 雄性SD大鼠40只,质量(200±20)g(天津春乐实验动物提供)。采用随机数字表法随机分为4组,每组10只,正常对照组(A组),致伤空白组(B组),致伤依达拉奉8h治疗组(C组),致伤依达拉奉24h治疗组(D组)。除A组外,其余各组大鼠制作烟雾吸入性损伤模型(根据谢尔凡等的方法[3])。模型制作成功后,C组及D组腹腔注射依达拉奉(9mg/kg),B组同时腹腔注射等量生理盐水。模型制作及给药过程中无大鼠死亡等意外情况发生。
1.3 标本采集 分别于致伤8h及24h后,C组及D组取大鼠腹主动脉血5mL,3000r/min离心15min后取上清液,-20℃冷冻保存待测IL-6、TNF-α。取左肺组织及时保存于-70℃冰箱中待测NO、MOD、SOD、iNOS。以4%的甲醛灌洗肺动脉以固定肺组织,取出右肺,以丝线结扎肺门后置于4%甲醛中固定,留待病理检查。
1.4 指标检测及方法 (1)血清IL-6、TNF-α的检测:参照试剂盒说明书以双抗体夹心酶联免疫吸附法检测,依次用pg/mL、ng/L作为单位。(2)肺组织SOD、NO、MDA、iNOS的检测:滤纸吸干肺组织表面污物,制备肺组织匀浆,考马斯亮蓝蛋白测定法测匀浆液中蛋白浓度。然后参照试剂盒说明书分别测定SOD、NO、MDA及iNOS含量,分别以U/mg、μmol/mg、nmol/mg、U/mg为单位表示。(3)制作苏木精-伊红(HE)染色切片:将以4%甲醛固定好的右肺组织依次进行脱水、石蜡包埋、制作切片,待HE染色后以光镜观察。
1.5 统计学处理 所有数据均进行方差齐性检验及正态检验,±s为表现形式,用SPSS 18.0统计软件进行统计学处理。P<0.05表示统计学差异显著。
2 结果
2.1 肺病理切片检查 光镜下,A组组织结构无明显变化,肺泡腔中未见渗出的白细胞,肺泡腔结构清晰,肺泡间隔光滑均匀(图1)。B组组织可见肺泡间隔明显不均,不同程度的肺泡萎陷和扩张,大量炎性细胞及红细胞浸润肺泡和小气道,肺泡组织结构不清晰(图2)。C组(图3)和D组(图4)肺组织可见肺泡仍有一定程度的萎陷和扩张,大小形态尚不规则,毛细血管仍充血扩张,管周尚有一定数量的红、白细胞浸润,肺泡腔炎性细胞浸润轻于B组。D组损伤程度又小于C组。
2.2 各组大鼠血清TNF-α、IL-6水平的比较 见表1。与A组相比较,B、C、D组IL-6及TNF-α水平明显升高(P<0.01)。与B组相比较,C、D组TNF-α, IL-6水平明显降低(P<0.01)。与C组比较,D组TNF-α,IL-6水平明显降低(P<0.01)。
表1 各组大鼠血清TNF-α、IL-6水平比较(±s)Tab 1 Comparison of TNF-α,IL-6in the serum of the rats in each group(±s)
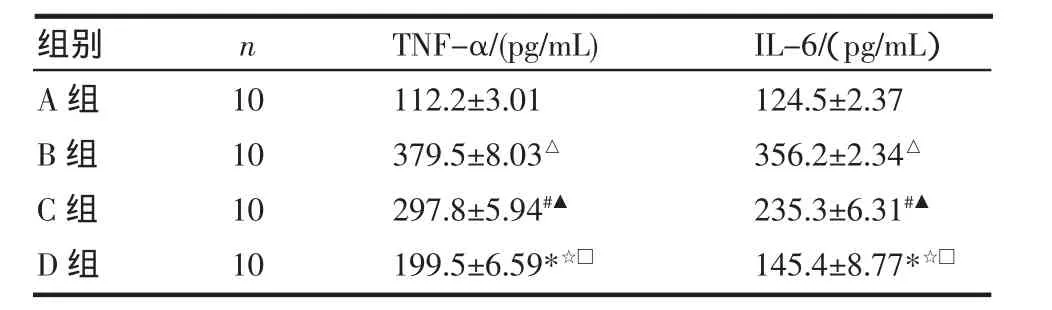
表1 各组大鼠血清TNF-α、IL-6水平比较(±s)Tab 1 Comparison of TNF-α,IL-6in the serum of the rats in each group(±s)
与A组相比,△P<0.01,#P<0.01,*P<0.01;与B组相比,▲P<0.01☆P<0.01;与C组相比,□P<0.01
组别A组B组C组D组n 10101010TNF-α/(pg/mL) 112.2±3.01379.5±8.03△297.8±5.94#▲199.5±6.59*☆□IL-6/(pg/mL)124.5±2.37356.2±2.34△235.3±6.31#▲145.4±8.77*☆□
2.3 各组大鼠肺组织MDA、NO、iNOS及SOD水平的比较 见表2。与A组比较,B、C、D组MDA、i-NOS及NO水平均升高(P<0.01),SOD水平均降低(P<0.01)。与B组比较,C、D组NO、MDA、iNOS水平均降低(P<0.01),C组SOD水平升高(P<0.05),D组SOD水平明显升高(P<0.01)。与C组相比,D组NO、MDA、iNOS水平降低(P<0.01),SOD水平升高(P<0.01)。
表2 各组大鼠肺组织MDA、NO、iNOS、SOD水平比较(±s)Tab 2 Comparison of MDA,NO,iNOS,SOD in the lung tissue of rats in each group(±s)

表2 各组大鼠肺组织MDA、NO、iNOS、SOD水平比较(±s)Tab 2 Comparison of MDA,NO,iNOS,SOD in the lung tissue of rats in each group(±s)
与A组比较,△P<0.01,#P<0.01,*P<0.01,◇P<0.05;与B组比较,▲P<0.01,☆P<0.01,◆P<0.05;与C组相比,○P<0.01,●P<0.05
组别A组B组C组D组n 10101010MDA/(nmol/mg)2.59±0.097.05±0.19△5.05±0.16#▲3.98±0.15*☆○NO/(μmol/mg)0.91±0.192.68±1.06△1.91±0.55#▲1.22±0.64*☆○iNOS/(U/mg)0.82±0.331.92±0.26△1.57±0.34#▲1.37±0.20*☆○SOD/(U/mg)336.64±2.84112.10±1.03◇134.39±2.03◆200.79±2.95●
3 讨论
吸入性损伤病情发展迅速,机制复杂,是严重威胁烧伤患者生命的临床常见疑难症之一。尽管一些细胞因子和炎症介质被证实在肺损伤和全身继发性损害中有一定作用,但在抑制过量炎症介质和细胞因子方面的问题一直未能得到有效解决,因此,寻找可行有效的抗炎药物及其探索具体使用方法就成为我们当前共同面临的难题。
依达拉奉是一种新型的自由基清除剂,可抑制脂质过氧化。因其对脑细胞有保护作用,临床上广泛应用于急性脑梗死患者[4]。研究发现其还可对肠缺血再灌注等有氧自由基参与的疾病有保护作用[5]。另有文献报道,依达拉奉可使大鼠组织中MDA、 TNF-α水平降低,肝内iNOS含量降低,起到保护肝脏的目的[6]。依达拉奉可能通过减轻自由基对细胞膜糖类及脂质的直接破坏作用,对细胞膜内外蛋白质损伤程度及对细胞核酸的破坏作用,来维持细胞生命周期的稳定,提高抗氧化酶活性。在吸入性损伤的发病过程中,上述破坏作用很重要,所以笔者认为依达拉奉可能对吸入性损伤具有肺保护作用。
本实验HE病理切片显示致伤各组大鼠肺泡间隔不均,肺泡形态极不规则,大量炎症细胞浸润,表明烟雾致伤模型制作成功。吸入性损伤可延长通气时间,容易继发感染,使死亡率增加[7]。吸入性损伤使巨噬细胞过度刺激产生大量氧自由基、IL-6、TNF-α等,致肺毛细血管通透性增加,肺水肿程度加重[8]。另外,吸入性损伤使中性粒细胞等炎症细胞产生释放IL-6、TNF-α等多种炎性介质及细胞因子,使血管通透性增高,渗出增多,小气道阻塞,使肺水肿程度进一步加重[9]。血浆中IL-6在炎症性疾病中被视为预示多脏器功能衰竭及死亡的重要标志[10]。本实验通过血清TNF-α和IL-6水平,来间接反映肺组织炎性损伤的程度。根据相关文献报道[11],采用腹腔注射依达拉奉9mg/kg作为实验剂量。实验结果显示,B、C、D组血清IL-6、TNF-α水平较A组升高,其中C组较B组水平有所降低,D组又较C组低。提示依达拉奉对吸入性肺损伤有保护作用。
吸入性损伤刺激自身抗氧化机制启动,使生理状态下就存在于体内的超氧化物歧化酶SOD活性增加,其活性的高低表示机体抑制氧自由基能力的强弱。通过检测MDA(又称脂质过氧化物酶)的活性高低可间接反映组织受自由基攻击导致脂质过氧化的程度[12]。NO是一种致炎因子,少量的内源性的NO能使血管扩张,改善微循环,能对肺组织起保护作用;但过量的NO会导致巨噬细胞释放炎性介质,进一步导致呼吸爆发,损伤肺组织[13]。肺组织中的iNOS的表达能影响NO的生成,并且提高SOD的活性及减少其消耗,能有效地发挥肺保护作用,本实验通过检测NO及iNOS的活性高低反映组织受损伤的程度[14]。实验结果显示,B、C、D组肺组织MDA、NO、iNOS水平较A组明显升高,SOD水平平均降低。肺组织MDA、NO、iNOS水平C组和D组较B组低,D组又较C组低,SOD水平C组和D组较B组高,D组又较C组高。病理显示B、C、D组肺泡结构不清晰,大量红白细胞浸润,其中B组损伤最严重,C组与D组损伤较B组轻,D组损伤程度又小于C组。所有结果显示依达拉奉不仅减低了由烟雾吸入性损伤引起的促炎因子IL-6、TNF-α水平,还能降低MDA、iNOS、NO的水平,更能提高具有抗氧化功能的SOD的水平,肺泡结构及炎症细胞浸润程度也明显减轻,说明依达拉奉在抑制炎症因子的过程中及抗氧化作用中起了重要作用。
本实验研究证明,依达拉奉可能通过抑制自由基和部分炎症介质的产生和释放减轻烟雾吸入性肺损伤大鼠体内炎性反应,对肺组织起到一定的保护作用。但在给药方式、用药浓度和用药时机的选择上还需深入研究。
(本文图1~4见封三)
[1] Yang T,Zhang J,Sun L,et al.Combined effects of a neutrophil elastase inhibitor(sivelestat sodium)and a free radical scavenger (edaravone)on lipopolysaccharide-induced acute lung injury in rats[J].Inflamm Res,2012,61(6):563
[2] 潘佳容,肖志辉.依达拉奉对新生鼠高氧肺损伤的影响[J].中国实用儿科杂志,2007,22(1):49
[3] 谢尔凡,杨宗城,王孰.大鼠烟雾吸入性损伤模型的制作[J].中国实验动物学杂志,1994,4(4):219
[4] Kikuchi K,Kawahara K I,Uchikado H,et al.Potential of edaravone for neuroprotection in neurologic diseases that do not involve cerebral infarction[J].Exp Ther Med,2011,2(5):771
[5] Tomatsuri N,Yoshida N,Takagi T,et al.Edaravone,a newly developed radical scavenger,protects against ischemia-reperfusion injury of the small intestine in rats[J].Int J Mol Med,2004,13(1):105
[6] Tsuji K,Yoshida H,Kwon A H,et a1.Free radical scavenger(edaravone)prevents endotoxin-induced liver injury after partial hepatictomy in rats[J].J Hepatol,2005,42(1):94
[7] Kabalak A A,Yast A C.Management of inhalation injury and respiratory complications in Burns Intensive Care Unit[J].Ulus Travma Acil Cerrahi Derg,2012,18(4):333
[8] 郭宏伟,王武军,廖崇先,等.米力农雾化吸入、静脉泵人对体外循环肺损伤的预防效果及机制探讨[J].山东医药,2011,51(38):6
[9] Toon M H,Maybauer M O,Greenwood J E,et al.Management of acute smoke inhalation injury[J].Crit Care Resusc,2010,12(1):53
[10]Enkhbaatar P,Wang J,Saunders F,et a1.Mechanistic aspects of inducible nitric oxide synthase-induced lung injury in burn trauma[J].BURNS,2011,37(4):638
[11]Koizumi T,Tanaka H,Sakaki S,et al.The therapeutic efficacy of edaravone in extensively burned rats[J].Arch Surg,2006,141(10): 992
[12]姜凯丽,张锡刚.活性氧在急性肺损伤/急性呼吸窘迫综合征中的作用[J].中华损伤与修复杂志(电子版),2010,5(2):249
[13]Pham H,Vottier G,Pansiot J,et al.Inhaled NO protects cerebral white matter in neonatal rats with combined brain and lung injury [J].Am J Respir Crit Care Med,2012,185(8):897
[14]Zhu T,Guan X,Zhang W,et al.Dehydroandrographolide succinate inhibits oxidative stress in mice with lipopolysaccharide-induced acute lung injury by inactivating iNOS[J].Nan Fang Yi Ke Da Xue Xue Bao,2012,32(9):1238

