缺氧诱导神经干细胞凋亡作用机制研究
罗素慧,张绪梅,黄国伟
(天津医科大学公共卫生学院营养与食品卫生教研室,天津300070)
脑血栓、脑梗死、脑血管痉挛等缺血缺氧性脑损伤在临床上常见,其发病率、致残率和致死率均较高。尤其是发生于宫内和新生儿期的缺血缺氧性脑损伤,是造成脑瘫、癫痫及智力低下的重要原因。近年来研究表明,神经细胞凋亡在脑缺血缺氧损害中发挥着重要作用,是缺血缺氧性脑损伤的重要机制之一[1]。有研究报道,低氧促进神经干细胞(NSCs)的存活增殖,长期缺氧则诱导NSCs的凋亡[2]。目前,缺血缺氧对NSCs凋亡影响的机制尚不清楚。本实验将通过体外分离培养新生SD大鼠的海马NSCs,探讨缺氧对NSCs凋亡的影响及分子机制,为临床预防和治疗缺血性脑病提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 24h内同窝新生SD大鼠,购自中国人民解放军军事医学科学院实验动物中心。
1.1.2 主要试剂 DMEM培养液、L-谷氨酰胺;F12和B27添加剂(美国Gibco公司);碱性成纤维细胞生长因子(basic fibroblast growth facter,bFGF)、表皮生长因子(epidermal growth factor,EGF,Perotech公司);山羊抗小鼠IgG、山羊抗兔IgG/辣根酶标记,兔抗大鼠多克隆抗体Caspase-3(北京中杉金桥科技公司);小鼠抗Bcl-2,小鼠抗Bax多克隆抗体(Cell signaling technology公司);小鼠抗大鼠单克隆抗体βactin IgG、ECL发光试剂盒(Santa Cruz公司);BCA蛋白定量试剂盒(武汉博士德生物公司);Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物科技公司);Rhodamine123(Sigma公司)。
1.1.3 仪器 3111型CO2水套培养箱(Thermoelectroncorporation,美国),VD-1320型超净工作台(哈尔滨市东联电子技术公司),低温高速离心机(Sigma),DYY-III8A稳压稳流定时电泳仪(北京六一仪器厂),BD FACSCalibur流式细胞仪(美国Becton-Dickin-son公司),DYCZ-40D型迷你转移槽(北京六一仪器厂),化学发光凝胶成像系统(美国MLTRA.LUM. Inc)。
1.2 方法
1.2.1 NSCs原代分离、培养 将新生SD大鼠用75%酒精浸泡15s,快速在超净台中取出脑组织,用手术镊分离大脑半球,分离大脑皮层取出海马,放入盛有HBSS缓冲液的无菌培养皿中,并用HBSS缓冲液洗2遍,DMEM/F12培养液洗一遍,剪碎成0.5mm×0.5mm小块,用玻璃吸管反复吹打,细胞筛网(0.76μm)过滤,制成细胞悬液。将细胞悬液离心(800r/min)5min,去除上清液,加入培养液(DMEM/F12、EGF 20μg/L、bFGF 20μg/L、L-谷氨酰胺2mmol/L、2%B27、青霉素和链霉素100U/mL),细胞计数,以5×105/mL的密度接种于培养瓶。置37℃、5%CO2孵育箱中培养,隔天换液,倒置显微镜下观察。
1.2.2 分组情况 将分离出的新生鼠NSCs分为2组:正常对照(NC)组、缺氧模型(Hyp)组。
1.2.3 缺氧模型建立 正常条件下(37℃、5%CO2)培养NSCs,于增殖第3天,将缺氧组细胞放入三气培养箱进行缺氧培养,通过调整N2的浓度而设定所需O2的浓度(37℃,5%CO2、94%N2、1%O2),6h后取出放回CO2培养箱继续培养,收集第6天细胞。
1.2.4 采用AnnexinV/PI双标记流式细胞仪检测NSCs凋亡率 收集缺氧后第6天的NSCs,采用机械吹打法吹打成单个细胞,分别置15mL离心管中,1000r/min离心5min,弃上清,用4℃PBS重悬细胞并计数细胞密度,细胞数目达106~107/mL。取1mL细胞悬液,用4℃PBS洗涤两次,重悬于500μL结合液(Binding Buffer)中,加入5μL FITC标记的AnnexinV,于25℃避光孵育30min,再加入5μL PI,室温避光染色5min。在1h内进行流式细胞仪分析,同时以不加AnnexinV-FITC及PI的1管单细胞悬液作为阴性对照。激发波长480nm,计数104个细胞,数据经Cell Quest软件分析处理,记录位于右下象限的AnnexinV阳性、PI阴性细胞数的百分比,即细胞早期凋亡率。
1.2.5 流式细胞仪测定线粒体跨膜电位 收集缺氧后第6天的NSCs,采用机械吹打法吹打成单个细胞,分别置15mL离心管中,1000r/min离心5min,弃上清,用4℃PBS重悬细胞并计数细胞密度,细胞数目达106~107/mL。取1mL细胞悬液,PBS洗涤,用新鲜培养基重悬细胞,加入Rhodamine1230.5μL (终浓度为0.5μmol/L),于37℃避光孵育30min,再用PBS洗细胞3次,留细胞悬液1mL,过200目尼龙网。流式细胞仪FL1通道检测聚集在细胞质中的绿色荧光单体。同时以不加Rhodamine123的1管单细胞悬液做为阴性对照,计数104个细胞,在流式细胞仪上用Cell Quest软件分析,绘制线粒体膜电位变化的平均荧光值分布图。其中横坐标为线粒体膜电位的平均荧光值的对数值,纵坐标为细胞体积。
1.2.6 Western blot检测缺氧NSCs凋亡相关蛋白Caspase-3和Bcl-2、Bax的表达 用Western-blot技术,将蛋白上清液与上样缓冲液按5∶1的比例混合,100℃变性5min,冷却后离心上样。10%聚丙烯酰胺凝胶上电泳分离蛋白,电转至硝酸纤维素膜上。用5%脱脂奶粉室温封闭2h,一抗1∶1000稀释,4℃摇床孵育过夜,TBST(Tris-buffered saline Tween-20)漂洗5次,每次5min。二抗1∶10000稀释。室温摇床孵育2h,TBST漂洗3次,每次15min。化学发光,凝胶成像系统照相。
1.3 统计分析 采用SPSS 16.0软件包处理数据,数据以±s的形式表示,均数间两两比较采用t检验,检验水准α=0.05。
2 结果
2.1 缺氧对NSCs凋亡率的影响 缺氧处理后,收集第6天的NSCs,经流式细胞术检测NSCs的凋亡率,图1A、B分别为NC组和Hyp组的流式细胞术检测结果(图1)。对两组结果进行统计学分析,缺氧处理组细胞早期凋亡率增加,且差异有统计学意义(P<0.05),见图1C。
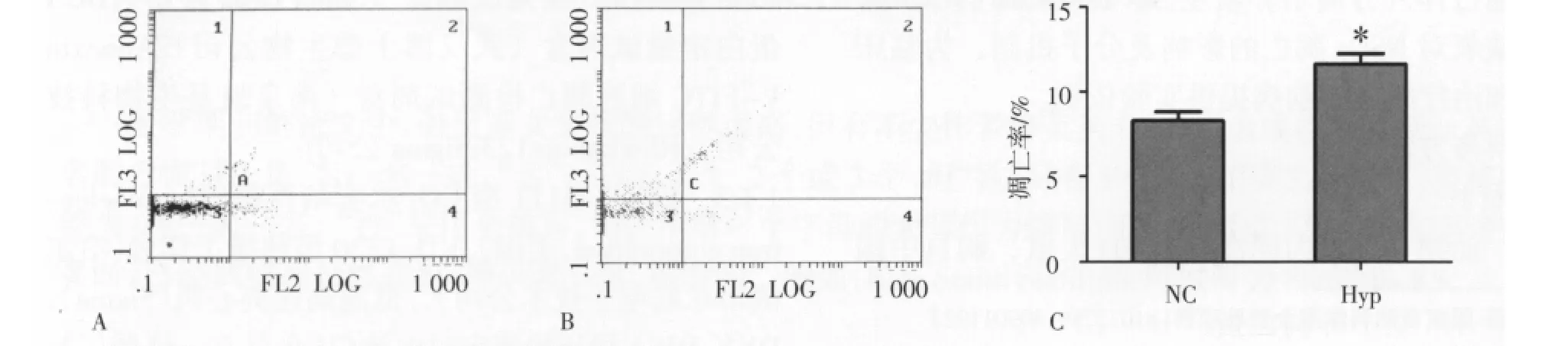
图1 AnnexinV/PI双标记流式细胞仪检测NSCs凋亡率Fig 1 The apoptotic rate of NSCs detected by FCM
2.2 缺氧对NSCs线粒体跨膜电位的影响 图2中A,B分别为线粒体跨膜电位结果。和正常对照组比较,缺氧处理组细胞荧光强度下降,线粒体跨膜电位降低,且差异有统计学意义(P<0.05),见图2C。

图2 流式细胞仪测定NSCs线粒体跨膜电位的变化Fig 2 The mitochondrial trans-membrane potential of NSCs
2.3 缺氧对NSCs凋亡相关蛋白Caspase-3活性表达的影响 用Western blot检测Caspase-3表达。结果表明:缺氧处理后Hyp组Caspase-3活性表达高于NC组,差异有统计学意义(P<0.05),见图3。
2.4 缺氧对NSCs线粒体通路凋亡相关蛋白Bcl-2、Bax蛋白表达的影响 统计分析结果显示:缺氧处理后Hyp组中抑凋亡蛋白Bcl-2的表达低于NC组,而促凋亡蛋白Bax的表达高于NC组,且差异有统计学意义(P<0.05),见图4。
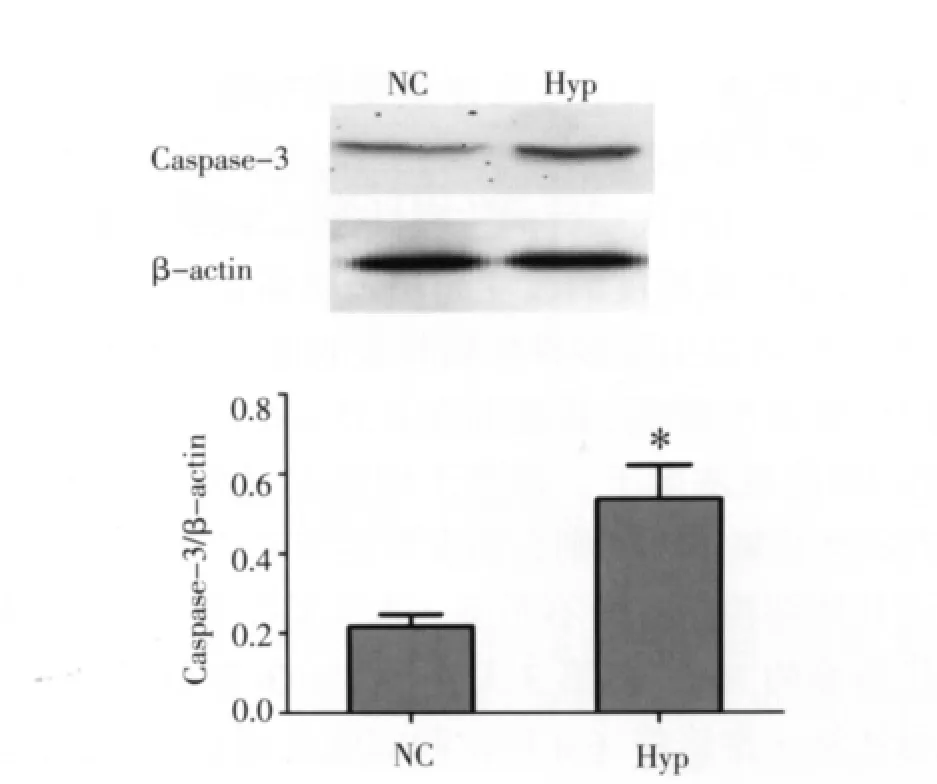
图3 Western blot检测Caspase-3表达Fig 3 The expression of Caspase-3detected by Western blot
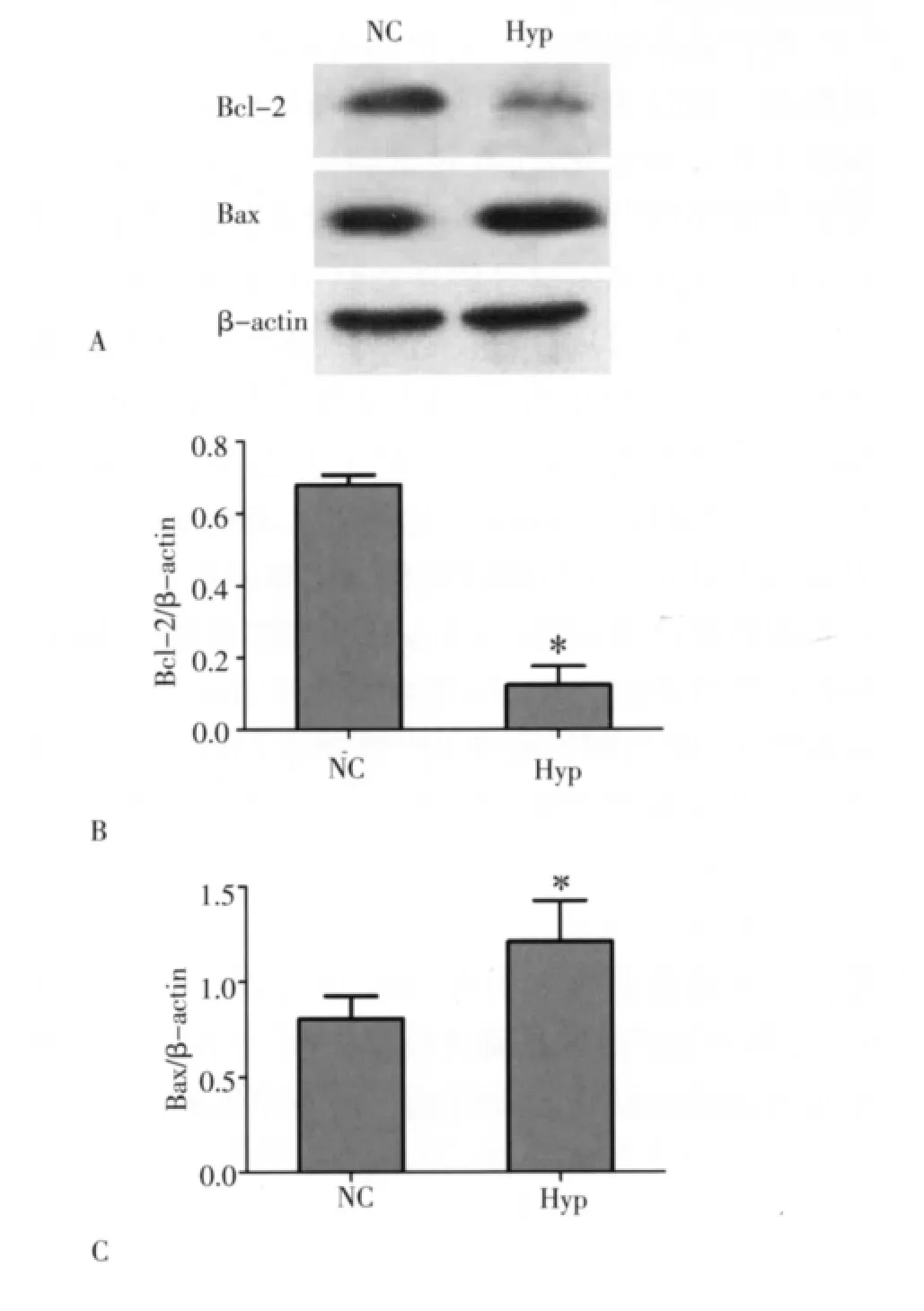
图4 Western blot检测Bcl-2和Bax活性表达Fig 4 The expression of Bcl-2and Bax detected by Western blot
3 讨论
NSCs在神经发育和修复受损神经中发挥重要作用,是当前神经科学领域的研究热点,其凋亡是一个非常复杂的过程,受到内外环境中众多调节因子的调节,组成复杂的调控网络,但其确切调控机制尚不明确。氧作为机体重要的病理生理调节因素,其浓度的改变可以影响生命过程,轻度缺氧可通过机体自身代偿性的生理性调节,减轻对机体的损伤,如果氧浓度的改变超出了机体正常生理代偿的范围,可以引发多种疾病和衰老退变[3]。脑组织间隙中氧水平较低,其范围在0.55%~8%,研究发现,在5%的氧浓度下,神经干细胞表现增殖增加,而在<1%的氧浓度下则会诱发神经细胞的凋亡[4],但凋亡具体调控机制尚不明确。本实验结果显示,将原代培养的NSCs在第3天进行1%O2缺氧处理,6h后恢复正常培养,6d后检测细胞的凋亡率,发现细胞凋亡率升高,且差异有统计学意义,表明缺氧可能诱导NSCs的凋亡,进而影响到因缺血缺氧造成神经损伤的修复。
凋亡是指细胞在一定生理或病理条件下,由基因控制,通过表达特定的RNA和蛋白质介导的细胞自主而有序地死亡,在正常脑发育过程中起着非常重要的作用。细胞凋亡是受高度调控的程序性死亡过程,在众多的信号传导通路中,B细胞淋巴瘤/白血病-2(Bcl-2)蛋白家族在细胞凋亡的线粒体途径中起重要调控作用[5]。Bcl-2家族包括两类蛋白质:一类是抗凋亡蛋白,包括Bcl-2、Bcl-xl、Bcl-w等;另一类是促凋亡蛋白,包括Bax、Bid、Bak等,其中Bcl-2和Bax是目前研究相对比较明确的功能对立的细胞凋亡调控蛋白。Bax是重要的促凋亡蛋白,一种可溶性的蛋白分子,正常情况下Bax蛋白位于细胞质中,但当凋亡发生时,通过增加线粒体膜通透性使其从胞浆转移到线粒体并与线粒体膜相结合[6],形成同源二聚体后被激活,发生构象改变,可引起线粒体大量释放CytC,启动Caspase-3的活化,诱导细胞凋亡;另外,Bax的促凋亡作用能被Bcl-2所抑制。国内外研究资料表明,大鼠海马区神经元对脑缺血缺氧反应敏感,缺血早期即以凋亡、坏死为主,最终导致神经元数目减少,超微结构发生变化,进而影响动物的学习、记忆功能[7-8]。但是,目前缺氧对神经干细胞凋亡的作用机制尚不明确。我们实验发现,缺氧处理后,线粒体通路中抑凋亡蛋白Bcl-2活性表达下降,促凋亡蛋白Bax活性表达升高,从而激活凋亡蛋白Caspase-3表达,故推测缺氧可改变多种凋亡相关蛋白的表达,打破了其动态平衡,从而产生细胞毒性作用,导致神经干细胞的凋亡。
总之,缺氧损伤可激活凋亡蛋白的表达,诱导NSCs凋亡,在缺血性脑病的预防、治疗有一定临床意义。本实验结果为缺血缺氧性胚胎脑损伤的基础和临床研究提供了一定的实验依据,但缺氧对NSCs的更多机制仍有待进一步研究。
[1] TaoufikE,ProbertL.Ischemicneuronaldamage[J].Curr Pharm Des, 2008,14(33):3565
[2] Santilli G,Lamorte G,Carlessi L,et al.Mild hypoxia enhances proliferation and multipotency of human neural stem cells[J].PLoS One,2010,5(1):e8575
[3] Kadenbach B,Ramzan R,Vogt S.Degenerative diseases,oxidative stress and cytochrome c oxidase function[J].Trends Mol Med,2009, 15(4):139
[4] De Filippis L,Delia D.Hypoxia in the regulation of neural stem cells[J].Cell Mol Life Sci,2011,68(17):2831
[5] Hu W,Xie J,Zhao J,et al.Involvement of Bcl-2family in apoptosis and signal pathways induced by cigarette smoke extract in the human airway smooth muscle cells[J].DNA Cell Biol,2008,17(12):13
[6] Middleton G,Cox S W,Korsmeyer S,et al.Differences in Bcl-2-and Bax-independent function in regulating apoptosis in sensory neuron populations[J].Eur J Neurosci,2000,12(3):819
[7] Blomgren K,Leist M,Groc L.Pathological apoptosis in the developing brain[J].Apoptosis,2007,12(5):993
[8] Uchiyama Y,Koike M,Shibata M.Autophagic neuron death in neonatal brain ischemia/hypoxia[J].Autophagy,2008,4(4):404

