重组人血小板生成素与重组人白介素-11治疗脓毒性血小板减少症临床疗效比较
李 艳,王勇强,王 兵
(1.天津医科大学一中心临床学院I C U,天津300192;2.天津市第一中心医院I C U,天津300192)
脓毒症相关的凝血功能紊乱和全身炎症反应常常引起致死性多器官功能不全。血小板在脓毒症中是联系凝血和炎症反应的关键性物质。研究发现脓毒症患者会出现血小板减少,而血小板进行性下降往往提示患者存在严重脓毒症并预后差。如何有效地改善脓毒症相关性血小板减少,已日益引起了临床医师的关注。近年来有多种血小板生成因子应用于临床,重组人血小板生成素(rhTPO)和重组人白介素-11(rhIL-11)是其中比较常见的两种。国内外一些研究关于rhTPO和rhIL-11在治疗放、化疗后血小板减少,慢性难治性血小板减少性紫癜等非感染性疾病导致的血小板减少症方面显示出较好的效果[1-2]。但将其用于纠正脓毒症相关性血小板减少,国内外少有报道。本研究旨在将上述两种药物应用于脓毒症相关性血小板减少的患者,观察两种药物临床疗效。
1 资料与方法
1.1 研究对象 脓毒症诊断标准:依照2001年国际脓毒症定义会议关于脓毒症诊断标准[3]。将外周血血小板计数≤50×109/L的患者为血小板减少症收入标准。排除条件:恶性肿瘤;6个月内接受过免疫调节剂治疗;年龄≥75岁或≤14岁;心肺复苏后;入院24h内转出或死亡;终末期肝或肾功能衰竭;血液系统疾病及放化疗后;用药前两周应用抗凝药物的患者。选择2010年1月-2011年12月入住天津市第一中心医院ICU符合入组条件的脓毒症合并血小板减少的患者76例。其中男41例,女35例。年龄19~74(53.49±17.41)岁。
1.2 分组情况 76例患者根据“不平衡指数最小的分配原则”随机分为对照组20(例),rhTPO组(28例),rhIL-11组(28例)。患者疾病严重程度用急性生理和慢性健康状况评分(APACHEⅡ评分)进行评价。3组患者在性别、年龄、APACHEⅡ评分、血小板基值、原发病种类及构成比、细菌培养菌株种类,经组间两两比较P>0.05,3组患者基线差异无统计学意义,具有可比性。
1.3 治疗方法 3组患者均予以机械通气,根据细菌学培养结果予以敏感抗生素,同时给予化痰,保护胃黏膜,保肝,抗氧自由基,补液等对症治疗。对照组继续上述治疗,不予以升血小板药物。rhTPO组在上述治疗的基础上加用沈阳三生制药生产rhTPO 300U/(kg·d),皮下注射,每日1次;rhIL-11组在保持上述治疗的基础上加用山东齐鲁制药厂生产的rhIL-111.5mg/(kg·d),加灭菌注射用水1mL,皮下注射,每日1次。用药过程中,3组患者血小板计数恢复至100×109/L时或血小板计数绝对值升高≥50×109/L时即停用升血小板药。当血小板低于10×109/L、需行有创操作、急性活动性出血可予以输注血小板治疗。
1.4 记录指标 3组患者每日抽取静脉血,检测血常规、血生化、出凝血时间指标。记录用药后第1、2、3、5、7、9天血小板计数的动态变化;比较用药过程中血小板最低值和最高值;血小板减少的持续时间;血小板及其他血制品的输注情况;药物对肝肾功能、凝血功能、红细胞、白细胞、血红蛋白的影响;药物不良反应;ICU住院天数,随访28d内病死率等情况。
1.5 统计学处理 使用SPSS 17.0软件,对数据进行统计学处理。计量资料结果用±s表示。计量资料行两独立样本t检验,3组间单因素方差分析,组间多重比较采用LSD-t检验。计数资料行χ2检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 用药后3组血小板计数比较 用药后第1、2天,3组血小板计数均有升高趋势,但组间比较差异无统计学意义(P>0.05)(表1)。用药后第3、5、7、9天,3组血小板计数进行性上升,3组血小板计数差异具有统计学意义(表1)。rhTPO组和rhIL-11组血小板数上升幅度明显高于对照组,且rhTPO组显著高于rhIL-11组(P<0.05)。用药期间血小板计数最低值,3组间差异不具有统计学意义(P>0.05)。血小板恢复最高值用药组均明显高于对照组,并且rhTPO组高于rhIL-11组(P<0.05)。rhTPO组血小板计数恢复至>50×109/L及血小板计数恢复到≥100×109/L所需时间较rhIL-11组明显缩短(P<0.05)(表2)。
2.2 血制品输注情况 76例患者中13例患者有自发性出血。其中对照组7例,rhTPO组3例,rhIL-11组5例。3组出血发生率差异无统计学意义(P> 0.05)。分别予以静脉输注血制品,3组患者输注血制品量具有显著差异,用药组均低于对照组(P<0.05)(表3)。rhTPO组输注血小板及其他血制品量少于rhIL-11组。
表1 用药后3组间血小板计数比较(±s,×109/L)Tab 1 The comparison of platelet count in three groups(±s,×109/L)
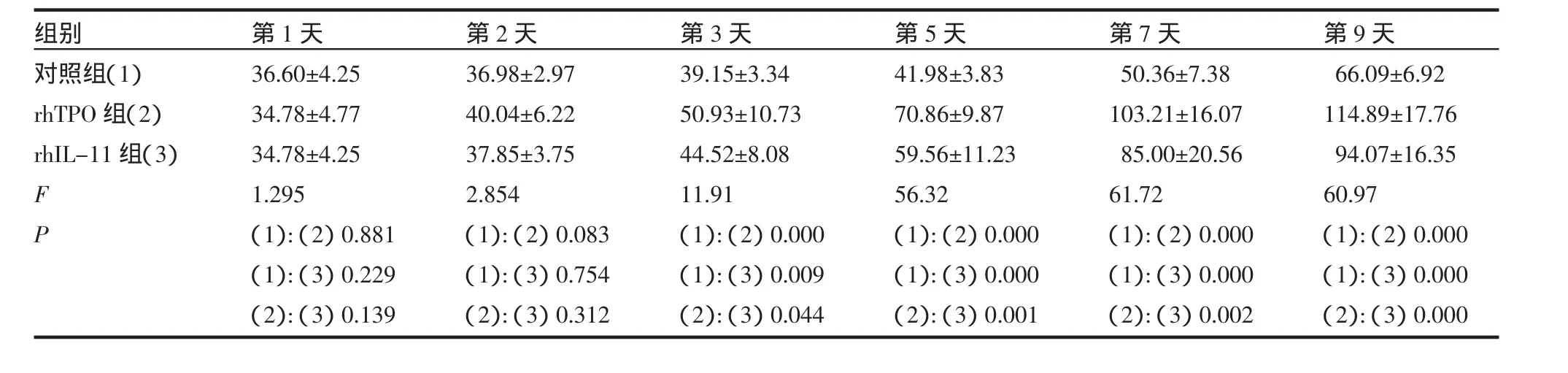
表1 用药后3组间血小板计数比较(±s,×109/L)Tab 1 The comparison of platelet count in three groups(±s,×109/L)
组别对照组(1)rhTPO组(2)rhIL-11组(3)F P第1天36.60±4.2534.78±4.7734.78±4.251.295(1):(2)0.881(1):(3)0.229(2):(3)0.139第2天36.98±2.9740.04±6.2237.85±3.752.854(1):(2)0.083(1):(3)0.754(2):(3)0.312第3天39.15±3.3450.93±10.7344.52±8.0811.91(1):(2)0.000(1):(3)0.009(2):(3)0.044第5天41.98±3.8370.86±9.8759.56±11.2356.32(1):(2)0.000(1):(3)0.000(2):(3)0.001第7天50.36±7.38103.21±16.0785.00±20.5661.72(1):(2)0.000(1):(3)0.000(2):(3)0.002第9天66.09±6.92114.89±17.7694.07±16.3560.97(1):(2)0.000(1):(3)0.000(2):(3)0.000
表2 用药后3组血小板计数恢复天数比较(±s,d)Tab 2 The comparison of platelet count recovery days in three group(±s,d)
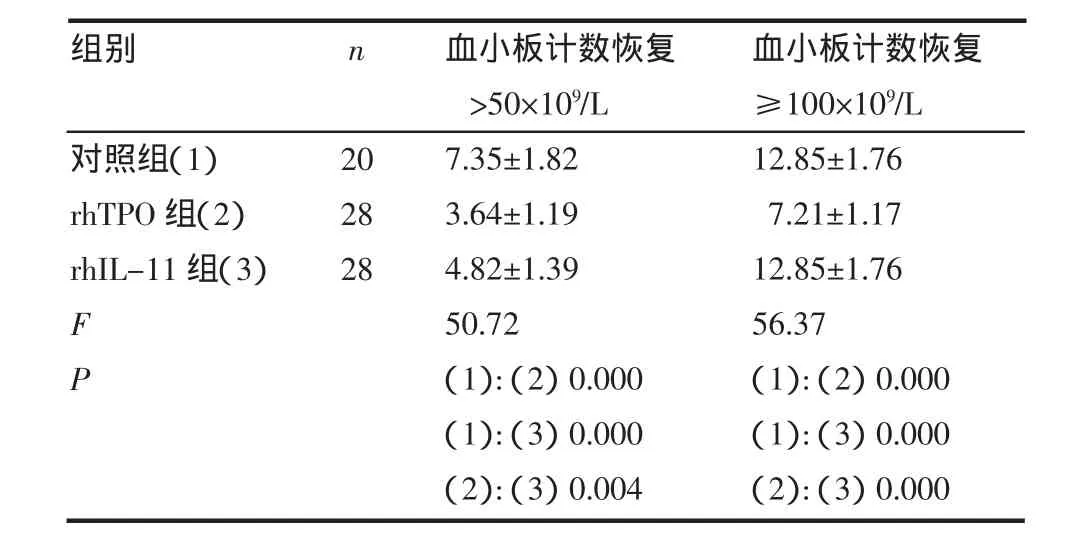
表2 用药后3组血小板计数恢复天数比较(±s,d)Tab 2 The comparison of platelet count recovery days in three group(±s,d)
组别对照组(1)rhTPO组(2)rhIL-11组(3)F P n 202828血小板计数恢复>50×109/L 7.35±1.823.64±1.194.82±1.3950.72(1):(2)0.000(1):(3)0.000(2):(3)0.004血小板计数恢复≥100×109/L 12.85±1.767.21±1.1712.85±1.7656.37(1):(2)0.000(1):(3)0.000(2):(3)0.000
2.3 对肝肾功能、凝血、红细胞、白细胞、血红蛋白的影响 用药前基值及用药后第5、7、9天,对照组、rhTPO组、rhIL-11组对肝肾功能(ALT、AST、 TBil、ALB、Cr)、凝血(PT、APTT)、红细胞(RBC)、白细胞(WBC)、血红蛋白(HB)指标影响差异无统计学意义(P>0.05)(表4、5)。
表3 3组输注血制品情况比较(±s)Tab 3 The comparison of infusion hematic products in three groups(±s)
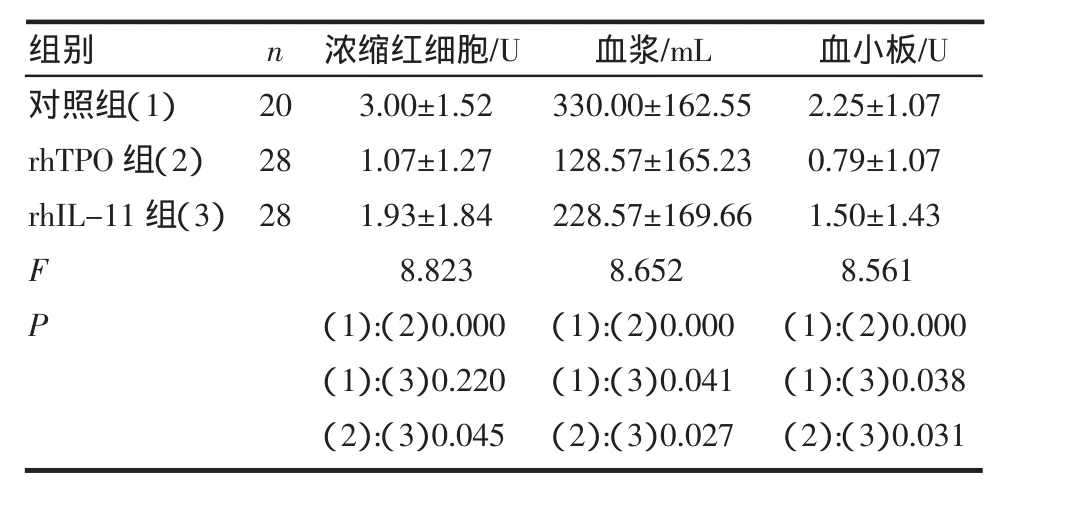
表3 3组输注血制品情况比较(±s)Tab 3 The comparison of infusion hematic products in three groups(±s)
组别对照组(1)rhTPO组(2)rhIL-11组(3)F P n 202828浓缩红细胞/U 3.00±1.521.07±1.271.93±1.848.823(1):(2)0.000(1):(3)0.220(2):(3)0.045血浆/mL 330.00±162.55128.57±165.23228.57±169.668.652(1):(2)0.000(1):(3)0.041(2):(3)0.027血小板/U 2.25±1.070.79±1.071.50±1.438.561(1):(2)0.000(1):(3)0.038(2):(3)0.031
表4 3组WBC、RBC、HB、PT、APTT比较(±s)Tab 4 The comparison of WBC,RBC,HB,PT,APTT in three groups(±s)
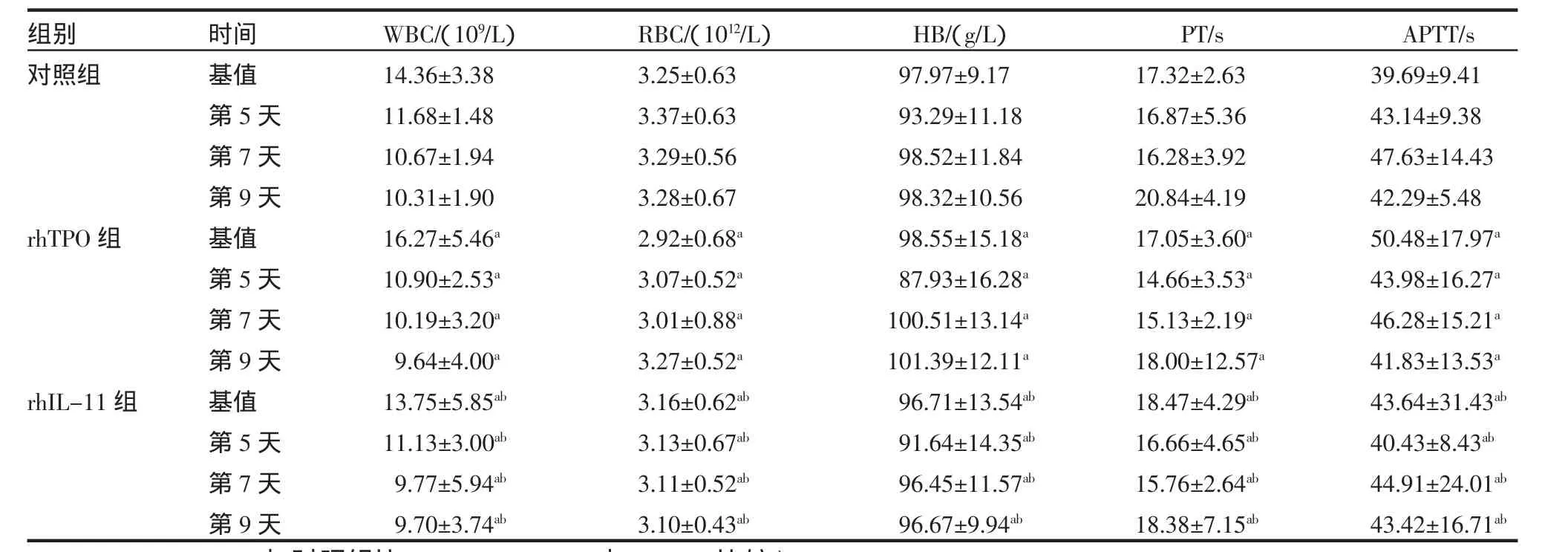
表4 3组WBC、RBC、HB、PT、APTT比较(±s)Tab 4 The comparison of WBC,RBC,HB,PT,APTT in three groups(±s)
rhTPO,rhIL-11与对照组比aP>0.05,rhIL-11与rhTPO比较bP>0.05
组别对照组rhTPO组rhIL-11组时间基值第5天第7天第9天基值第5天第7天第9天基值第5天第7天第9天WBC/(109/L)14.36±3.3811.68±1.4810.67±1.9410.31±1.9016.27±5.46a 10.90±2.53a 10.19±3.20a 9.64±4.00a 13.75±5.85ab 11.13±3.00ab 9.77±5.94ab 9.70±3.74ab RBC/(1012/L)3.25±0.633.37±0.633.29±0.563.28±0.672.92±0.68a 3.07±0.52a 3.01±0.88a 3.27±0.52a 3.16±0.62ab 3.13±0.67ab 3.11±0.52ab 3.10±0.43ab HB/(g/L)97.97±9.1793.29±11.1898.52±11.8498.32±10.5698.55±15.18a 87.93±16.28a 100.51±13.14a 101.39±12.11a 96.71±13.54ab 91.64±14.35ab 96.45±11.57ab 96.67±9.94ab PT/s 17.32±2.6316.87±5.3616.28±3.9220.84±4.1917.05±3.60a 14.66±3.53a 15.13±2.19a 18.00±12.57a 18.47±4.29ab 16.66±4.65ab 15.76±2.64ab 18.38±7.15ab APTT/s 39.69±9.4143.14±9.3847.63±14.4342.29±5.4850.48±17.97a 43.98±16.27a 46.28±15.21a 41.83±13.53a 43.64±31.43ab 40.43±8.43ab 44.91±24.01ab 43.42±16.71ab
表5 3组肝肾功能(ALT、AST、TBil、ALB、Cr)比较(±s)Tab 5 The comparison of ALT,AST,TBil,ALB,Cr in three groups(±s)
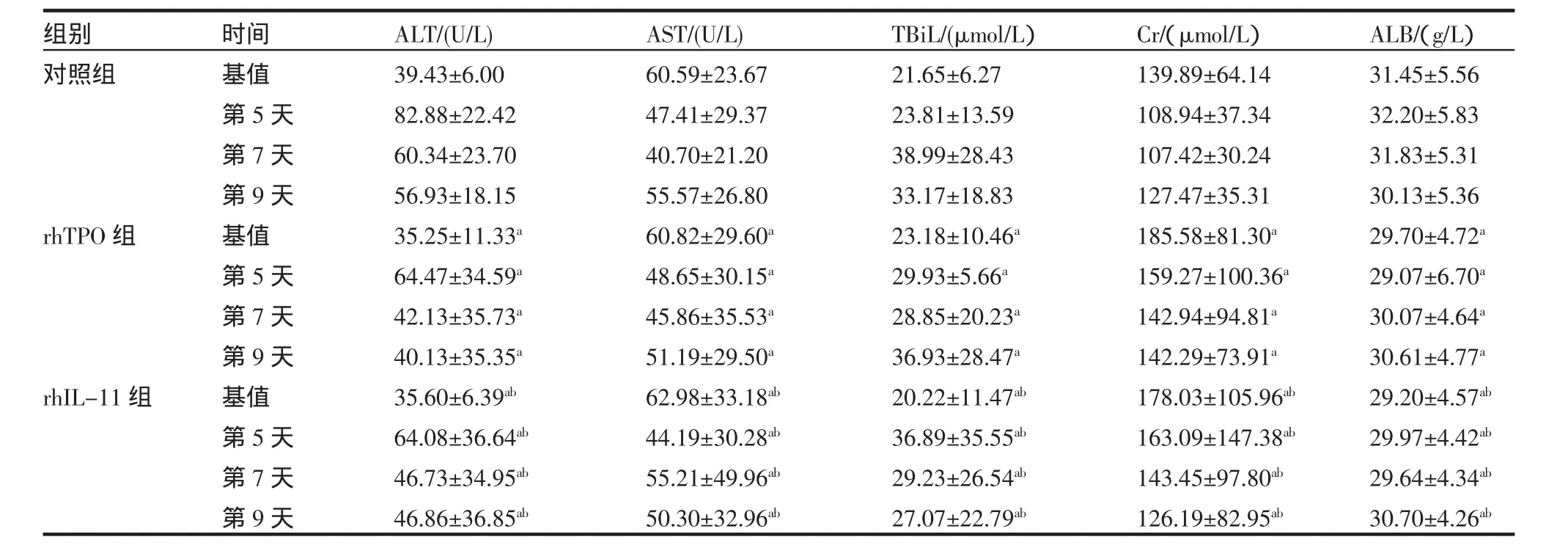
表5 3组肝肾功能(ALT、AST、TBil、ALB、Cr)比较(±s)Tab 5 The comparison of ALT,AST,TBil,ALB,Cr in three groups(±s)
rhTPO,rhIL-11与对照组比aP>0.05,rhIL-11与rhTPO比较bP>0.05
组别对照组rhTPO组rhIL-11组时间基值第5天第7天第9天基值第5天第7天第9天基值第5天第7天第9天ALT/(U/L) 39.43±6.0082.88±22.4260.34±23.7056.93±18.1535.25±11.33a 64.47±34.59a 42.13±35.73a 40.13±35.35a 35.60±6.39ab 64.08±36.64ab 46.73±34.95ab 46.86±36.85ab AST/(U/L) 60.59±23.6747.41±29.3740.70±21.2055.57±26.8060.82±29.60a 48.65±30.15a 45.86±35.53a 51.19±29.50a 62.98±33.18ab 44.19±30.28ab 55.21±49.96ab 50.30±32.96ab TBiL/(μmol/L)21.65±6.2723.81±13.5938.99±28.4333.17±18.8323.18±10.46a 29.93±5.66a 28.85±20.23a 36.93±28.47a 20.22±11.47ab 36.89±35.55ab 29.23±26.54ab 27.07±22.79ab Cr/(μmol/L)139.89±64.14108.94±37.34107.42±30.24127.47±35.31185.58±81.30a 159.27±100.36a 142.94±94.81a 142.29±73.91a 178.03±105.96ab 163.09±147.38ab 143.45±97.80ab 126.19±82.95ab ALB/(g/L)31.45±5.5632.20±5.8331.83±5.3130.13±5.3629.70±4.72a 29.07±6.70a 30.07±4.64a 30.61±4.77a 29.20±4.57ab 29.97±4.42ab 29.64±4.34ab 30.70±4.26ab
2.4 不良反应观察 用药组皮下注射药物后2~8d,rhTPO组患者无不良反应发生。rhIL-11组出现注射局部硬结1例(3.6%),眼结膜出血1例(3.6%),皮疹1例(3.6%),心律失常4例(14.3%),包括窦性心动过速1例(3.6%)、室性早搏2例(7.1%)、阵发性心房颤动1例(3.6%)。rhIL-11组用药前及对照组患者均不存在上述表现,停用该药后上述症状未再出现。
2.53 组患者ICU住院天数,随访28d病死率比较 3组患者ICU住院天数,对照组(12.40±2.68)d,rhTPO组(11.57±2.33)d,rhIL-11组(12.39±2.36)d,3组差异无统计学意义(P>0.05)。随访28d内,对照组死亡11例,病死率55%;rhTPO组死亡5例,病死率17.9%;rhIL-11组死亡6例,病死率21.4%。对照组病死率高于用药两组。但rhTPO组和rhIL-11组之间病死率差异无统计学意义(P>0.05)。
3 讨论
脓毒症是ICU主要致死原因之一,严重脓毒症患者的入院率、病死率更是逐年上升[4]。35%~59%的脓毒症患者可发生血小板减少,血培养阳性的患者血小板下降的发生率高达79.6%[5]。国内有学者研究发现[6],脓毒症血小板减少的患者存在ICU住院时间延长,更大的出血风险和低生存率,血小板计数最低值的恢复与降低病死率相关。重症感染时,病毒或细菌直接抑制骨髓巨核细胞功能或者骨髓受抑制产生血小板抗体导致血小板生成减少或破坏增加;病原体直接破坏血小板或损伤血管内皮细胞,激活凝血系统刺激PAI-1释放、抑制纤溶系统,激活血小板、促进聚集与释放,形成弥漫性血管内凝血,最终导致血小板的大量消耗;病原体或其产物通过免疫途径激活补体导致血小板破坏[7];血小板向肺毛细血管和肝血窦迁移,聚集和扣押导致血小板减少[8]。严重的血小板减少患者可发生内脏器官出血,危及生命,因此积极纠正血小板减少成为临床医师的关键问题。以往予以输注外源性血小板后可产生抗体,降低输注血小板效果,增加血小板输注并发症及血液传播疾病的概率。近年来,刺激巨核细胞生成的正调控因子rhTPO和rhIL-11备受人们关注。rhTPO是由中国仓鼠卵巢细胞表达经提纯而制成的全长糖基化的糖蛋白分子。与内源性血小板生成素有相似的升血小板作用,通过与其特异性受体MPL结合,扩大定向巨核系祖细胞池[9]促进巨核细胞集落形成[10]。全程性参与巨核细胞的分化、成熟并分裂为有活性的血小板。其能诱发扣押在肺毛细血管网的血小板释放[11];具有免疫调节作用,可以改善T淋巴细胞功能[12],通过纠正免疫异常间接降低了血小板大量消耗。rhIL-11最先从灵长类动物骨髓基质细胞株中发现的非特异性造血因子,其也可促进巨核细胞的成熟分化,促进巨核细胞和血小板生成,增加外周血小板的数量[13-14],但对巨核细胞集落形成单位的产生无作用。有研究表明[15]rhIL-11在辅助抗感染方面也有一定的疗效。其可降低肺组织TNF-α,减少中性粒细胞的聚集,改善肺血管舒缩功能障碍,从而减轻了内毒素(脂多糖LPS)所致的肺损伤。有文献报道,其可以阻止大量炎性因子的产生(如TNF-α,IL-12,IL-1,一氧化氮,IL-2)[16]。在内毒素血症动物模型中[17],rhIL-11可以降低血清前炎症细胞因子的释放以及防止低血压的发生,提高革兰阴性杆菌脓毒症和脓毒性休克的存活率。rhTPO在抗炎方面的报道较少,有待进一步研究。
本研究通过与对照组的对比来观察rhTPO和rhIL-11分别用于脓毒症相关性血小板减少症的患者在提升血小板方面的疗效。用药后第3天至第9天用药组患者的血小板数明显高出对照组,rhTPO组较rhIL-11组更能在较短的时间内提升血小板,减少血小板最低值持续时间从而有效地改善血小板减低的状态。考虑rhTPO在短时间里快速动员扣押的血小板进入循环,促进血小板生成的各个阶段的作用更具优势。rhTPO组在输注血小板量上少于rhIL-11组,从而降低了输注血制品所带来的风险。用药过程中肝肾功能、血细胞、凝血指标与对照组比较未见差异,考虑药物本身对上述指标产生影响,但临床观察中笔者发现rhIL-11组中有4例患者频发心律失常,且患者在用药前和停药后心律失常未再发生,同时观察对照组患者均未出现上述症状,因此考虑心律失常与用药有关,可以认为在用药安全性上rhTPO优于rhIL-11。以上研究表明脓毒症相关性血小板减少的患者在积极控制感染等综合治疗的基础上加用rhTPO或rhIL-11,通过与对照组的比较发现两种升血小板药物在提升血小板数量上均起到较好的效果,但rhTPO在升血小板速度、幅度及安全性方面较rhIL-11更具优势。本研究存在样本量偏小、单中心等不足,希望能在不久的将来,进行多中心、大样本的临床研究,深入探讨这两种血小板生成因子在抗炎方面对血小板的影响,从而为脓毒症血小板减少症的纠正提供新的思路。
[1] 白春梅,邹晓阳,赵永强,等.重组人血小板生成素治疗化疗诱导的重度血小板减少的临床研究[J].中华医学杂志,2004,84(5):397
[2] Bhatia M,Davenport V,Cairo M S.The role of interleukin-11to prevent chemotherapy-induced thrombocytopenia in patients with solid tumors,lymphoma,acute myeloid leukemia and bone marrow failure syndromes[J].Leuklymphama,2007,48(1):9
[3] 2001年国际脓毒症定义会议.关于脓毒症诊断的新标准[J].中国危重病急救医学,2006,18(11):645
[4] Dombrovskiy V Y,Martin A A,Sunderram J,et al.Rapid increase in hospitalization and mortality rates for severe sepsis in the United States:a trend analysis from 1993to 2003[J].Crit Care Med,2007, 35(5):1414
[5] 高红梅,王兵,李寅,等.重组人血小板生成素治疗脓毒症血小板减少症[J].中华急诊医学杂志,2011,20(3):239
[6] 王兵,韩鹦赢,李红洁,等.危重患者血小板减少症发病危险因素及预后分析[J].中国急救医学,2008,28(12):1072
[7] Cines D B,Bussel J B,Liebman H A,et al.The ITP syndrome: pathogenic and clinical diversity[J].Blood,2009,113(26):6511
[8] Andonegui G,Kerfoot S M,McNagny K,et al.Platelets express functional Toll-like receptor-4[J].Blood,2005,106(7):2417
[9] Borge O J,Ramsfjell V,Veiby O P,et al.Thrombopoietin but not erythropoietin promotes viability and inhibits apoptosis of multipotent murinehematopoietic progenitor cells in vitro[J].Blood,1996, 88(8):2859
[10]Kaushansky K,Lok S,Holly R D,et al.Promotion of megakaryocyte progenitor expansion and differentiation by the c-MPL ligand thrombopoietin[J].Nature,1994,369(6481):568
[11]莫姝,杨默,于洁,等.血小板生成素及其受体的新作用[J].中国小儿血液与肿瘤杂志,2006,11(2):89
[12]Xie C G,Wang J F,Xiang Y,et al.Marrow mesenchymal stem cells transduced with TPO/FL genes as support for ex vivo expansion of hematopoietic stem/progenitor cells[J].Cell Mol Life Sci,2005,10(18):423
[13]吴伟,邢月明,宋翔.动态监测巨合粒治疗化疗引起的血小板减少症[J].中华肿瘤防治杂志,2006,6(13):957
[14]孙黎,方芳,赖伏英,等.重组人白介素-11对人骨髓细胞生长的影响[J].中国新药杂志,2010,10(7):510
[15]沈继春,石莹,王素莉,等.巨和粒对院内肺感染所致血小板减少患者血小板恢复时间的影响[J].临床血液学杂志,2010,23(6):340
[16]Cotreau M M,Stonis L,Strahs A et,al.Amultiple-dose,safety,tolerability,Pharmacokinetics and pharmacodynamics study of oral recombinant human interleukin-11(opreluekin)[J].Biopharm Drug Dispos,2004,25(7):291
[17]宗丹丹,曹书华,王勇强.重组人白细胞介素-11治疗脓毒症相关性血小板减少症的疗效观察[J].中国急救医学杂志,2011,31(11):975

