2011年中国CHINET不动杆菌属细菌耐药性监测
张 辉 ,张小江,徐英春,杨 青,汪 复,朱德妹,倪语星,孙景勇,孙自镛,简 翠,胡云建 艾效曼张 泓,李万华,贾 蓓,黄文祥,王传清,薛建昌,魏莲花0,吴 玲0,卓 超,苏丹虹,张朝霞,季 萍,徐元宏,沈继录,单 斌,杜 艳,俞云松,林 洁
细菌耐药性监测可以帮助我们了解细菌耐药性的变迁、耐药菌株的流行情况,从而指导临床合理使用抗菌药物。现将2011年中国CHINET细菌耐药性监测网收集的临床分离的不动杆菌属细菌对抗菌药物的耐药性监测结果报道如下。
材料与方法
一、材料
(一)菌株来源 收集2011年1—12月从中国不同地区15所医院临床分离的不动杆菌属细菌6 723株(剔除同一患者相同部位重复分离株),其中鲍曼不动杆菌5 958株,各医院按常规操作规程将菌株鉴定到种,并记录菌株的相关临床信息。
(二)培养基和抗菌药物 药敏试验用MH琼脂培养基。抗菌药物纸片为美国BBL公司或英国OXOID公司产品。抗菌药物品种详见结果部分表格。
二、方法
(一)药敏试验 按CLSI[1]推荐的纸片扩散法进行药敏试验,部分医院采用自动化仪器进行,以大肠埃希菌ATCC 25922和铜绿假单胞菌ATCC 27853为药敏试验质控菌株。
(二)药敏结果的判读和数据分析 按2012年版CLSI标准判读药敏结果,采用WHONET5.6版本统计分析数据。头孢哌酮-舒巴坦的判定标准参照头孢哌酮对肠杆菌科细菌的折点,替加环素对鲍曼不动杆菌的判定标准采用FDA标准,即S≥16 mm,R≤12 mm。
结果
一、菌种分布
共收集不动杆菌属细菌6 723株,其中鲍曼不动杆菌占88.6%(5 958/6 723),菌种分布见表1。
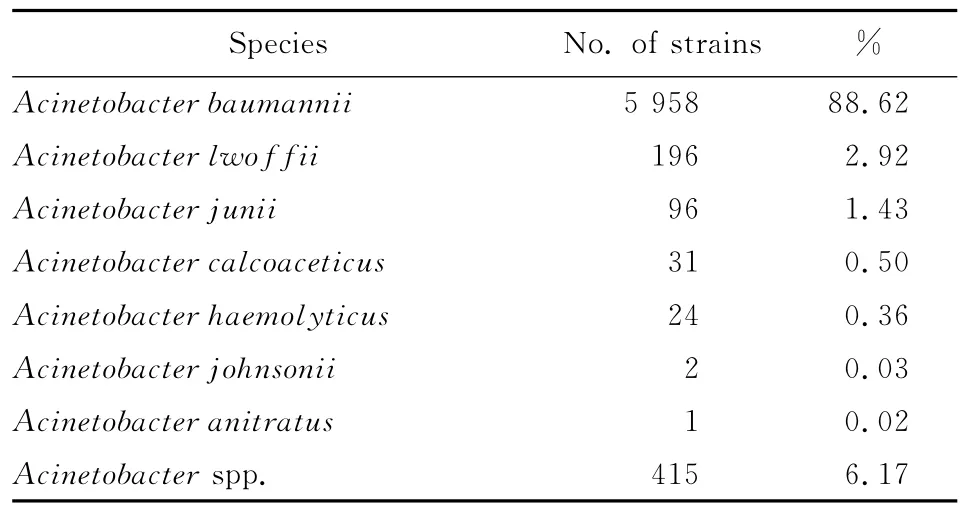
表1 2011 CHINET耐药监测不动杆菌属菌种分布Table 1 Distribution of Acinetobacter species in 2011 CHINET antibiotic resistance surveillance program
二、标本分布
6 723株不动杆菌属细菌分离自呼吸道标本占75.6%(5 084/6 723),伤口脓液占7.5%(501/6723),尿液标本占4.4%(294/6 723),血液标本占3.9%(261/6 723),脑脊液标本占1.3%(85/6723),胸、腹水等无菌体液标本占4.9%(330/6 723)。
三、科室分布
6 723株不动杆菌属细菌中,分离自住院患者6 003株,占89.3%,分离自门急诊患者720株,占10.7%。ICU占33.9%(2 279/6 723),内 科 占29.3%(1 972/6 723),外 科 占21.0%(1 414/6 723),急诊科占6.1%(412/6 723),儿科占1.0%(68/6 723)。
四、不动杆菌属细菌对抗菌药物的药敏试验结果
5 958株鲍曼不动杆菌对米诺环素和头孢哌酮-舒巴坦耐药率较低,分别为31.1%和43.4%,其次为阿米卡星(52.4%)和左氧氟沙星(59.6%),而对其他所检测的抗菌药物的耐药率均高于60.0%,对亚胺培南和美罗培南的耐药率分别为65.2%和66.2%,见表2。受试的313株鲍曼不动杆菌对替加环素的耐药率较低,为13.4%。196株洛菲不动杆菌对所有监测抗菌药物的耐药率均低于鲍曼不动杆菌,除对头孢噻肟的耐药率为60.1%外,对其余抗菌药物的耐药率均低于50.0%。
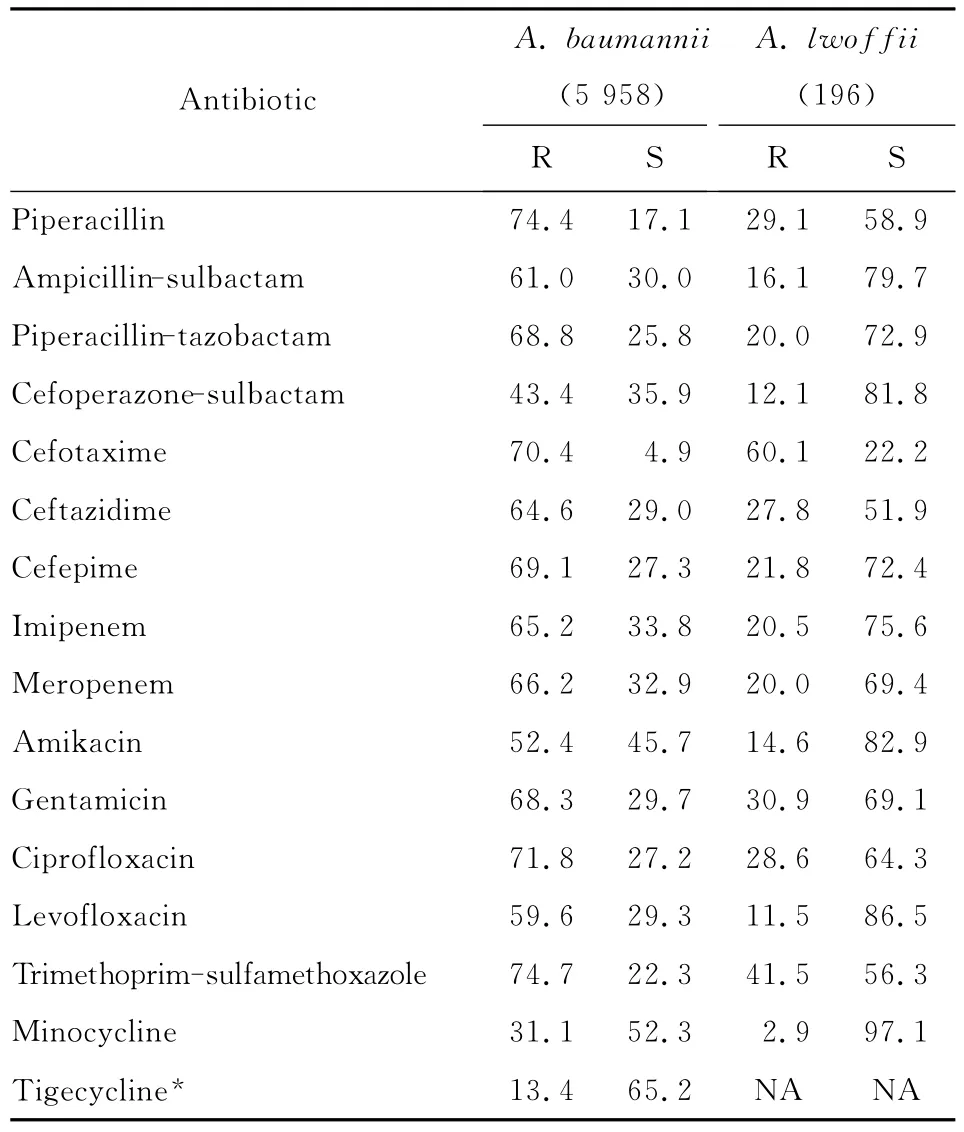
表2 5 958株鲍曼不动杆菌和196株洛菲不动杆菌对抗菌药物的耐药率和敏感率(%)Table 2 Resistance and susceptibility rates of A.baumanii(5 958)and A.lwoffii(196)to antimicrobial agents(%)
不同地区、不同医院的鲍曼不动杆菌分离株对抗菌药物的耐药率有较大差异,见表3。如有2所医院的分离株对大部分受试的抗菌药物的耐药率低于50.0%,并低于其他13所医院。有2所医院的分离株对头孢哌酮-舒巴坦的耐药率分别为9.3%和2.6%,是15所医院中最低者;但有7所医院分离菌对该药的耐药率较高,为48.6%~70.4%;另外6所医院的分离菌对该药的耐药率为26.1%~36.0%。有3所医院的分离菌对米诺环素的耐药率较高,分别为37.4%、42.3%和62.0%。15所医院中鲍曼不动杆菌分离株对亚胺培南和美罗培南的耐药率最低者分别为28.3%和33.9%,但多所医院分离株对碳青霉烯类抗生素耐药率均>60.0%。有6所医院的分离株对阿米卡星的耐药率比较低(<35.2%),多所医院分离株对阿米卡星的耐药率近50.0%或以上。
5 958株鲍曼不动杆菌中,多重耐药(MDR)和泛耐药(PDR)菌株的平均检出率分别为51.7%和27.4%,但不同医院的检出率也有很大差异。其中,PDR检出率最高的医院为43.6%,有3所医院的检出率低,分别为4.4%、1.0%和0.5%,其他的医院为15.5%~42.3%;而MDR的检出率最高为69.2%,最低为9.6%,其他的医院为28.8%~67.6%。见表4。3 081株MDR鲍曼不动杆菌和1 635株PDR鲍曼不动杆菌中,分离自ICU的最多,分别占40.8%和41.7%;其次为外科,分别为23.3%和22.2%。
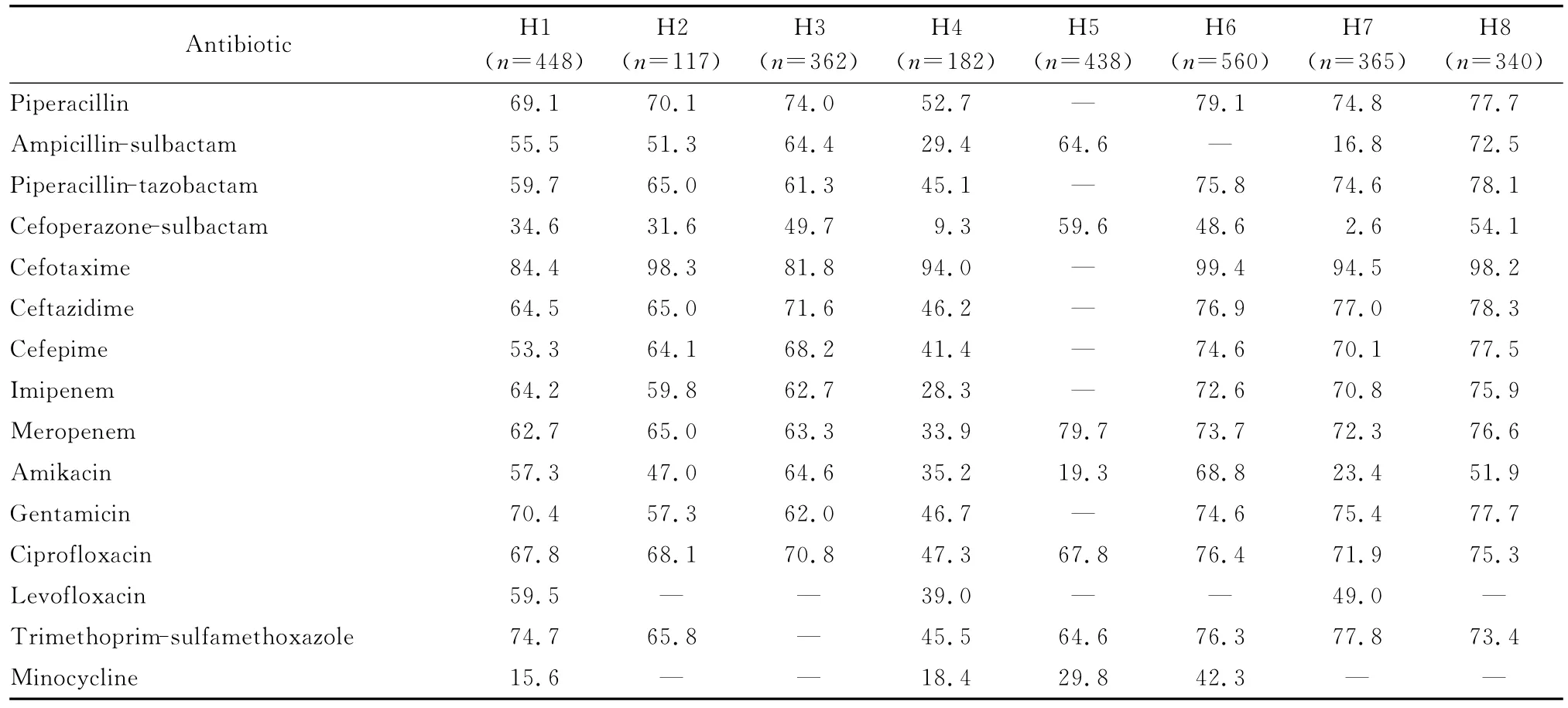
表3 各医院鲍曼不动杆菌对抗菌药物的耐药率(%)Table 3 Resistance rates of A.baumannii to antimicrobial agents in different hospitals(%)
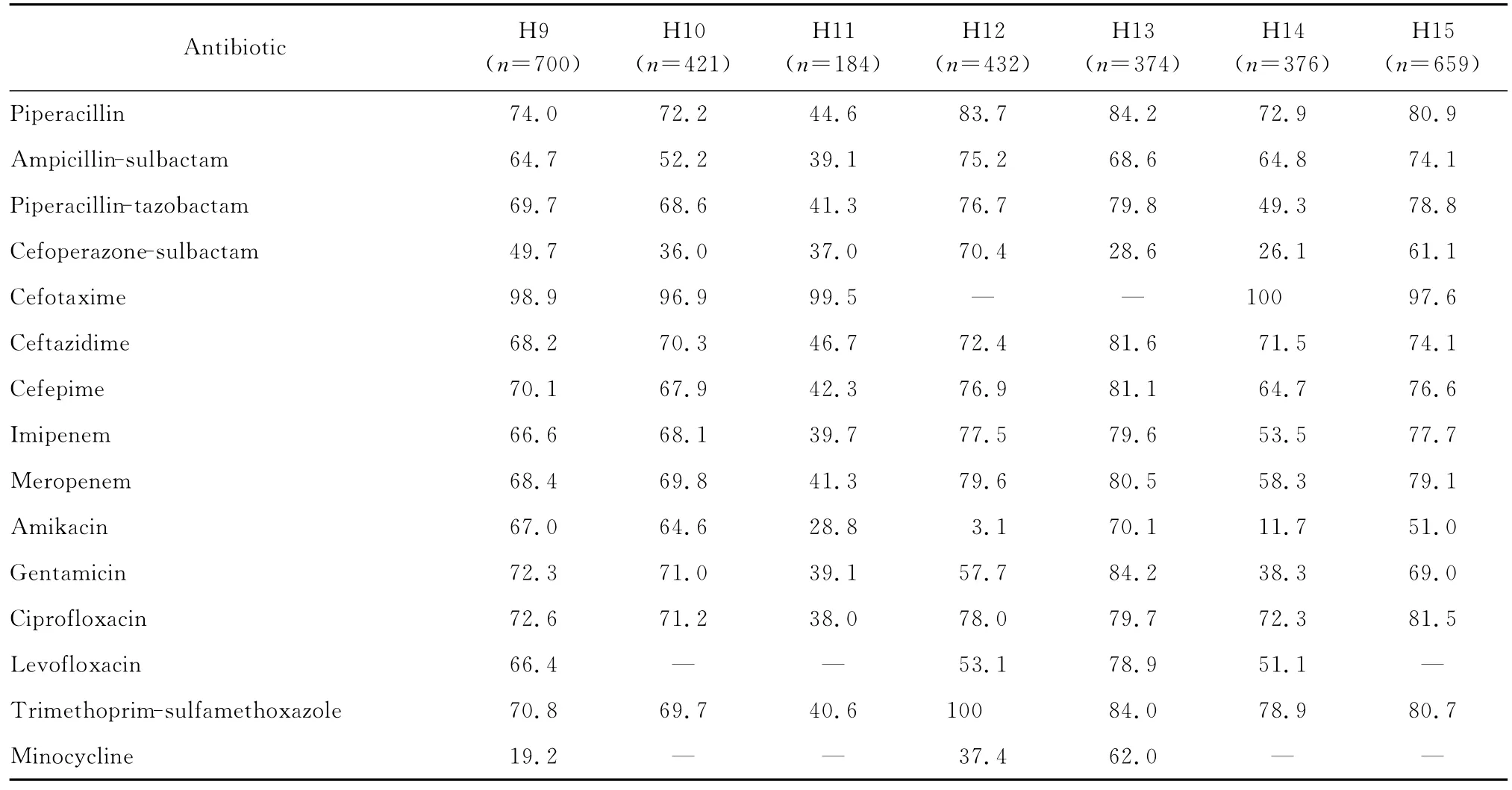
continued table 3

表4 各医院多重耐药和泛耐药鲍曼不动杆菌的株数和百分率Table 4 Number and percentage of multidrug-resistant and pandrug-resistant A.baumannii in different hospitals
不同科室中,ICU的鲍曼不动杆菌对大多数抗菌药物的耐药率均高于其他科室,其次为急诊。各科室分离菌对头孢哌酮-舒巴坦和米诺环素耐药率较低,分别为27.5%~57.8%和22.9%~38.4%。
在ICU分离株中,除头孢哌酮-舒巴坦和米诺环素耐药率较低外,对其他抗菌药物的耐药率较高,为62.6%~98.8%。见表5。
鲍曼不动杆菌对所测试的β内酰胺类抗生素的耐药率呈现逐年上升的趋势,特别是对头孢哌酮-舒巴坦,从2007年的5.4%升至2011年的43.4%;对亚胺培南和美罗培南,从2007年的37.6%和42.7%升至2011年的65.2%和66.2%;而对阿米卡星、庆大霉素和米诺环素的耐药率变化不大。见表6。
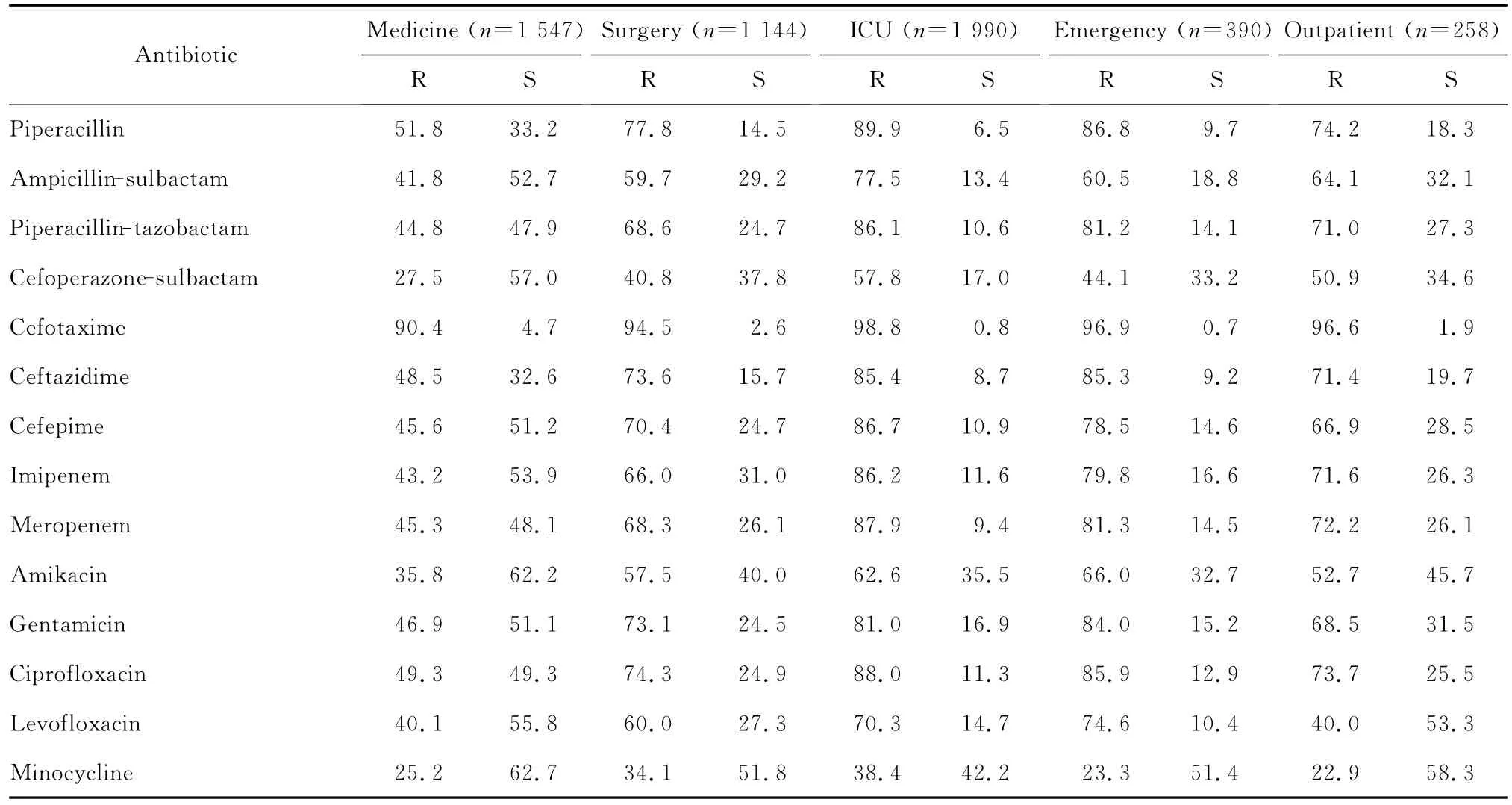
表5 不同科室分离的鲍曼不动杆菌对14种抗菌药物的耐药率和敏感率(%)Table 5 Susceptibility and resistance rates of A.baumannii to 14 antimicrobial agents in different departments(%)
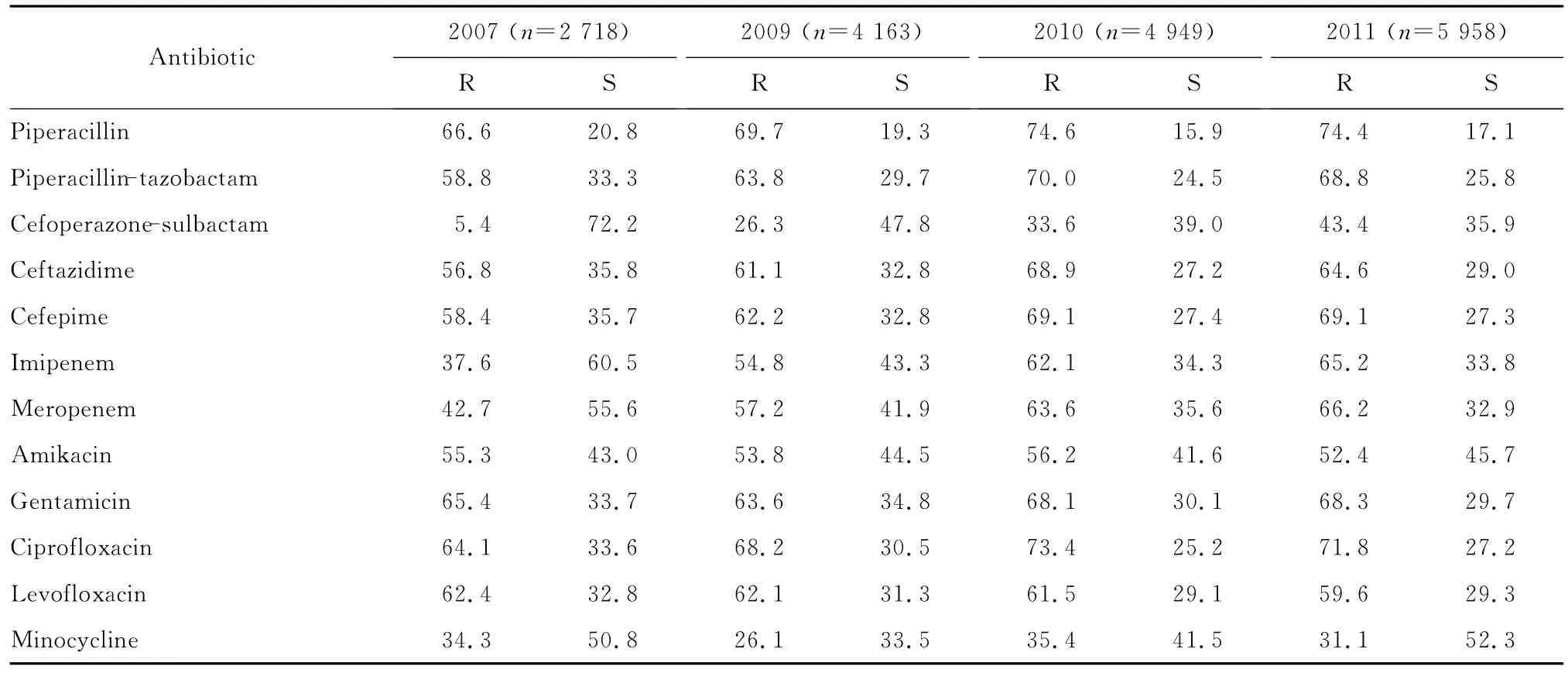
表6 2007—2011年鲍曼不动杆菌对各种抗菌药物耐药率和敏感率变化(%)Table 6 The changing pattern of susceptibility of A.baumannii from year 2007 to 2011(%)
讨 论
不动杆菌属细菌是一群不发酵糖的革兰阴性杆菌,通过分子生物学方法至少可将其分为33个种,其中已经命名的有18个种[2],鲍曼不动杆菌是其中之一,具有非常重要的临床意义。鲍曼不动杆菌是医院感染的重要条件致病菌,可引起各种严重感染,如呼吸机相关性肺炎、血流感染、脑膜炎、泌尿道感染和外科手术感染等。主要发生在ICU的危重患者或免疫力较低的患者,特别是需要辅助机械通气、创伤或烧伤的患者[3-4]。
早期文献报道,临床分离的鲍曼不动杆菌对许多常用的抗菌药物敏感,如氨苄西林(60.0%~70.0%)、庆大霉素(92.5%)、氯霉素(57.0%),因此治疗该菌引起的感染有药可用[3]。但由于鲍曼不动杆菌有较强的生存能力及产生和传播其耐药性的能力,加之临床上大量使用广谱抗菌药物,为耐药性的发展创造了有利的环境。目前鲍曼不动杆菌几乎对所有临床常用的抗菌药物(β内酰胺类、氨基糖苷类、氟喹诺酮类、碳青霉烯类)耐药,其耐药机制有:产生β内酰胺酶、外排泵激活、外膜蛋白缺失导致对β内酰胺类抗生素耐药;产生氨基糖苷修饰酶(AME)或16SrRNA甲基化酶对氨基糖苷类耐药;细菌gryA和parC基因的点突变引起对喹诺酮类耐药;产苯唑西林酶(OXA-23、24、40等)、金属酶,外排泵过度表达等导致对碳青霉烯类抗生素耐药。
本研究显示,临床分离6 723株不动杆菌属细菌中,89.3%分离自住院患者,10.7%为门急诊患者,充分说明不动杆菌属是重要的医院感染病原菌。在医院的各科室中,ICU是不动杆菌属检出率最高的科室,占所有菌株的33.9%,与2010年(29.5%)[5]、2009年(27.4%)[6]相比,ICU检出率呈现逐年升高的趋势。由于入住ICU大多是重症患者,且住院时间长,免疫功能低下,大量使用广谱抗菌药物,留置导尿管和各种侵袭性操作,导致各种外源性和内源性感染的机会增多,因此该菌检出率普遍高于其他科室。
从本年度鲍曼不动杆菌对抗菌药物耐药性分析,该菌对常用抗菌药物保持了较高的耐药率,且耐药率较往年呈现逐年上升的趋势。鲍曼不动杆菌对头孢哌酮-舒巴坦耐药率虽较低,但呈现明显的上升趋势,从2007年 的5.4%[7]、2009年的26.3%、2010年的33.6%到2011年的43.4%,这可能与此类药物在临床上的大量使用有关。该菌对米诺环素的耐药率变化不大,从2007年的34.3%到2011年的31.1%。碳青霉烯类抗生素以往被认为是治疗鲍曼不动杆菌感染的首选用药。但该菌对碳青霉烯类抗生素的耐药率不断升高,亚胺培南和美罗培南的耐药率分别从2007年的37.6%和42.7%升高到2011年的65.2%和66.2%。本次监测中洛菲不动杆菌对抗菌药物的耐药率均低于鲍曼不动杆菌,除头孢噻肟外,对其余抗菌药物的耐药率均低于50.0%。本研究中测定了313株鲍曼不动杆菌对替加环素的耐药性,采用FDA的判定标准(S≥16 mm,R≤12 mm),耐药率为13.4%。已经有许多关于临床使用替加环素联合其他药物治疗MDR的鲍曼不动杆菌引起感染的报道,大部分患者获得了不错的疗效。据Karageorgopoulos等[8]报道,在8份替加环素对MDR不动杆菌属感染的治疗研究中,共涉及42例患者,替加环素的治疗有效率为76.0%(32/42),其中66.7%患者的治疗中采用了替加环素联合其他抗菌药物的方案。也有一些临床治疗被证明是失败的,可能由替加环素在患者体内的血药浓度较低造成[9-11],并且一些研究已经证明外排泵的过度表达可导致对此药的耐药[12]。
不同医院分离的鲍曼不动杆菌对抗菌药物的耐药性差别较大,这可能与各医院抗菌药物使用的种类和数量不同以及各医院分离株的耐药型别不同有关。在参与本研究的15所医院中,有2所医院分离的鲍曼不动杆菌对除头孢噻肟外的所有监测药物的耐药率均低于其他13所医院,耐药率均低于50.0%;1所医院分离菌除对头孢哌酮-舒巴坦和阿米卡星较敏感外,对氨苄西林-舒巴坦也较敏感;个别医院的分离菌对阿米卡星的耐药率最低,而对头孢哌酮-舒巴坦的耐药率较高;另有1所医院分离菌对头孢哌酮-舒巴坦的耐药率最低,而对米诺环素的耐药率较高,超过60.0%;还有1所医院分离菌对大多数抗菌药物耐药率较高,对米诺环素依然较为敏感。
本年度鲍曼不动杆菌MDR的比率为51.7%,与2010年55.0%相比变化不大;PDR的比率为27.4%,比2010年21.4%略有升高。约40.8%的MDR和41.7%的PDR鲍曼不动杆菌分离自ICU,提示ICU的耐药菌株存在克隆传播的可能。
鲍曼不动杆菌感染的抗菌治疗是临床治疗中的难题,应根据药敏结果选用敏感的抗菌药物,目前较常使用者为β内酰胺类与舒巴坦的复方,如氨苄西林或头孢哌酮与舒巴坦的复方。对于严重感染或MDR菌株所致感染患者则应联合用药,例如上述药物与氨基糖苷类抗生素、多黏菌素B(或E)、替加环素等联合,但尚须积累更多的临床资料证实其疗效。总之,应合理使用抗菌药物,以延迟细菌产生耐药性,加强细菌耐药性监测和流行病学调查,加强对新型有效抗菌药物的研制,才能更好应对鲍曼不动杆菌及其所致感染带来的挑战。
[1]Clinical and Laboratory Standards Institute(CLSI).Performance standards for Antimicrobial susceptibility testing[S].M100-22,2012.
[2]Towner KJ.Acinetobacter:an old friend,but a new enemy[J].J Hosp Infect,2009,73(4):355-363.
[3]Bergogne-Bérézin E.Resistance ofAcinetobacterspp.to antimicrobials-overview of clinical resistance patterns and herapeutic problems.Acinetobacter,microbiology,epidemiology,infections,management[M].Boca Raton:CRC Press,1996:133-183.
[4]Peleg AY,Seifert H,Paterson DL.Acinetobacterbaumannii:emergence of a successful pathogen[J].Clin Microbiol Rev,2008,21(3):538-582.
[5]习慧明,徐英春,朱德妹,等.2010年中国CHINET鲍曼不动杆菌耐药性监测[J].中国感染与化疗杂志,2012,12(2):98-104.
[6]张小江,徐英春,俞云松,等.2009年中国CHINET鲍曼不动杆菌耐药性监测[J].中国感染与化疗杂志,2010,10(6):441-446.
[7]史俊艳,张小江,徐英春,等.2007年中国CHINET鲍曼不动杆菌耐药性监测[J].中国感染与化疗杂志,2009,9(3):196-200.
[8]Karageorgopoulos DE,Kelesidis T,Kelesidis I,et al.Tigecycline for the treatment of multidrug-resistant(including car-bapenem-resistant)Acinetobacterinfections:a review of the scientific evidence[J].J Antimicrob Chemother,2008,62(1):45-55.
[9]Anthony KB,Fishman NO,Linkin DR,et al.Clinical and microbiological outcomes of serious infections with multidrugresistant Gram-negative organisms treated with tigecycline[J].Clin Infect Dis,2008,46(4):567-570.
[10]Schafer JJ,Goff DA,Stevenson KB,et al.Early experience with tigecycline for ventilator-associated pneumonia and bacteremia caused by multidrug-resistantAcinetobacterbaumannii[J].Pharmacotherapy,2007,27(7):980-987.
[11]Reid GE,Grim SA,Aldeza CA,et al.Rapid development ofAcinetobacterbaumanniiresistance to tigecycline[J].Pharmacotherapy,2007,27(8):1198-1201.
[12]Peleg AY,Adams J,Paterson DL.Tigecycline efflux as a mechanism for nonsusceptibility inAcinetobacterbaumannii[J].Antimicrob Agents Chemother,2007,51(6):2065-2069.

