拉氧头孢的体外抗菌作用
杨 洋,朱德妹,叶信予,郭 燕,吴 湜,吴卫红,胡付品,张婴元
拉氧头孢系日本盐野义制药株式会社研制,国内有海南海灵化学制药有限公司生产的氧头孢烯类抗生素,其抗菌作用特点与第三代头孢菌素相似,故有时亦被归入第三代头孢菌素。为了解该药对近期临床分离细菌的抗菌活性,采用琼脂稀释法测定拉氧头孢对近期临床分离的大肠埃希菌、肺炎克雷伯菌等肠杆菌科细菌以及厌氧菌等的抗菌活性,并与其他抗菌药物比较,现将结果报道如下。
材料与方法
一、材料
(一)细菌来源 收集2010—2011年上海、北京、广东、浙江等11个省市部分医院的临床分离菌共612株,涉及16个菌属23个菌种,其中包括肠杆菌科细菌398株,不发酵糖革兰阴性杆菌110株,厌氧菌104株。肠杆菌科细菌包括大肠埃希菌和肺炎克雷伯菌各80株,产ESBLs菌株占一半,均经过ESBL确证试验验证。质控菌株为大肠埃希菌ATCC25922,铜绿假单胞菌ATCC27853,脆弱拟杆菌ATCC25285。
(二)抗菌药物 拉氧头孢、头孢米诺为海南海灵化学制药公司提供的产品;头孢他啶、头孢曲松、头孢吡肟、头孢哌酮-舒巴坦、哌拉西林-他唑巴坦、美罗培南、环丙沙星、庆大霉素、阿米卡星、替卡西林-克拉维酸、左氧氟沙星、甲氧苄啶-磺胺甲口恶唑、米诺环素、甲硝唑、克林霉素、氯霉素为中国食品药品检定研究院技术服务部标准品;亚胺培南为默沙东制药公司产品。
(三)抗菌药物纸片 头孢他啶、头孢噻肟、头孢他啶-克拉维酸、头孢噻肟-克拉维酸等检测ESBLs的纸片为美国BBL公司产品。
(四)培养基和主要的试剂 需氧菌药敏试验用Mueller-Hinton培养基,厌氧菌药敏用添加5%(v/v)脱纤维羊血及血红素(5 mg/L)和维生素K1(1 mg/L)的Brucella培养基。MH培养基和Brucella培养基均为英国OXOID公司产品,Brucella厌氧菌药敏培养基添加剂血红素和维生素K1为Sigma-Aldrich公司产品;脱纤维羊血为上海闵行区诸翟无菌动物血试剂供应站产品。PCR扩增试剂盒为大连宝生物工程有限公司产品。PCR引物由上海生物工程有限公司合成。
二、方法
(一)最低抑菌浓度(MIC)测定
1.琼脂稀释法:按CLSI 2009年版M07-A8[1]和2007年版M11-A7[2]的推荐方法,采用琼脂稀释法测定拉氧头孢及相关抗菌药物对临床分离菌的MIC。抗菌药物测试浓度范围为0.06~128 mg/L,按CLSI推荐的方法配制稀释,用多点接种仪(A400,DENLEY)接种,肠杆菌科细菌和不发酵糖革兰阴性杆菌接种菌量为104CFU/点,(35±2)℃培养20 h后阅读结果,厌氧菌接种菌量为105CFU/点,(36±1)℃厌氧环境培养48 h后阅读结果。
2.药敏判读标准:参照CLSI 2012年版M100-S22[3]的标准进行药敏结果判读,其中头孢哌酮-舒巴坦按Jones等[4]报道以头孢哌酮单药的标准(≤16 mg/L敏感、32 mg/L中介、64 mg/L耐药)判读。CLSI无头孢米诺的相关判读标准,亦无拉氧头孢对不发酵糖革兰阴性杆菌和厌氧菌的判读标准。采用SPSS统计软件对药敏试验结果进行分析。
(二)β内酰胺酶检测
1.ESBL表型确证试验:按CLSI推荐[3]的酶抑制剂增强试验检测大肠埃希菌和肺炎克雷伯菌的ESBLs。如头孢他啶或头孢噻肟加克拉维酸后对受试菌的抑菌圈直径与不加克拉维酸的单药抑菌圈直径相比,差值≥5 mm时,即判定为产ESBL菌株。
2.质粒AmpC检测:根据文献[5]采用多重PCR检测大肠埃希菌和肺炎克雷伯菌的AmpC酶。
结果
一、β内酰胺酶的检测结果
受试的160株大肠埃希菌和肺炎克雷伯菌,经ESBL确证试验结果显示,产ESBLs大肠埃希菌和肺炎克雷伯菌各40株,其中上述菌株中分别又有2株和7株细菌兼产AmpC酶。非产ESBLs的大肠埃希菌和肺炎克雷伯菌亦各40株,但后者有1株产AmpC酶。见表1。

表1 160株受试大肠埃希菌和肺炎克雷伯菌中产ESBLs和AmpC酶菌株的检出率[n,(%)]Table 1 Prevalence of ESBLs and/or AmpC-producing strains in160 Escherichia coli and Klebsiella pneumoniae isolates[n,(%)]
二、拉氧头孢对各种受试菌的MIC
拉氧头孢对大肠埃希菌、肺炎克雷伯菌、肠杆菌属、变形杆菌属、黏质沙雷菌、弗劳地枸橼酸杆菌、摩氏摩根菌等肠杆菌科细菌均具有良好的抗菌活性,包括产ESBLs的大肠埃希菌和肺炎克雷伯菌在内。拉氧头孢除对弗劳地枸橼酸杆菌和肠杆菌属细菌的MIC90分别为8 mg/L和4 mg/L外,对其他受试肠杆菌科细菌的MIC90为0.125~1 mg/L,见表2。
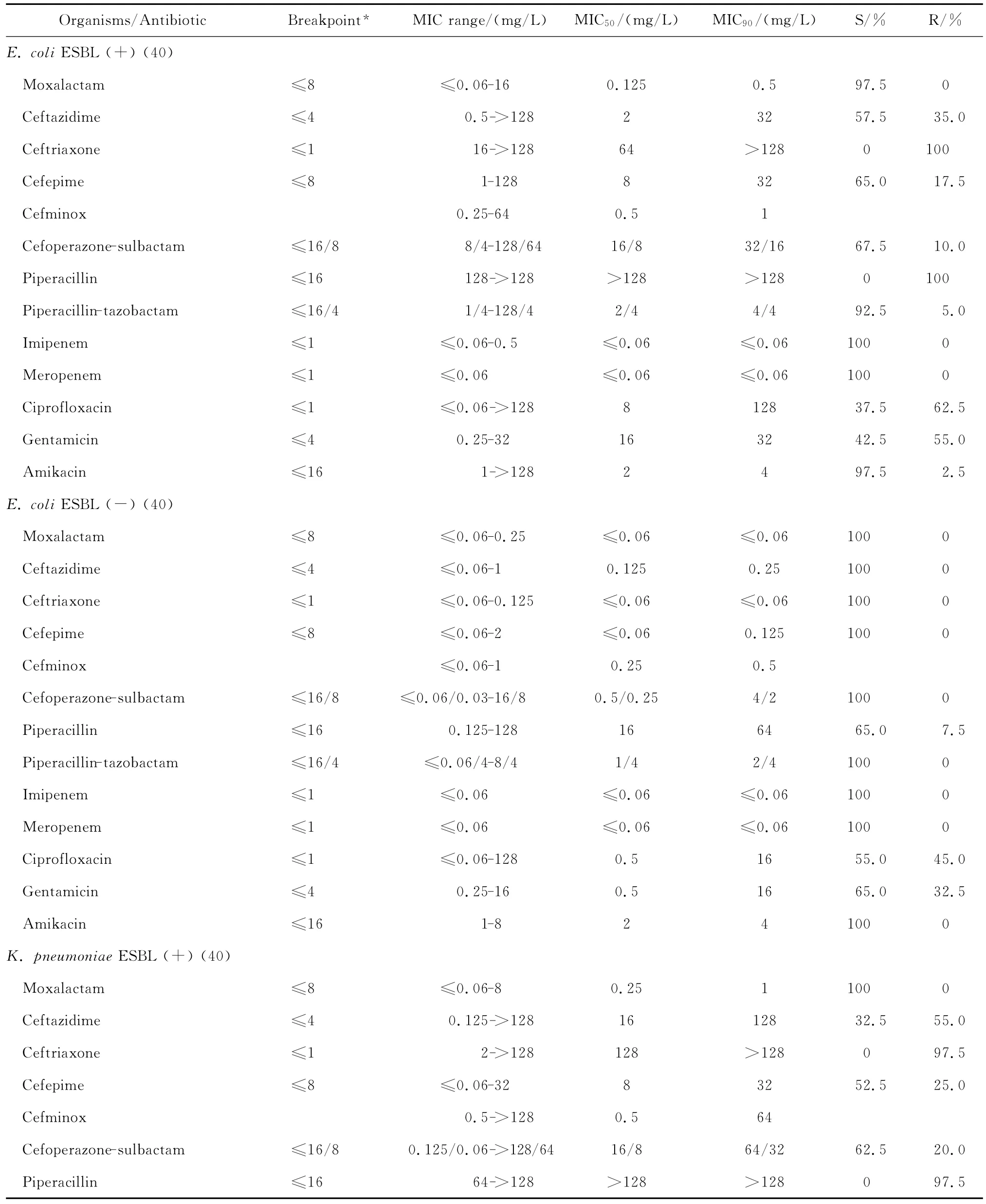
表2 拉氧头孢等抗菌药物对398株肠杆菌科细菌的药敏试验Table 2 In vitro activities of moxalactam and comparative antibiotics against Enterobacteriaceaisolates(n=398)
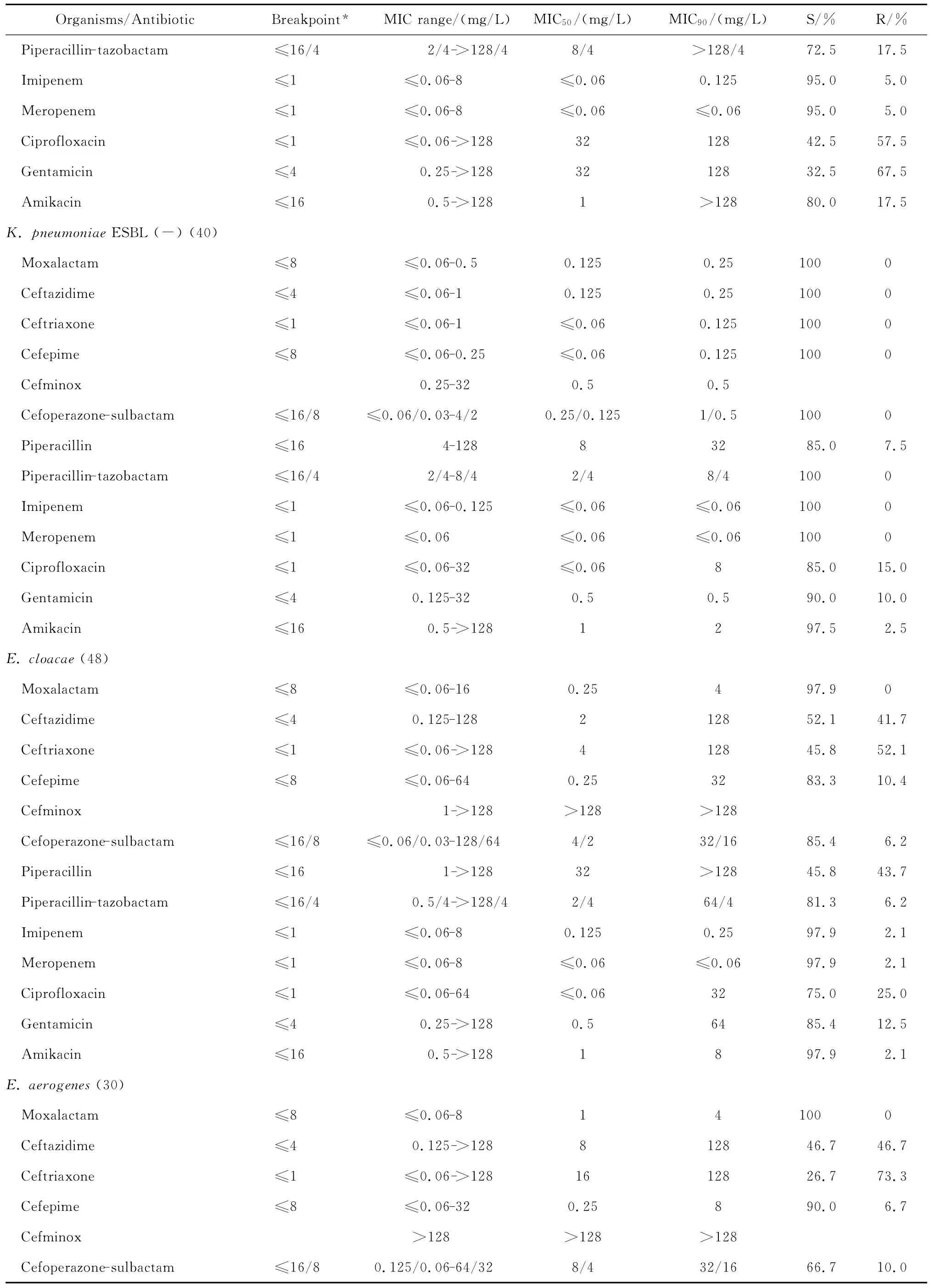
continued table 2
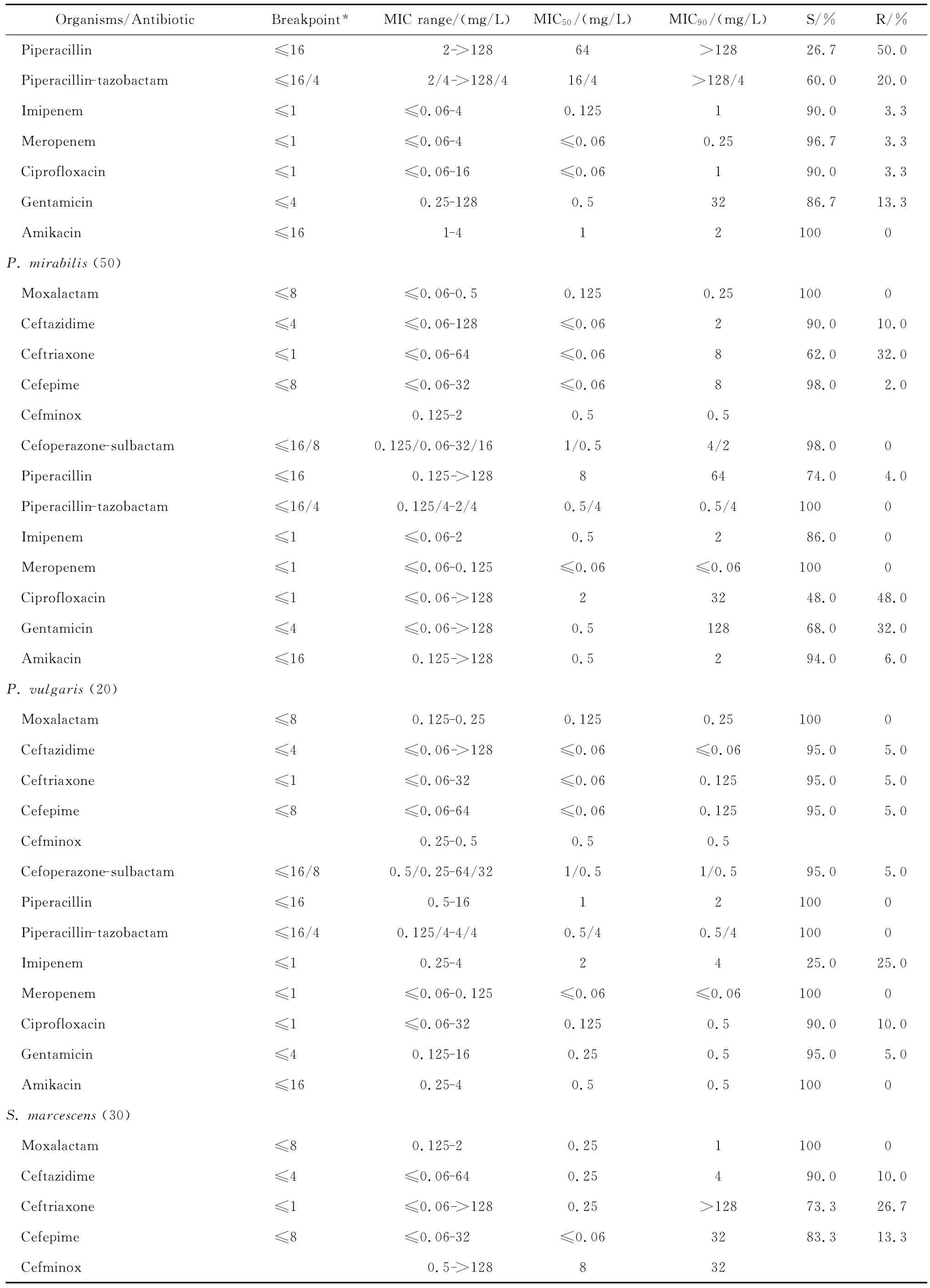
continued table 2
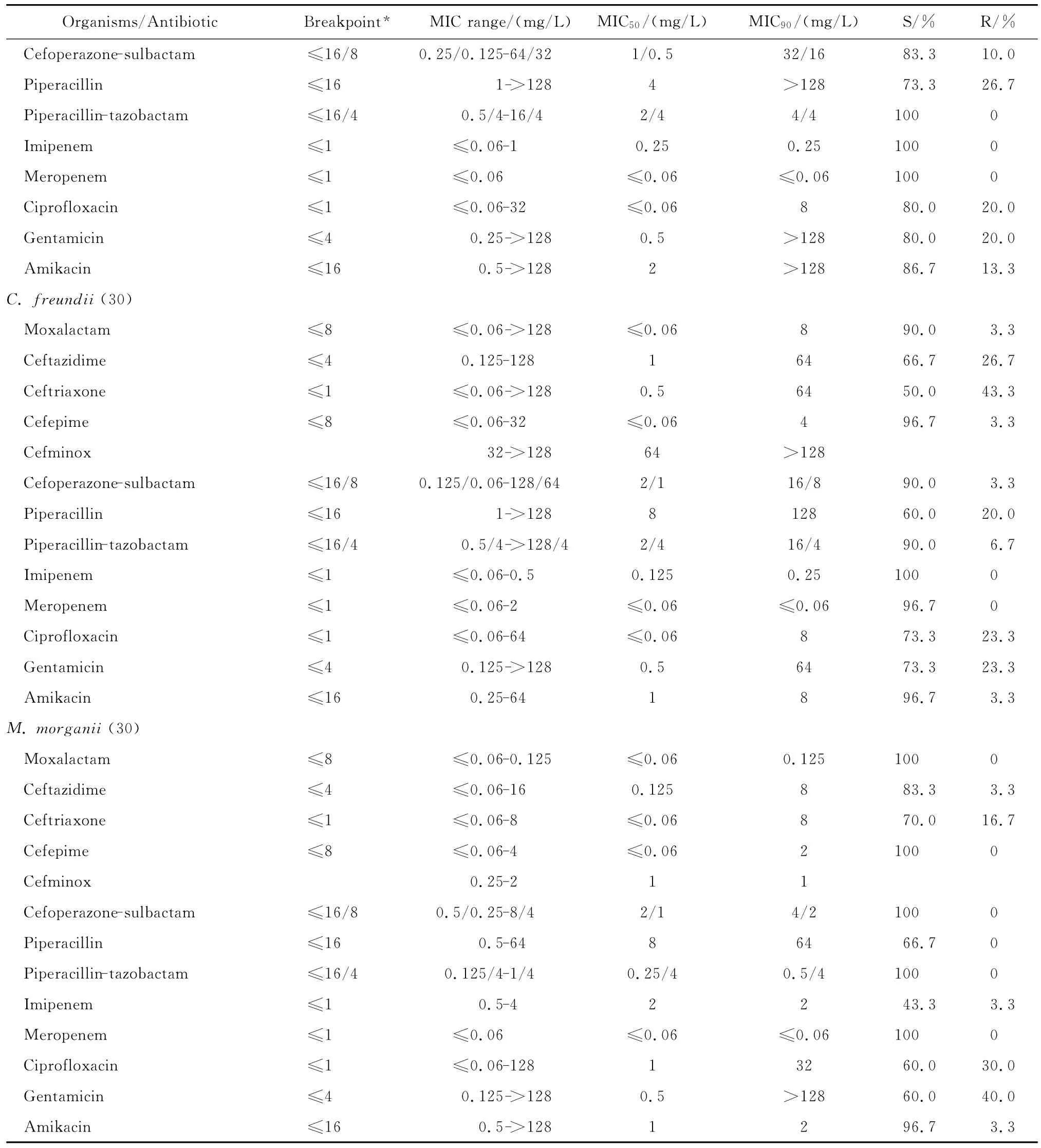
continued table 2
拉氧头孢对铜绿假单胞菌、鲍曼不动杆菌和洋葱伯克霍尔德菌等不发酵糖革兰阴性杆菌的抗菌活性较弱。拉氧头孢除了对嗜麦芽窄食单胞菌的MIC90为8 mg/L外,对其他受试不发酵糖革兰阴性杆菌的MIC90均≥64 mg/L,见表3。
拉氧头孢对脆弱拟杆菌和普雷沃菌属细菌亦有一定的抗菌活性,MIC50分别为2 mg/L和1 mg/L,MIC90分别为64 mg/L和32 mg/L;但对其他拟杆菌属细菌的抗菌活性差。拉氧头孢对梭杆菌属和消化链球菌属细菌均有良好的抗菌活性,其MIC50和MIC90分别为0.25~2 mg/L和2~4 mg/L,但对韦荣球菌属细菌的MIC50和MIC90分别为8 mg/L和16 mg/L,见表4。

表3 拉氧头孢等抗菌药物对110株不发酵糖革兰阴性杆菌的药敏试验Table 3 In vitro activities of moxalactam and comparative antimicrobial agents against non-fermentative gram-negative rods(n=110)
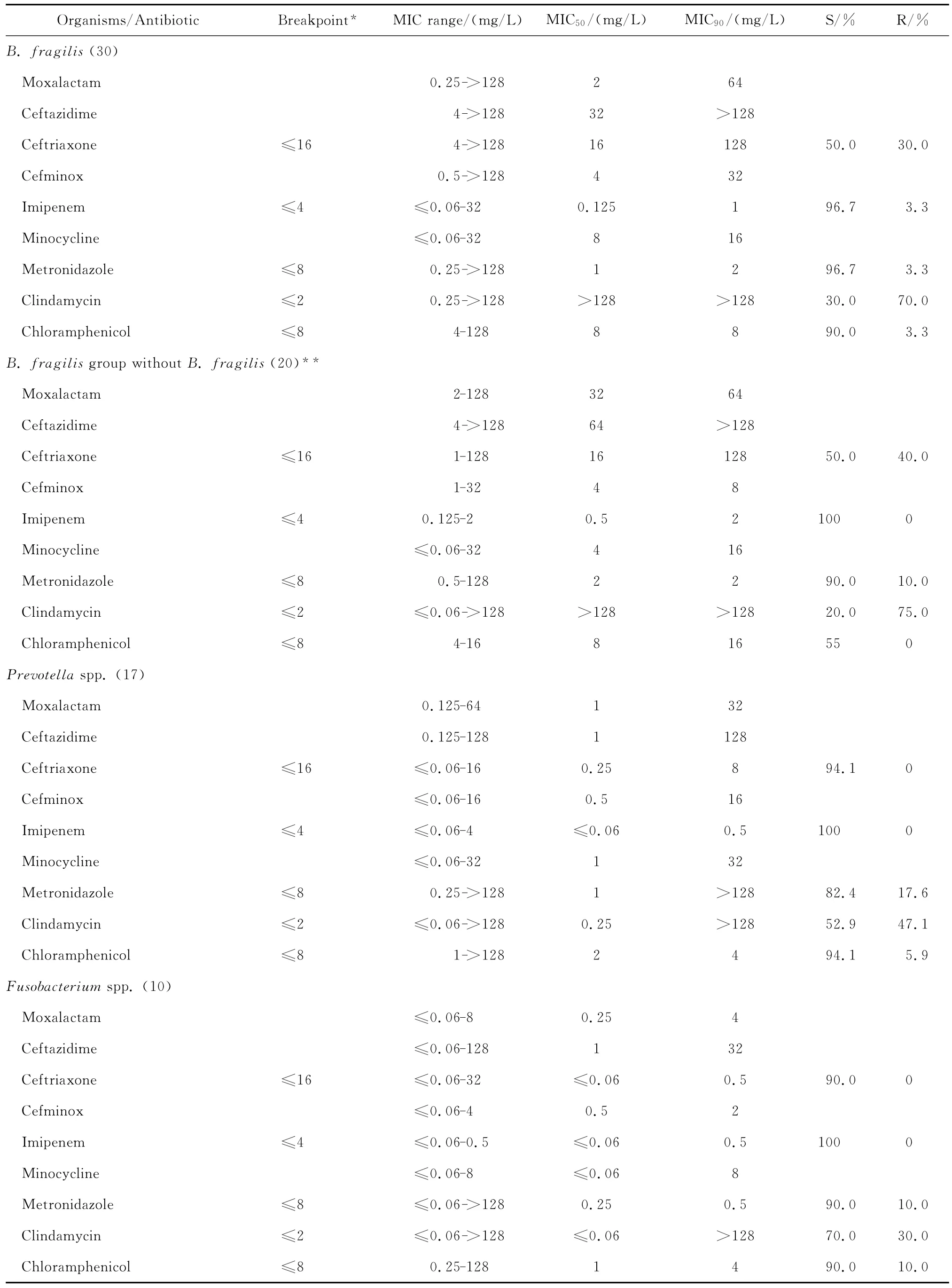
表4 拉氧头孢等抗菌药物对104株厌氧菌的药敏试验Table 4 In vitro activities of moxalactam and comparative antimicrobial agents against anaerobic bacterium(n=104)
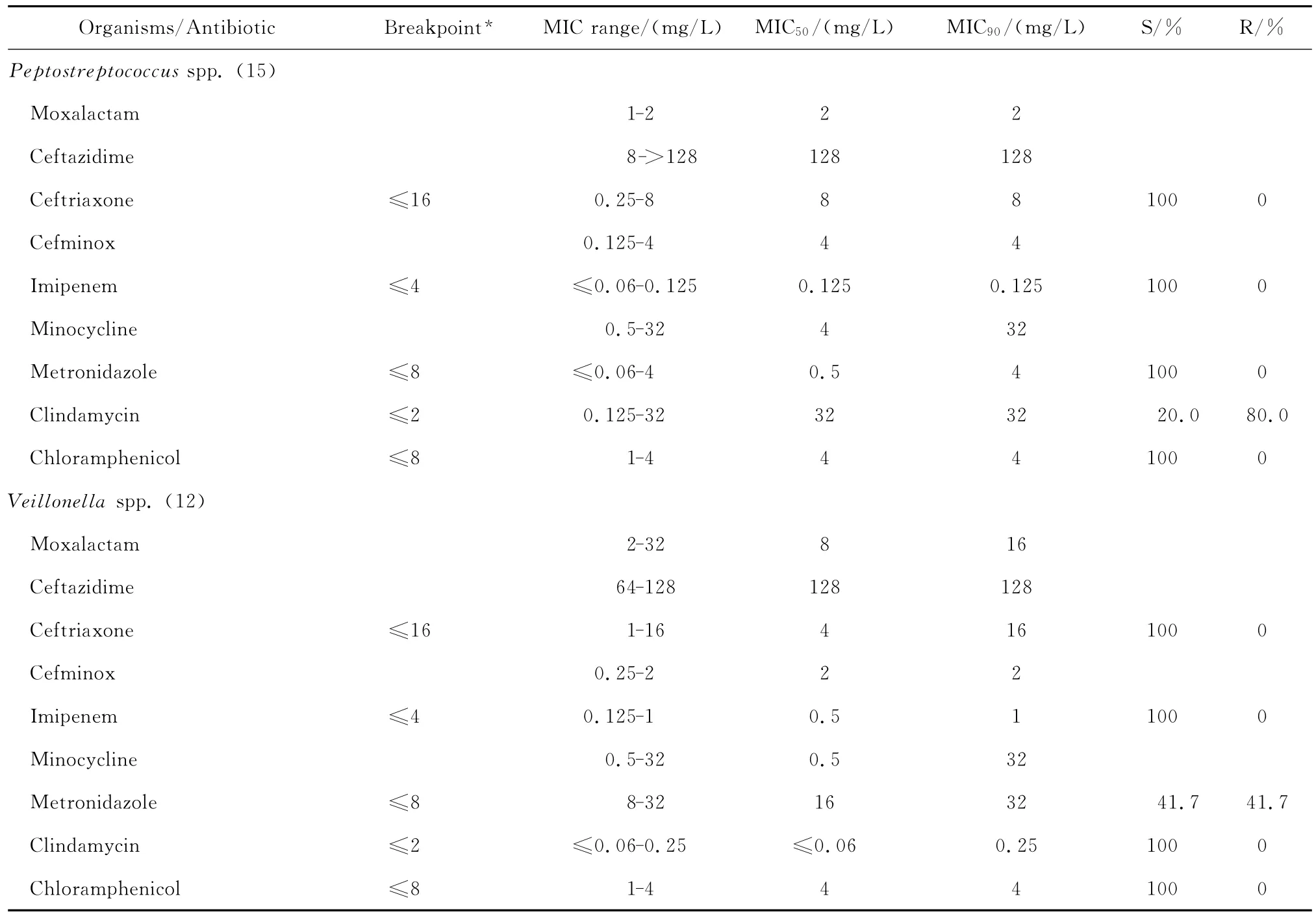
continued table 4
三、受试药与其他对照药的体外抗菌活性比较
与第三、四代头孢菌素相比,拉氧头孢对产ESBLs大肠埃希菌和肺炎克雷伯菌的抗菌活性较上述2类头孢菌素强。0.25 mg/L拉氧头孢即可分别抑制100%大肠埃希菌和90.0%以上肺炎克雷伯菌中产ESBLs菌株的生长,但4 mg/L头孢他啶仅能分别抑制57.5%大肠埃希菌和32.5%肺炎克雷伯菌中产ESBLs株生长,头孢曲松对之几无抗菌活性;8 mg/L头孢吡肟只能抑制50.0%大肠埃希菌和肺炎克雷伯菌中的产ESBLs株。其中对大肠埃希菌和肺炎克雷伯菌中产ESBLs株的抗菌活性与受试的2种酶抑制剂复方抗菌活性相仿,对不产酶株的抗菌活性优于酶抑制剂复方。0.25 mg/L拉氧头孢即可抑制所有非产ESBLs大肠埃希菌和肺炎克雷伯菌的生长,抗菌活性优于或相仿于头孢他啶、头孢曲松、头孢吡肟。
拉氧头孢对肠杆菌属、奇异变形杆菌、沙雷菌属、摩根菌属等其他肠杆菌科细菌的抗菌活性亦明显优于头孢他啶、头孢曲松和头孢吡肟,4 mg/L或8 mg/L拉氧头孢即可抑制大多数受试的其他肠杆菌科细菌生长,亦可分别抑制97.9%阴沟肠杆菌和90.0%弗劳地枸橼酸杆菌生长。
拉氧头孢对肠杆菌科细菌的抗菌活性较头孢米诺、头孢哌酮-舒巴坦和哌拉西林-他唑巴坦为优或相仿,但对肠杆菌科细菌的抗菌活性较碳青霉烯类抗生素差(亚胺培南对变形杆菌属细菌和摩氏摩根菌除外)。本研究中10株肠杆菌科细菌对亚胺培南或美罗培南耐药,其中亚胺培南对5株普通变形杆菌和1株摩氏摩根菌的MIC为4 mg/L,而美罗培南的MIC≤0.06 mg/L;2株肺炎克雷伯菌和2株肠杆菌属细菌对2种碳青霉烯类抗生素均耐药,拉氧头孢对这些菌株的MIC在0.125~4 mg/L敏感范围内。但拉氧头孢对肠杆菌科细菌的抗菌活性与阿米卡星、环丙沙星和庆大霉素相仿或略优。
拉氧头孢对铜绿假单胞菌的抗菌活性明显较碳青霉烯类、氨基糖苷类及氟喹诺酮类抗菌药物差。8 mg/L拉氧头孢只能抑制40.0%铜绿假单胞菌生长,且对鲍曼不动杆菌的抗菌活性较多数受试对照药为差,但对嗜麦芽窄食单胞菌的抗菌活性较替卡西林-克拉维酸为优;与左氧氟沙星相仿,较米诺环素差。拉氧头孢对洋葱伯克霍尔德菌的抗菌活性较头孢他啶、美罗培南、氟喹诺酮类和米诺环素差,与替卡西林-克拉维酸相仿。
拉氧头孢对脆弱拟杆菌、梭杆菌属和消化链球菌属细菌的抗菌活性与头孢米诺相仿,但对其他拟杆菌属细菌以及普雷沃菌属、韦荣球菌属细菌的抗菌活性较头孢米诺稍差;拉氧头孢对厌氧菌的抗菌活性较亚胺培南差。对脆弱拟杆菌等拟杆菌属细菌的抗菌活性较甲硝唑差,但对普雷沃菌属、梭杆菌属、韦荣球菌属和消化链球菌属细菌的抗菌活性与甲硝唑相仿;对消化链球菌属细菌的抗菌活性优于克林霉素。
讨 论
拉氧头孢是氧头孢烯类抗生素,为广谱抗生素,有时亦被归入第三代头孢菌素,由于其7-氨基头孢烷酸上的硫原子被氧原子替代,其化学结构和抗菌谱均有别于第三代头孢菌素,不但对革兰阴性菌抗菌活性强,对多数β内酰胺酶稳定,且对脆弱拟杆菌等厌氧菌亦具有良好的抗菌活性[6-9]。
肠杆菌科细菌是临床重要病原菌,中国CHINET细菌耐药性监测网最近报道的结果显示,大肠埃希菌和肺炎克雷伯菌的临床分离株数居前2位。产β内酰胺酶是肠杆菌科细菌对β内酰胺类抗生素最常见的耐药机制[10],如今ESBLs在我国临床分离菌株中广泛流行,大肠埃希菌中产ESBLs菌株超过50.0%,肺炎克雷伯菌中近40.0%[11]。据文献报道,我国临床分离菌所产ESBL以CTX-M型为主,SHV型亦有发现、TEM型少见[12-13]。治疗产ESBLs菌感染的首选药物为碳青霉烯类抗生素。但随着碳青霉烯类抗生素的广泛应用,肠杆菌科细菌对碳青霉烯类抗生素的耐药率逐年升高,给临床诊治带来严重挑战。本研究发现拉氧头孢对产ESBLs的菌株仍有良好的抗菌活性,MIC值较低;本品1 mg/L即可抑制大部分产ESBLs菌株的生长。拉氧头孢对大肠埃希菌、肺炎克雷伯菌、变形杆菌属细菌、摩氏摩根菌等肠杆菌科细菌,包括产ESBLs大肠埃希菌和肺炎克雷伯菌在内的抗菌活性明显优于头孢他啶、头孢曲松和头孢吡肟,其MIC90大多是后3种抗菌药物的1/8到1/256。这与杨青等[13]报道的氧头孢烯类抗生素对产ESBLs菌株的体外抗菌活性研究的结果一致。
Jacoby等[14]报道肠杆菌属、枸橼酸杆菌属、沙雷菌属和摩根菌属细菌常携带染色体介导的AmpC酶,其中可能出现去阻遏高产酶菌株。本组资料中有10株产AmpC酶菌株,拉氧头孢的MIC90为0.125~8 mg/L,其中9株同时产ESBLs。拉氧头孢对2株产ESBLs和AmpC酶的大肠埃希菌的MIC分别为1 mg/L和16 mg/L,对7株产ESBLs和AmpC酶的肺炎克雷伯菌中6株的MIC为0.25~0.5 mg/L,另1株的MIC为8 mg/L;对1株单产AmpC酶肺炎克雷伯菌的MIC≤0.06 mg/L。提示拉氧头孢对细菌产生的ESBLs和AmpC酶高度稳定。这与陈东科等[15]2003年的研究发现,拉氧头孢 对ESBLs(包 括TEM-3、TEM-5、SHV-2、SHV-4、SHV-5)高度稳定,对产ESBLs+AmpC酶菌株的耐药率低的结果亦相一致。
本组资料显示,肠杆菌科细菌中10株碳青霉烯类耐药菌株,其中2株肺炎克雷伯菌、5株普通变形杆菌以及阴沟肠杆菌、产气肠杆菌和摩氏摩根菌各1株。拉氧头孢对上述菌株的MIC值(≤8 mg/L)均在敏感范围内。文献报道,产碳青霉烯酶是肠杆菌科细菌对碳青霉烯类抗生素耐药的主要机制[16],但其中变形杆菌属、摩根菌属细菌对亚胺培南的耐药则有其他尚未明确的耐药机制[3]。因此提示拉氧头孢可能对耐碳青霉烯类抗生素的肠杆菌科细菌具有抗菌活性,且与碳青霉烯类抗生素无交叉耐药。
本组资料显示,拉氧头孢对脆弱拟杆菌等厌氧菌有一定的抗菌作用,其作用与头孢米诺相仿或略差,逊于亚胺培南。文献报道拉氧头孢对脆弱拟杆菌的抗菌活性优于其他头孢菌素,对其他厌氧菌的抗菌活性则与头孢噻肟等第三代头孢菌素相仿[17-18]。
拉氧头孢具有抗菌谱广,对革兰阴性菌抗菌活性强,对细菌产生的多种β内酰胺酶稳定,血药浓度高且持续时间长以及脑脊液内药物浓度高等特点,日本批准用于肠杆菌科细菌、流感嗜血杆菌、拟杆菌属中敏感菌株引起的血流感染、细菌性脑膜炎、肺炎、肺脓肿、肝脓肿、胆道感染、盆腔感染和肾盂肾炎等。但拉氧头孢对葡萄球菌属、肺炎链球菌等革兰阳性球菌抗菌活性差,肠球菌属细菌对拉氧头孢天然耐药,在上述细菌所致感染中不宜采用[19-20]。
[1]Clinical and Laboratory Standards Institute.Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Glow Aerobically[S].Approved Standard-Eighth Edition,2009,M07-A8.
[2]Clinical and Laboratory Standards Institute.Methods for Antimicrobial Susceptibility Testing of Anaerobic Bacteria[S].Approved Standard-Seventh Edition,2007,M11-A7.
[3]Clinical and Laboratory Standards Institute.Performance Standards for Antimicrobial Susceptibility Testing[S].Twenty-Second Informational Supplement,2012,M100-S22.
[4]Jones RN,Barry AL,Packer RR,et al.Invitroantimicrobial spectrum,accurrence of synergy,and recommendations for dilution susceptibility testing concentration of the cefoperazone-sulbactam combination[J].J Clin Microbiol,1987,25(9):1725-1729.
[5]Pérez-Pérez FJ,Hanson ND.Detection of plasmid-mediated AmpC beta-lactamase genes in clinical isolates by using multiplex PCR[J].J Clin Microbiol,2002,40(6):2153-2162.
[6]Snepar R,Poporad G,Romano J,et al.Invitroactivity,efficacy,and pharmacology of moxalactam,a new beta-lactam antibiotic[J].Antimicrob Agents Chemother,1981,20(5):642-647.
[7]Reimer LG,Mirrett S,Reller LB.Comparison ofinvitroactivity of moxalactam(LY127935)with cefazolin,amikacin,tobramycin,carbenicillin,piperacillin,and ticarcillin against 420 blood culture isolates[J].Antimicrob Agents Chemother,1980,17(3):412-416.
[8]Lang SD,Edwards DJ,Durack DT.Comparison of cefoperazone,cefotaxime,and moxalactam(LY127935)against aerobic gram-negative bacilli[J].Antimicrob Agents Chemother,1980,17(3):488-493.
[9]张凤凯,李家泰,潘石,等.拉氧头孢对临床分离的1143株致病菌体外抗菌作用的研究[J].中国抗生素杂志,1994,19(3):221-229.
[10]Paterson DL,Bonomo RA.Extended-spectrum beta-lactamases:a clinical update[J].Clin Microbiol Rev,2005,18(4):657-686.
[11]胡付品,朱德妹,汪复,等.2011年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2012,12(5):321-329.
[12]Wang P,Hu F,Xiong Z,et al.Susceptibility of extendedspectrum-beta-lactamase-producingEnterobacteriaceaeaccording to the new CLSI breakpoints[J].J Clin Microbiol,2011,49(9):3127-3131.
[13]杨青,陈云波,顾怡明,等.氧头孢烯类抗生素对产超广谱β内酰胺酶菌株的体外抗菌活性研究[J].中国抗感染化疗杂志,2003,3(6):344-346.
[14]Jacoby GA.AmpC beta-lactamases[J].Clin Microbiol Rev,2009,22(1):161-182.
[15]陈东科,胡云建,张秀珍.舒巴坦与拉氧头孢配比对产酶菌的体外抗菌活性研究[J].临床药物治疗杂志,2003,1(4):53-56.
[16]Tzouvelekis LS,Markogiannakis A,Psichogiou M,et al.Carbapenemases inKlebsiellapneumoniaeand otherEnterobacteriaceae:an evolving crisis of global dimensions[J].Clin Microbiol Rev,2012,25(4):682-707.
[17]Edwards R,Greenwood D.An investigation of beta-lactamases from clinical isolates ofBacteroidesspecies[J].J Med Microbiol,1992,36(2):89-95.
[18]Jorgensen JH,Crawford SA,Alexander GA.Comparison of moxalactam(LY127935)and cefotaxime against anaerobic bacteria[J].Antimicrob Agents Chemother,1980,17(5):901-904.
[19]汪复,张婴元.实用抗感染治疗学[M].2版.人民卫生出版社,2012:305-306.
[20]McCracken GH Jr,Threlkeld N,Mize S,et al.Moxalactam therapy for neonatal meningitis due to gram-negative enteric bacilli.A prospective controlled evaluation[J].JAMA,1984,252(11):1427-1432.

