万古霉素对医院获得性肺炎中甲氧西林耐药金葡菌的最低抑菌浓度及其与预后的关系
王晓丽,刘嘉琳,孙景勇,谭若铭,李梅玲,尹建永,瞿洪平
耐甲氧西林金葡菌(MRSA)是导致医院获得性肺炎(hospital-acquired pneumonia,HAP)的主要革兰阳性病原菌。近年来MRSA导致的HAP使患者住院时间延长、医疗花费以及病死率增高[1]。目前,万古霉素仍是治疗MRSA感染最常用且最有效的抗菌药物之一,但随着万古霉素的使用量增加,其对MRSA的最低抑菌浓度(MIC)在敏感范围内增高,甚至出现万古霉素中介以及耐药的金葡菌;进一步研究发现,MIC值增高可能与临床应用万古霉素治疗失败相关[1]。van Hal等[2]研究结果表明,MIC≤2 mg/L是MRSA血流感染患者死亡的独立危险因素。由于万古霉素在肺组织中的浓度较低,不恰当的应用更容易造成肺炎治疗失败并筛选出耐药性增高的优势菌群,因此其在肺炎治疗中的应用更值得关注[3]。
本研究旨在分析MRSA菌株的MIC值与患者临床预后的关系,以及高MIC值MRSA菌株感染的可能危险因素,为临床治疗提供依据。
材料与方法
一、研究对象
选择2011年11月至2012年10月上海交通大学医学院附属瑞金医院诊断明确并应用万古霉素治疗的MRSA HAP患者作为研究对象,收集并分析患者的基本情况及住院期间的临床资料。
入选标准:1.年龄>18岁。2.诊断参照2005年ATS/IDSA指南[4]:(1)符合HAP临床诊断标准,入院时不存在也不处于感染潜伏期,入院48 h后在医院发生的肺炎,即符合①新近出现的咳嗽、咳痰,或原有呼吸道疾病症状加重,并出现脓性痰,伴或不伴胸痛;②发热;③肺实变体征和(或)湿性啰音;④血白细胞>10×109/L或<4×109/L,伴或不伴核左移;⑤肺部影像学检查显示新发或进行性发展且持续存在的片状、斑片状浸润影或间质性改变,伴或不伴胸腔积液。(2)符合微生物学诊断标准,即患者下呼吸道标本、支气管肺泡灌洗液、胸腔积液中分离并培养出MRSA菌株。下呼吸道标本来自患者清洁口腔后深部咳痰或经气管插管、气管切开导管内吸引所得,所有标本均经涂片证实为合格标本,即标本镜检白细胞数>10/低倍镜和鳞状上皮细胞数<25/低倍镜。3.初始治疗药物为万古霉素,并且治疗时间≥72 h,根据患者疾病严重程度、临床治疗效果以及体质量等因素参照ATS/IDSA指南设定万古霉素的给药剂量、方法及疗程。
排除标准:1.孕妇;2.年龄>80岁;3.临床肺部感染评分(CPIS)<6分;4.合并其他对万古霉素耐药的革兰阳性菌感染;5.肝肾功能衰竭或需要透析治疗的患者;6.免疫功能处于明显抑制状态者。
二、方法
(一)临床资料收集 一般临床资料:入院诊断、基础疾病、临床症状和体征、实验室和影像学检测指标、抗菌药物治疗过程及治疗结果等。
(二)临床病原菌鉴定及药敏试验
1.菌株鉴定:采用常规方法分离细菌,进行血浆凝固酶试验,采用VITEK2系统(法国生物梅里埃公司)进行菌株鉴定。采用纸片扩散法(K-B法)测定菌株对常用抗菌药物的敏感性,对苯唑西林的抑菌圈<20 mm的金葡菌为MRSA。
2.药敏试验:采用E试验法(法国生物梅里埃公司)对MRSA菌株进行万古霉素MIC值测定并重复确认,试验结果参照CLSI 2009年版标准判断,质控菌株为金葡菌ATCC25923。
(三)MIC值定义和预后的评价指标
1.MIC值:MIC>1 mg/L的MRSA菌株被定义为高MIC值[5],根据E试验检测结果将患者分为低MIC值(MIC≤1 mg/L)和高MIC值(MIC>1 mg/L)。
2.临床预后评价指标:预后评价指标主要有患者临床治疗效果分析、MRSA细菌学疗效评价、住院时间、28 d内肺炎复发和病死率等。其中治疗3 d后评价万古霉素的临床疗效,MRSA肺炎复发指终止万古霉素治疗后28 d内患者再次发生MRSA肺炎[6-7]。
三、统计学方法
所有数据均使用SPSS19.0软件包进行统计分析。符合正态分布的数据描述采用均数±标准差(¯x±s)表示,两样本率的比较采用χ2检验;非正态分布数据描述采用中位数(四分位距),即M(IQR)表示,两样本率的比较采用非参数检验;危险因素的分析采用logistic回归。P<0.05为差异有统计学意义。
结果
一、患者情况及万古霉素对MRSA菌株的MIC值分布
82例患者中男58例,女24例。73例(73/82,89.0%)患者MRSA菌株分离自痰液,8例(9.8%)为支气管肺泡灌洗液,1例(1.2%)为胸腔积液。25例(30.5%)患者合并其他细菌感染,其中15例(18.3%)为鲍曼不动杆菌,合并其他细菌感染的患者均接受充分恰当的抗菌药物治疗。
本组分离的MRSA菌株万古霉素MIC为0.5、0.75、1.0、1.5、2.0mg/L的菌株分别为5株(6.1%)、2株(2.4%)、32株(39.0%)、33株(40.2%)和10株(12.2%)。
二、高MIC值与低MIC值MRSA HAP患者临床基本情况及预后比较
本研究中MRSA HAP患者最常合并的基础疾病主要有:脑血管意外(29.3%)、糖尿病(28.0%)、肺部疾病(25.6%)及恶性肿瘤(22.0%)等;其中44例(53.7%)患者接受有创机械通气治疗。不同MIC值菌株感染患者临床基本情况比较见表1。
本研究中有29例(29/82,35.4%)患者万古霉素治疗3 d后临床症状无明显改善;22例(22/82,26.8%)患者万古霉素治疗7 d后病原菌未清除;8例(8/82,9.8%)患者MRSA肺炎后28 d内死亡;10例(10/82,12.2%)患者终止万古霉素治疗后28 d内再次发生MRSA肺炎;12例(12/82,14.6%)患者在万古霉素治疗7 d内更换其他抗菌药物治疗,其中10例更换为利奈唑胺,2例更换为替考拉宁。低MIC值与高MIC值患者MRSA感染后住院时间、28 d内病死率及住院期间病死率间差异均无统计学意义(P>0.05);但与低MIC值患者相比,高MIC值患者万古霉素治疗7 d后病原菌未清除率(15.4%和37.2%,P=0.03),更换其他抗菌药物替代治疗率(5.1%和23.3%,P=0.02),万古霉素应用3 d后临床治疗无效率(25.6%和44.2%,P=0.08)和肺炎复发率(5.7%和20.5%,P=0.13)均明显升高。
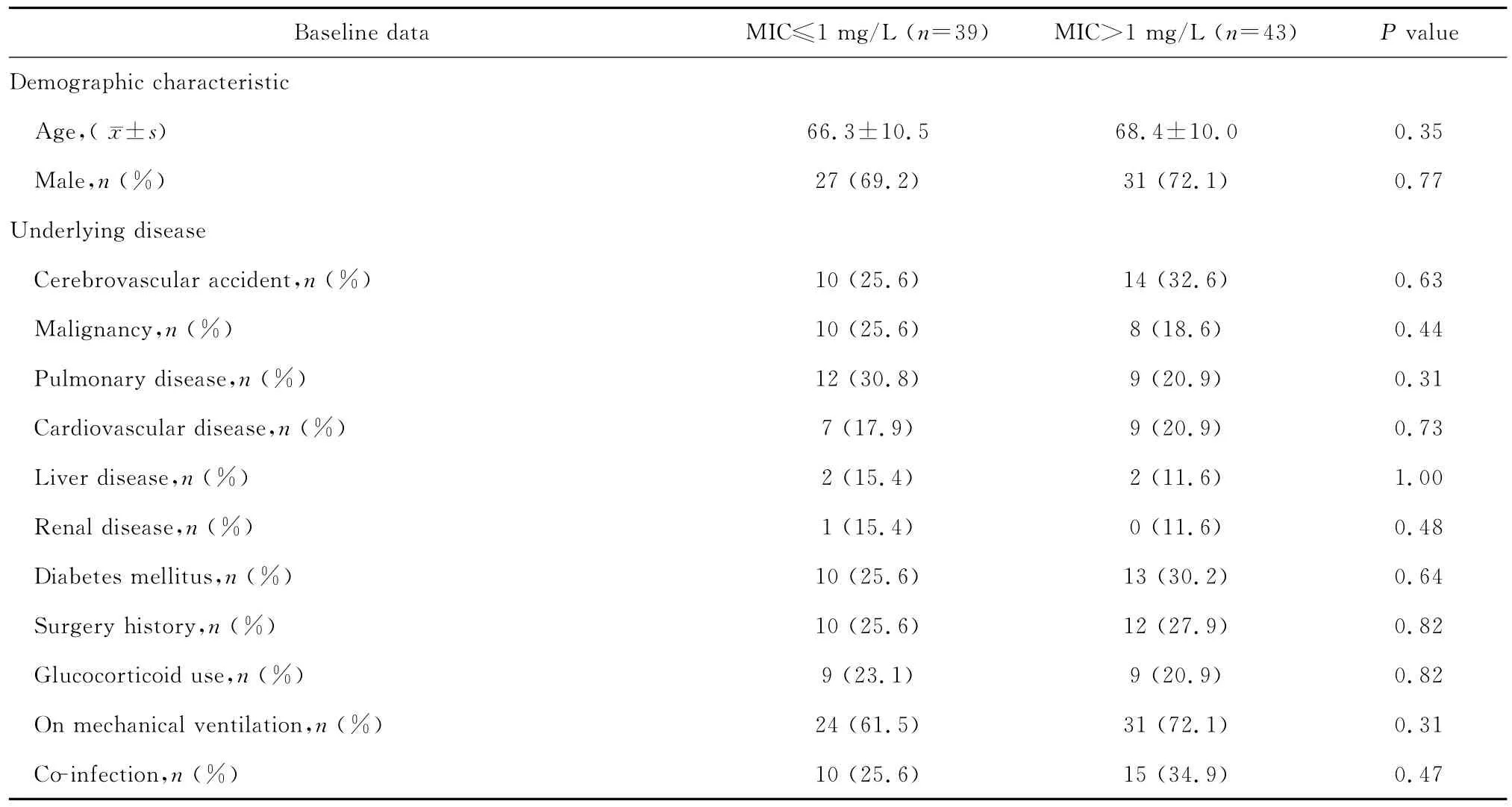
表1 高MIC值与低MIC值MRSA医院获得性肺炎患者临床基本情况及预后比较Table 1 Comparison of baseline clinical characteristics and outcomes between patients with hospital-acquired MRSA pneumonia in terms of high or low vancomycin MIC
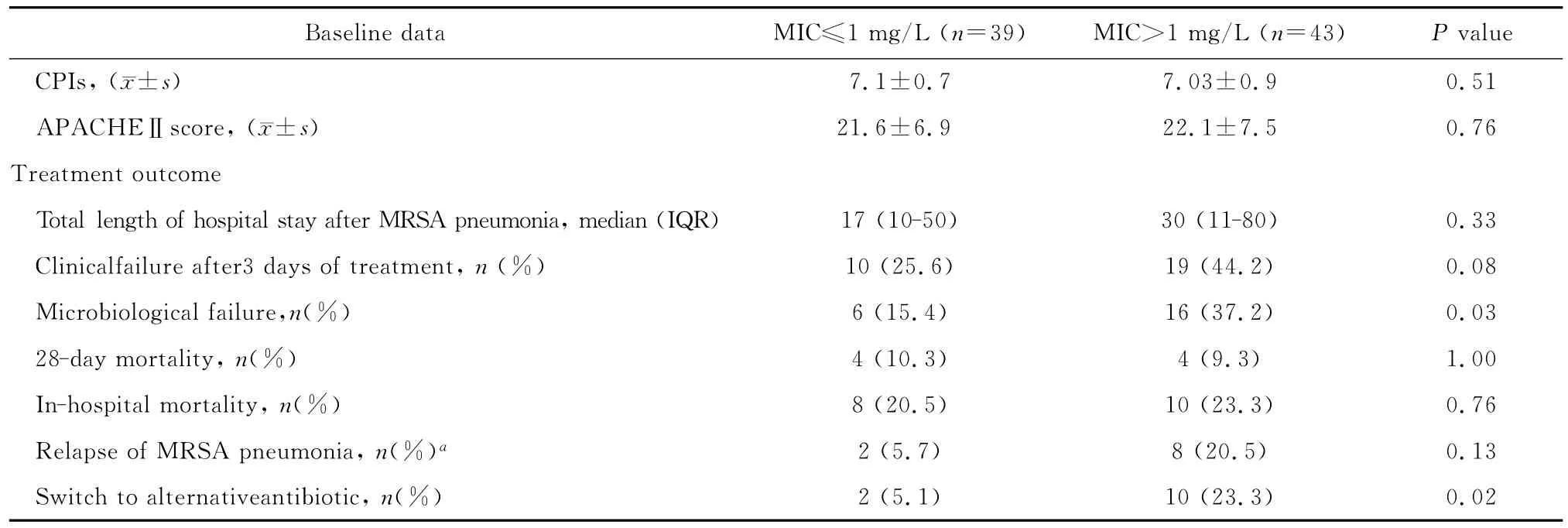
continued table 1
三、发生高MIC值MRSA菌株感染的可能危险因素
进一步分析表明,高MIC值患者本次感染前90 d内MRSA感染病史、万古霉素使用史明显高于低MIC值组患者(P均为0.03),见表2。以MIC值为因变量,以ICU内感染、患者近期住院史、HAP前90 d内MRSA感染史、万古霉素应用史为自变量进行多因素logistic回归分析,最终得出患者近期MRSA感染史是HAP中高MIC值MRSA菌株感染的独立危险因素(P=0.03,OR=5.60)。

表2 高MIC值MRSA菌株感染发生的可能危险因素Table 2 Risk factors associated with high vancomycin MIC in hospital acquired MRSA pneumonia
讨 论
尽管有效的预防以及合理的抗感染治疗可以降低MRSA感染的发生率和病死率,但是近年来万古霉素治疗失败的临床病例仍屡见不鲜。文献报道万古霉素对MRSA HAP的临床治疗失败率可高达40.0%[1],其中MIC值增高可能是临床治疗失败的潜在因素之一。
本研究中采用E试验法对82例HAP患者的MRSA菌株进行万古霉素MIC值测定,虽然E试验法测定的MIC值高于肉汤稀释法,但它仍是目前国际上普遍认可的一种简易可行的测定方法。检测结果显示,52.4%的患者MRSA菌株的MIC>1 mg/L;在不同MIC值患者基础状态无明显差异的情况下,高MIC值者万古霉素应用3 d后患者临床治疗无效率、应用7 d后病原菌未清除率以及肺炎复发率均高于低MIC值者,并且容易更换为利奈唑胺等其他抗菌药物治疗。上述结果可能由多种原因造成。首先,万古霉素对高MIC值的MRSA菌株清除作用减弱。腹膜炎动物感染模型研究发现,MRSA菌株的MIC值仅轻微升高即可导致糖肽类药物的杀菌作用明显减弱,与MIC<1 mg/L的MRSA菌株相比,MIC值为2 mg/L的MRSA菌株细菌清除所需要中位时间明显延长[8]。其次,研究发现异质性万古霉素中介的金葡菌(hVISA)在高MIC值MRSA菌株中的检出率明显高于低MIC值,而hVISA与MRSA感染的临床治疗失败明显相关[9]。再则,万古霉素是时间依赖性抗菌药物,药动学参数AUC/MIC比值大于400与MRSA感染治疗成功明显相关。但当MIC值为2 mg/L时,即使万古霉素的血药谷浓度维持在15~20 mg/L,AUC/MIC比值也难以达到400,导致万古霉素临床治疗失败[10]。
本研究进一步发现,HAP中高MIC值MRSA菌株感染可能与万古霉素治疗前90 d内有MRSA感染史、万古霉素使用史等因素相关,排除相关影响因素后发现,万古霉素治疗前90 d内有MRSA感染史是HAP中高MIC值MRSA菌株感染的独立危险因素。因此在临床治疗中,对于有上述高危因素的患者在发生MRSA HAP时需及时检测万古霉素对MRSA菌株的MIC值,当MIC>1 mg/L时,应观察患者对万古霉素的临床及微生物反应来决定是否继续使用万古霉素[11];如果临床分离菌株的MIC>2 mg/L时,应考虑选择其他覆盖MRSA的抗菌药物替代治疗[12-13]。
本研究仍存在一些缺陷:样本选择可能存在偏倚;纳入研究的患者较少,可造成部分统计结果无意义;另外,部分患者存在多种细菌感染可能会影响临床治疗结果;再者,虽然根据指南进行合理剂量及疗程的万古霉素治疗,但仅有少数患者进行了万古霉素药物浓度监测,部分患者可能由于血药浓度未达标影响治疗结果。因此,仍需排除其他干扰因素并扩大样本量进一步研究。
综上所述,本研究发现高MIC值患者万古霉素应用3 d后临床治疗无效率、万古霉素应用7 d后病原菌未清除率及终止万古霉素治疗后28 d内MRSA肺炎复发率均高于低MIC值患者;万古霉素治疗前90 d内MRSA感染史是HAP中高MIC值MRSA菌株感染的独立危险因素。
[1]Haque NZ,Zuniga LC,Peyrani P,et al.Relationship of vancomycin minimum inhibitory concentration to mortality in patients with methicillin-resistantStaphylococcusaureushospital-acquired,ventilator-associated,or health-care-associated pneumonia[J].Chest,2010,138(6):1356-1362.
[2]van Hal SJ,Lodise TP,Paterson DL.The clinical significance of vancomycin minimum inhibitory concentration inStaphylococcusaureusinfections:a systematic review and meta-analysis[J].Clin Infect Dis,2012,54(6):755-771.
[3]Cruciani M,Gatti G,Lazzarini L,et al.Penetration of vancomycin into human lung tissue[J].J Antimicrob Chemother,1996,38(5):865-869.
[4]American Thoracic Society;Infectious Diseases Society of America.Guidelines for the management of adults with hospital-acquired,ventilator-associated,and healthcare-associated pneumonia[J].Am J Respir Crit Care Med,2005,171(4):388-416.
[5]Soriano A,Marco F,Martinez JA,et al.Influence of vancomycin minimum inhibitory concentration on the treatment of methicillin-resistantStaphylococcusaureusbacteremia[J].Clin Infect Dis,2008,46(2):193-200.
[6]Choi EY,Huh JW,Lim CM,et al.Relationship between the MIC of vancomycin and clinical outcome in patients with MRSA nosocomial pneumonia[J].Intensive Care Med,2011,37(4):639-647.
[7]Lodise TP,Graves J,Evans A,et al.Relationship between vancomycin MIC and failure among patients with methicillinresistantStaphylococcusaureusbacteremia treated with vancomycin[J].Antimicrob Agents Chemother,2008,52(9):3315-3320.
[8]Domenech A,Ribes S,Cabellos C,et al.A mouse peritonitis model for the study of glycopeptide efficacy in GISA infections[J].Microb Drug Resist,2004,10(4):346-353.
[9]Bae IG,Federspiel JJ,Miro JM,et al.Heterogeneous vancomycin-intermediate susceptibility phenotype in bloodstream methicillin-resistantStaphylococcusaureusisolates from an international cohort of patients with infective endocarditis:prevalence,genotype,and clinical significance[J].J Infect Dis,2009,200(9):1355-1366.
[10]Kullar R,Davis SL,Levine DP,et al.Impact of vancomycin exposure on outcomes in patients with methicillin-resistantStaphylococcusaureusbacteremia:support for consensus guidelines suggested targets[J].Clin Infect Dis,2011,52(8):975-981.
[11]Liu C,Bayer A,Cosgrove S E,et al.Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistantStaphylococcusaureusinfections in adults and children[J].Clin Infect Dis,2011,52(3):e18-e55.
[12]Dhand A,Sakoulas G.Reduced vancomycin susceptibility among clinicalStaphylococcusaureusisolates('the MIC Creep'):implications for therapy[J].F1000 Med Rep,2012,4:4.
[13]Wunderink RG,Mendelson MH,Somero MS,et al.Early microbiological response to linezolid vs vancomycin in ventilator-associated pneumonia due to methicillin-resistantStaphylococcusaureus[J].Chest,2008,134(6):1200-1207.

